
- •Энергетический обмен
- •3 Этапа аэробного катаболизма (тканевого дыхания):
- •Цепь переноса электронов (цпэ).
- •Структурная организация цепи переноса электронов (цпэ).
- •Компоненты цпэ:
- •Этапы цпэ:
- •I ферментный комплекс: nadh-дегидрогеназа.
- •III Ферментный комплекс qh2-дегидрогеназа (убихинолдегидрогеназа) – сложный олигомерный белок, включающий 2 протомера: цитохром b и цитохром с1.
- •IV Ферментный комплекс – цитохромоксидаза (цитохром-c-оксидаза).
- •2 Протомера-гемопротеина: цитохром a и цитохром a3, каждый из которых содержит центр связывания с o2.
- •Использование энергии цпэ для синтеза атф.
- •Дыхательный контроль
- •Ингибиторы цпэ.
- •Разобщение тканевого дыхания и окислительного фосфорилирования.
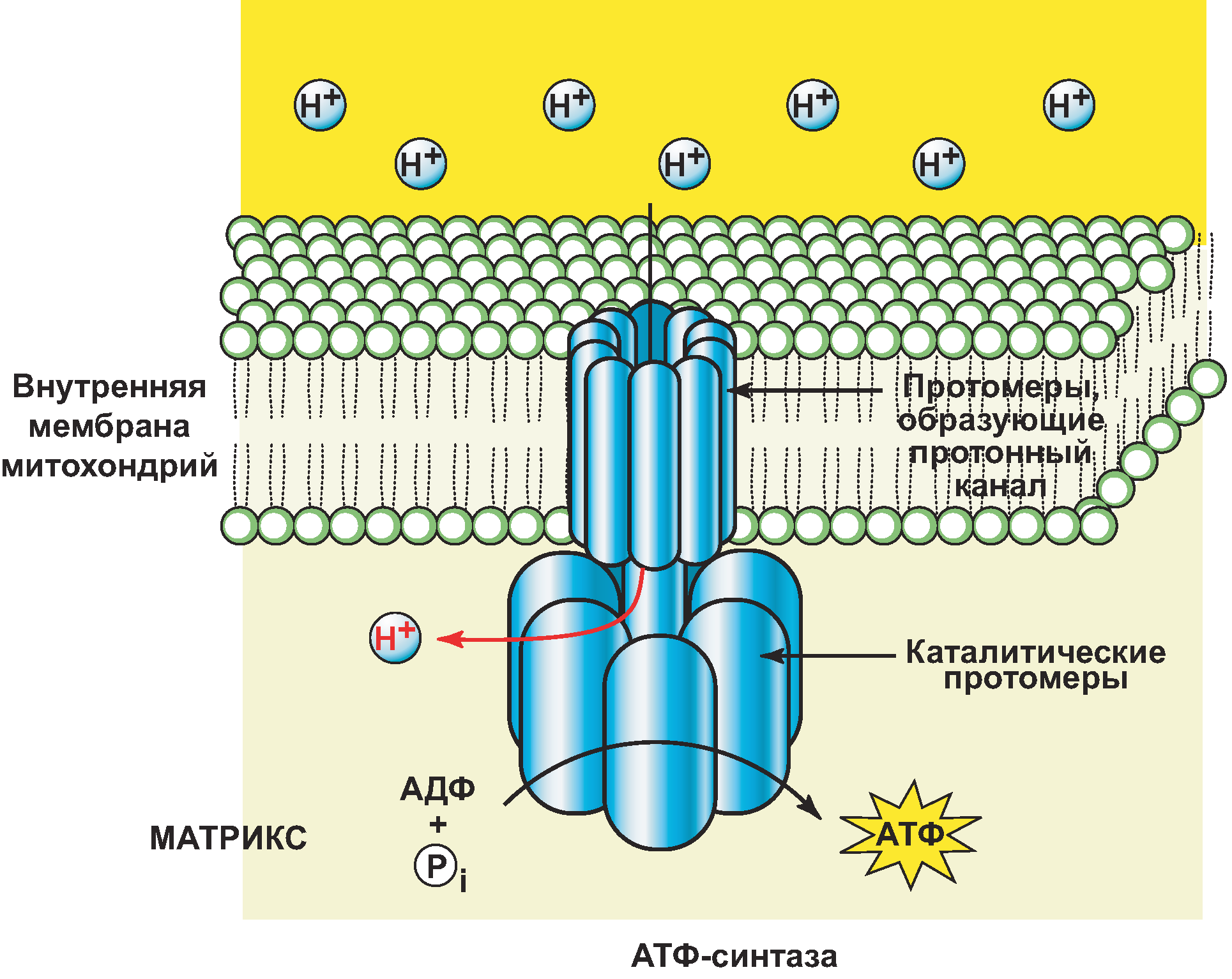
Использование энергии цпэ для синтеза атф.
Хемиосмотическая теория П. Митчелла, которая объясняет механизмы сопряжения процессов биологического окисления и фосфорилирования АДФ:
При движении от окисляемого субстрата к кислороду электроны теряют часть своей потенциальной энергии.
Комплексы (I, III и IV) внутренней мембраны митохондрий используют эту энергию электронов для переноса H+ из матрикса в межмембранное пространство митохондрий против градиента концентрации.
Т.е. комплексы ЦПЭ (I, III и IV) работают как протонные насосы, перекачивая H+ из матрикса в межмембранное пр-во митохондрий за счет энергии переноса электронов по ЦПЭ.
В результате возникает градиент концентрации H+ и градиент «+» заряда – протонный электрохимический потенциал (H+).
При накоплении в межмембранном пространстве достаточного кол-ва H+, происходит их присоединение к ферменту = изменяется заряд и конформация фермента.
Это приводит к раскрытию протонного канала АТФ-синтазы = H+ переносятся в матрикс по градиенту концентрации.
Это приводит к активации поверхностной части фермента, кот. катализирует синтез АТФ:
АДФ + H3PO4 АТФ + H2O
Было установлено, что при переносе электронов через поверхностную часть АТФ-синтазы происходит её вращение по кругу.
И каждый поворот на 120 приводит к синтезу 1 молекулы АТФ.
! Окислительное фосфорилирование – это способ синтеза АТФ из АДФ и неорганического фосфата с использованием энергии протонного электрохимического потенциала (H+), который образуется за счет переноса электронов по ЦПЭ.
Количество АТФ, которое образуется в результате сопряжения работы ЦПЭ и АТФ-синтазы, оценивается с помощью коэффициента фосфорилирования.
Коэффициент окислительного фосфорилирования (Р/О) показывает, какое количество неорганического фосфата затрачивается для фосфорилирования АДФ при использовании 1 атома кислорода на образование 1 молекулы воды.
! Коэффициент окислительного фосфорилирования численно равен количеству моль АТФ, синтезированных в результате окислительной реакции.
Энергия электронов и протонов, перенесенных комплексами ЦПЭ (I, III и IV) от субстратов NAD+-зависимых дегидрогеназ, достаточна для активации АТФ-синтазы и синтеза 3 моль АТФ в расчете на 1 моль дегидрируемого субстрата.
Т.е. для всех субстратов NAD+-зависимых дегидрогеназ Р/О 3.
Таким образом, дегидрирование 1 моль любого субстрата NAD+-зависимых дегидрогеназ сопряжено с синтезом 3 моль АТФ.
При дегидрировании веществ с участием FAD-зависимых дегидрогеназ происходит передача протонов и электронов на убихинон без участия комплекса I:
DH2 + E-FAD D + E-FADH2
E-FADH2 + Q E-FAD + QH2
Основной FAD-зависимой дегидрогеназой явл-ся Сукцинатдегидрогеназа.
Это поверхностный белок внутренней мембраны митохондрий (комплекс II).
Сукцинатдегидрогеназа катализирует превращение сукцината в фумарат, являющееся одной из реакций цикла Кребса:
Сукцинат + E-FAD Фумарат + E-FADH2
В этом случае на пути электронов от субстрата на O2 только 2 участка переноса H+ в межмембранное пр-во митохондрий (комплексы III и IV)
Таким образом, энергия электронов и протонов, поступивших в ЦПЭ от субстратов FAD-зависимых дегидрогеназ, достаточна для активации АТФ-синтазы и синтеза 2 моль АТФ в расчете на 1 моль дегидрируемого субстрата.
Т.е. для субстратов FAD-зависимых дегидрогеназ (сукцинат, ацил-KoA, глицерол-3-фосфат): Р/О 2.
Витамин C (аскорбиновая к-та) способна восстанавливать ионы Fe3+ цитохрома c.
П![]() ри
этомFe3+
принимает и переходит в Fe2+.
ри
этомFe3+
принимает и переходит в Fe2+.
На пути электронов от цитохрома c на O2 1 участок переноса H+ в межмембранное пр-во (IV комплекс).
В этом случае Р/О 1.
Коэффициент Р/О показывает только теоретический максимум синтеза АТФ.
На самом деле, для синтеза АТФ используется ~ 40-50% энергии ЦПЭ.
Остальная часть энергии выделяется в виде тепла, а также используется для других видов работ клеток:
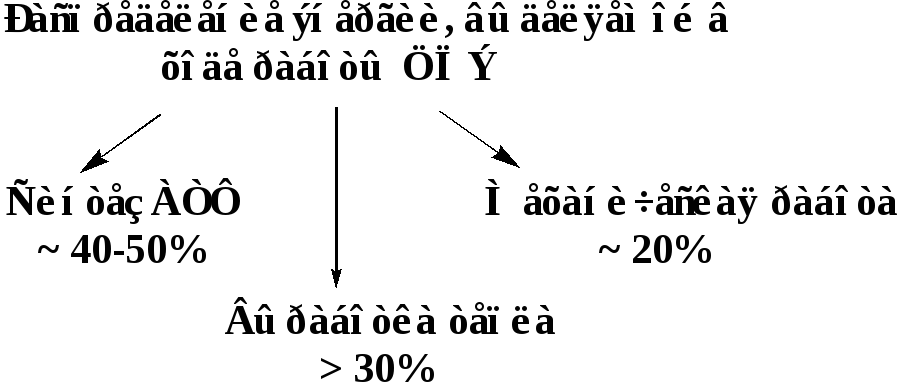
Итак, биологические функции ЦПЭ:
Использует энергию окисления субстратов для синтеза АТФ путём окислительного фосфорилирования;
Обеспечивает поддержание температуры тела человека.
