
Орг химия / 31-38_Soedinenia_azota
.pdf
Преимущество этого метода – это простота, недостаток – трудно разделить образующиеся амины, однако для промышленного производства этот метод очень удобен.
2. Перегруппировка Гофмана. При обработке незамещенных амидов карбоновых кислот гипобромитом натрия (смесь брома и гидро-ксида натрия) образуются первичные амины, при этом углеродная цепь укорачивается на один атом:
Этот способ имеет большое значение и дает возможность получать чистые амины.
3. Способ Габриэля. Конденсацией фталимида калия с алкилгалогенидами с последующим гидролизом получают только первичные алифатические амины:
11
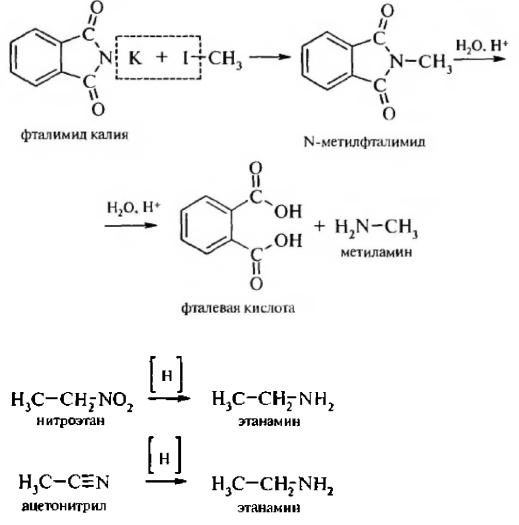
4. При восстановлении нитроалканов и нитрилов образуются первичные амины:
Физические свойства
Низшие амины (метиламин и этил амин) – газы, с увеличением количества атомов углерода – жидкости, высшие амины – твердые вещества. Они обладают аммиачным запахом, а также запахом соленой сельди.
Низшие амины хорошо растворимы в воде, с увеличением молекулярной массы растворимость снижается, а высшие амины не растворимы в воде.
12

34) ХИМИЧЕСКИЕ СВОЙСТВА АЛИФАТИЧЕСКИХ АМИНОВ
Реакционная способность алифатических аминов определяется наличием у атома азота неподеленной пары электронов, которая обуславливает то, что амины активно выступают в роли нуклеофилов, а также являются сильными органическими основаниями.
Основность. Являясь производными аммиака, алкиламины подобно аммиаку проявляют ярко выраженные основные свойства, которые обусловлены способностью атома азота с неподеленнои электронной парой к присоединению протона с образованием иона замещенного аммония. При этом амины в 10 раз сильнее, чем аммиак. Это связано с изменением электронной плотности на атоме азота.
Алкильные радикалы увеличивают электронную плотность на атоме азота за счет проявления +I-эффекта, что приводит к заметному усилению основности. Поэтому можно предположить, что третичные ал килами ны, имеющие три донорных заместителя, будут более сильным и основаниями, чем вторичные, а вторичные, в свою очередь, более сильными, чем первичные и аммиак:
Такая закономерность изменения основности алкиламинов наблюдается в газовой фазе и в неводных растворах. В водных растворах наряду с электронными эффектами заместителей влияет
исольватационный эффект растворителя.
Врезультате совместного проявления этих двух факторов основность третичных аминов в водных растворах ниже основности первичных и вторичных:
1.Водные растворы алкиламинов имеют щелочную среду:
2.С кислотами алкиламнны образуют соли алкиламмония:
3.Взаимодействие с галогеналканами (реакция алкилирования). См. способы получения
(peaкиия Гофмана).
4.Взаимодействие аминов с ацилирующими реагентами (реакция аицлирования). Первичные и вторичные алкил амины вступаютвреакцию с функциональными производными карбоновых кислот – галогенангидридами, ангидридами и сложными эфирами, образуя N-за мешенные амиды карбоновых кислот:
13

В процессе реакции атом водорода при азоте в молекуле амина замещается на остаток карбоновой кислоты. Третичные амины не содержат при атоме азота водорода и поэтому в реакцию ацилирования не вступают.
5. Взаимодействие с азотистой кислотой. Реакция с HNO2 применяется для идентификации алифатических аминов.
Первичные алкиламины под действием азотистой кислоты превращаются в спирты с выделением азота и воды:
Вторичные алкиламины в реакции с азотистой кислотой образуют N-нитрозоамины:
Третичные амины при обычной температуре с азотистой кислотой не реагируют:
6. Изонитрилъная реакция. Специфическая реакция обнаружения первичных аминов. При нагревании первичных алкиламинов с хлороформом в присутствии щелочи в спиртовой среде образуются изонитрилы (изоцианиды):
Изонитрилы имеют очень неприятный запах. Эта реакция очень чувствительна.
7. Реакция окисления. Первичные алкиламины при окислении озоном образуют нитроалканы:
Под действием сильных окислителей первичные алифатические амины образуют смесь вешеств, в которой преобладают альдегиды, а вторичные – тетразамещенные гидразины.
14

При окислении третичных аминов действием Н2O2 или пероксикислотами RCOOOH образуются N-оксиды аминов:
N-Оксиды аминов являются биологически активными соединениями.
15

35) НОМЕНКЛАТУРА, ИЗОМЕРИЯ И СПОСОБЫ ПОЛУЧЕНИЯ АМИНЫ АРОМАТИЧЕСКОГО РЯДА (АРИЛАМИНЫ)
Способы получения
1. Восстановление нитросоединений (реакция Зимина).
2. Взаимодействие галагеннроизводных с аммиаком и аминами.
При взаимодействии галогенаренов с ариламиками образуются вторичные и третичные ариламины:
3. Алкилирование первичных ариламинов.
Физические свойства
Ариламины представляют собой бесцветные высококипящие жидкости или твердые кристаллические вещества со слабым неприятным запахом. Мало растворимы в воде, сильно токсичны, окисляются кислородом воздуха, из-за чего при хранении приобретают желтоватую окраску.
16

36) ХИМИЧЕСКИЕ СВОЙСТВА АРОМАТИЧЕСКИХ АМИНОВ
Для ариламинов характерны реакции с участием атома азота и реакции с участием атомов углерода ароматического ядра.
Основность. Ароматические амины обладают основным характером. Однако они слабее, чем амины жирного ряда и даже слабее аммиака.
Снижение основности обусловлено сопряжением неполеленной пары электронов атома азота с π-электронной системой ароматического ядра:
Основные свойства падают в ряду:
Являясь слабыми основаниями, ариламины образуют соли только с сильными минеральными кислотами:
Анилин не образует соли с Н2СО3 На основность ариламинов существенное влияние оказывают заместители в бензольном кольце.
Электронодонорные заместители увеличивают основность, а электроноакиепторные – уменьшают ее.
При переходе от первичных к третичным основность ароматических аминов снижается.
1. Реакция алкилирования. Первичные и вторичные ариламины реагируют с галоген алканам и, образуя N-алкил- и N,N-диалкилариламины. Реакция протекает труднее в виду снижения нуклеофильных свойств атома азота.
17

2. Реакция ацилирования. Первичные и вторичные амины при взаимодействии с хлоран гидридам и или ангидридами карбоновых кислот образуют N-замещенные амиды карбоновых кислот. N-Ацильные производные анилина и его гомологов называют анилидами.
Амиды карбоновых кислот легко гидролизуются в кислой или щелочной среде с образованием исходного амина и карбоновой кислоты:
Способность ацильных производных легко подвергаться гидролизу позволяет применять эту реакцию в органическом синтезе для временной защиты аминогруппы от окисления и протекания по ней нежелательных реакций,
Ацильные производные аминов имеют большое значение как фармацевтические препараты. Например, ацетанилид – это жаропонижающий препарат, который долгое время применялся в медицинской практике, а в настоящее время – в ветеринарии.
3. Реакция образования изоцианидов (качественная реакция). Аналогично алифатическим аминам первичные ароматические амины при нагревании с хлороформом и щелочью в спиртовой среде образуют изоцианиды – вещества с неприятным тошнотворным запахом:
4. Реакция взаимодействия с азотистой кислотой. Алифатические и ароматические амины по-
разному реагируют с азотистой кислотой» эту реакцию можно использовать для отличия первичных, вторичных и третичных аминов алифатического и ароматического рядов.
Первичные ароматические амины при действии азотистой кислоты в присутствии сильной минеральной киапоты образуют соли диа-зония. Эта реакция получила название реакции диазотирования.
18

Вторичные ариламины и N-алкилариламины в этих условиях превышаются BN-нитрозоамины:
Третичные ароматические амины при взаимодействии с азотистой кислотой нитрозируются по бензольному кольцу обычно в пара-положение, если пара-положение занято, то нитрозогруппа занимает орто-подожение:
5. Реакция взаимодействия с ароматическими альдегидами. Первичные ароматические амины реагируют при нагревании с ароматическими альдегидами, образуя азометины (основания Шиффа):
Реакции с участием атомов углерода ароматического ядра
Для ариламинов характерны реакции электрофильного замещения по ароматическому ядру Аминогруппа проявляет +M-эффект и выступает в качестве сильного электронодонора по
отношению к бензольному кольцу, тем самым активируя его в реакциях электрофильного замещения.
6. Реакция галогенирования.
Анилин взаимодействует с бромной водой в отсутствие катализатора, образуя сразу 2,4,6- триброманилин:
19

Для введения хлора в ароматическое ядро требуются особые условия (присутствие НCl, ССl4,
С2Н5ОН, 16 °С).
7. Реакция нитрования. Поскольку аминогруппа чувствительна к действию окислителей, а ее влияние на ароматическое ядро обуславливает сравнительно легкую окисляемость аренаминов до хинонимина, нитрование ароматических аминов проводят предварительно их проацилировав. Это необходимо для защиты аминогруппы, а также для понижения реакционной способности ароматического ядра.
Образовавшееся ацильное производное подвергают гидролизу и выделяют свободные нитроанилины.
8. Реакции сульфирования. При взаимодействии анилина с концентрированной серной кислотой образуется пара-аминобензолсульфокислота, которую чаще называют сульфаниловой кислотой. Реакция протекает через стадию образования N-фенилсульфаминоьой кислоты, которая перегруппировывается впара-шинобензолсул ьфокислоту:
20
