
Орг химия / 1-10_Nomenklatura_svyazi_izomeria
.pdf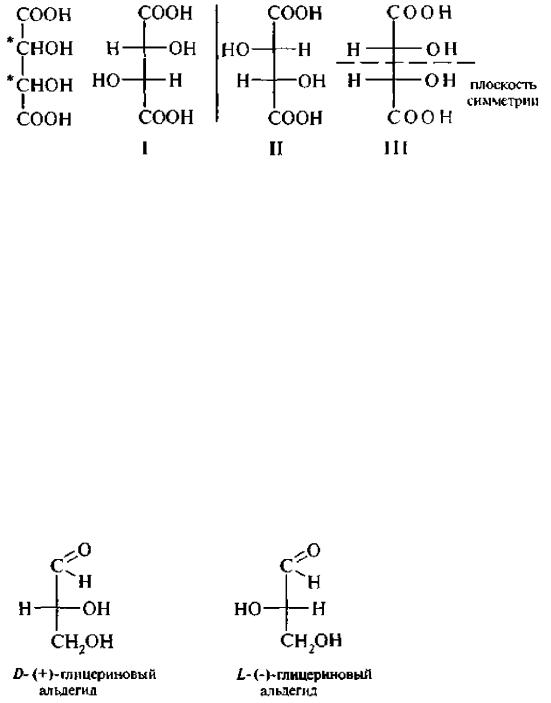
Стереомеры 1 и II являются энантиомерами. Стереоизомер III (мезо-форма) является оптически неактивным. Молекула мезовинной кислоты ахиральна. Каждый энантиомер винной кислоты по отношению к мезо-форме является диастереомером.
Номенклатура оптических изомеров
В номенклатуре наряду с названием соединения указывают также конфигурацию и направление вращения плоскости поляризованного света. Последнее обозначают знаком (+) для правовращающего изомера или знаком (-) для левовращающего изомера.
Для обозначения конфигурации оптических изомеров существуют D,L- и R,S- стереохимические системы.
D,L-система обозначения конфигурации. Установить абсолютную конфигурацию молекул оказалось для химиков довод ьно сложной задачей. Впервые это удалось лишь в 1951 г. методом рентгеноструктур-ного анализа. До этого времени конфигурацию оптических изомеров устанавливали методом сравнения со специально выбранным стандартным веществом. Такая конфигурация получила название относительной. В 1906 г. русским ученым М.А. Розановым в качестве стандарта для установления относительной конфигурации был предложен глицериновый альдегид,
Для правовращающего изомера выбрали формулу Фишера, в которой гидроксильная группа у хирального атома углерода находится справа, а для левоврашаюшего – слева. Конфигурация правовращающего изомера обозначается буквой D а левоврашаюшего – L.
С использованием в качестве эталона сравнения глицеринового альдегида была разработана D,L-система стереохимической классификации хиральных соединений, т. е. отнесения соединений соответственно к D- или L-стереохимическому ряду
D,L-система главным образом применяется в ряду многоатомных спиртов, гидрокси-, аминокислот и углеводов:
31
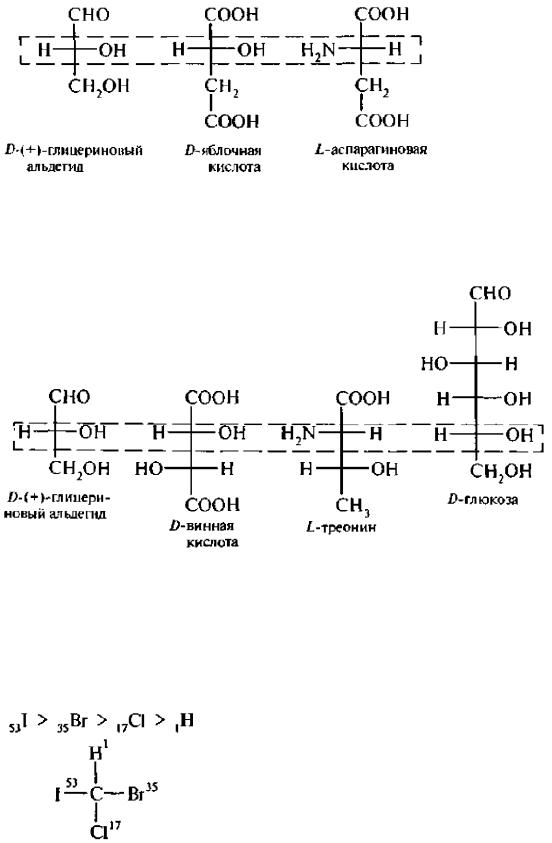
Для соединений с несколькими асимметрическими атомами углерода, таких как α- пироксикислоты, α-аминокислоты, винные кислоты, конфигурацию условно определяют по верхнему асимметрическому атому углерода (по гндроксикислотному ключу), в то время как в молекуле углеводов конфигурацию устанавливают (условно) по нижнему асимметрическому атому углерода.
R,S-система обозначения конфигурации. D,L-система оказалась практически неприемлемой для соединений мало похожих на глицериновый альдегид. Поэтому R Каном, К. Ингольдом и В. Прелогом была предложена R,S-система обозначения абсолютной конфигурации оптических изомеров. R,S-система построена на определении старшинства заместителей у хирального центра.
Старшинство заместителей определяется величинами атомных номеров элементов. Чем больше атомный номер, тем старше заместитель. Например» в молекуле бромйодхлорметана старшинство заместителей уменьшается в ряду:
После установления старшинства заместителей модель молекулы ориентируют так, чтобы заместитель с наименьшим порядковым номером был направлен в сторону, противоположную глазу наблюдателя. Если старшинство трех остальных заместителей убывает по направлению часовой стрелки, то молекула имеет конфигурацию, обозначаемую буквой R (отлат, rectus – правый), а если старшинство заместителей убывает против часовой стрелки, конфигурацию обозначают буквой S (отлат. sinister–левый). Например, для молекулы бромйодхлорметана:
32
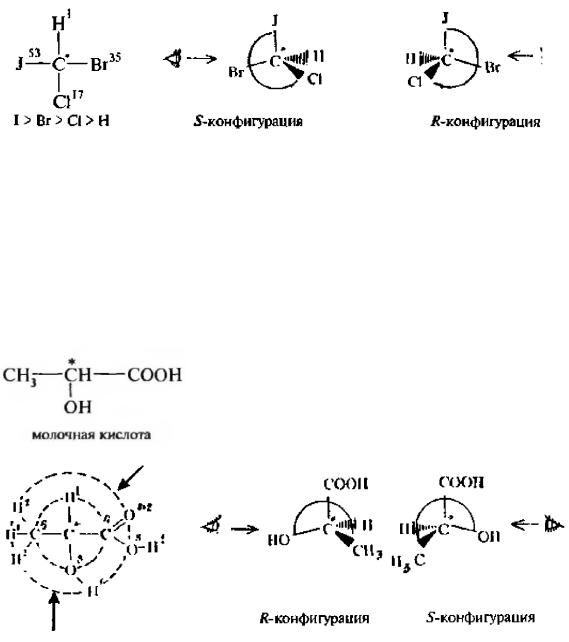
Рис 3,4. Определение конфигурации по R,S-системе для молекулы бромйодхлорметана
Рассмотрим определение старшинства заместителей и конфигурации для более сложных молекул на примере молочной кислоты (рис. 3.4). Уже по первому слою (8O, бС, 1Н, 6С) становится понятно, что старшим заместителем является группа ОН, а младшим – водород. Для выяснения старшинства двух других заместителей СН^ и СООН с одинаковым атомным номером (6С) по первому слою, необходимо рассмотреть второй слой. Сумма атомных номеров второго слоя СН3- группы= 1 + 1 + 1 = 3, а группы СООН = 8 + 8*2 = 24. Значит-СООН-группа старше группы –СН3 Старшинство заместителей вокруг асимметрического атома углерода в молекуле молочной кислоты уменьшается в ряду: ОН > СООН > СН3 > Н
Рис. 3.5. Определение конфигурации по R,S-системе для молочной кислоты
Рацематы. Смесь равных количеств энантиомеров оптически неактивна, ее называют рацемической смесью (рацематом). Рацематы отличаются от индивидуальных энантиомеров физическими свойствами, они могут иметь различную температуру плавления, растворимость; отличаются спектральными характеристиками.
На практике чаще приходится сталкиваться не с индивидуальными энантиомерами, а рацематами, которые образуются в результате химических реакций, протекающих с образованием хиральных молекул.
Для разделения рацематов на энантиомеры пользуются тремя методами:
1.Механический метод. В результате кристаллизации некоторых оптически активных соединений могут образовываться две формы кристаллов, похожих друг на друга как предмет и его зеркальное отображение. Их можно отделить под микроскопом препаративной иглой (механически).
2.Биохимический метод основан на том, что определенные виды микроорганизмов предпочитают одну из энантиомерных форм и поедают ее, вторая остается и может быть легко выделена.
33
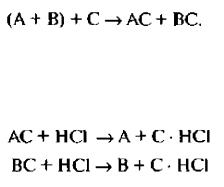
3. Химический метод, В основе химического метода лежит перевод энантиомеров при помощи оптически активных реагентов в диа-стереомеры, которые уже отличаются друг от друга по физическим свойствам. Диастереомеры гораздо легче разделить.
Например, следует разделить рацемическую смесь двух кислот (А+ В), Для этого к смеси добавляют оптически активное основание (С). Между рацемической формой и оптически активным основанием протекает реакния
АС и ВС – это диастереомеры. Они обладают различной растворимостью и методом последовательной кристализации можно выделить два диастереомера отдельно.
Но так как АС и ВС образованы слабой органическом кислотой и основанием, то используют для их разложения минеральные кислоты.
Таким образом получают чистые энантиомеры А и В.
34
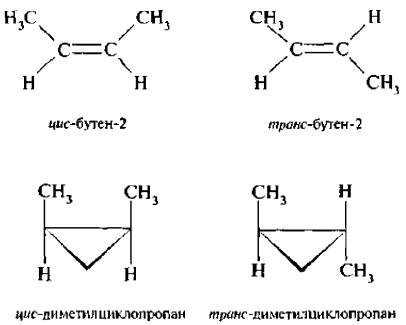
8) ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ
Причиной возникновения геометрической изомерии является отсутствие свободного вращения вокруг σ-связи. Этот вид изомерии характерен для соединений, содержащих двойную связь, и для соединений алициклического ряда.
Геометрические изомеры это вещества, имеющие одинаковую молекулярную формулу, одинаковую последовательность связывания атомов в молекулах, но отличающиеся друг от друга различным расположением атомов или атомных групп в пространстве относительно плоскости двойной связи или плоскости цикла.
Причиной возникновения данного вида изомерии является невозможность свободного вращения вокруг двойной связи или σ-связей, образующих цикл.
Например, бутен-2 СН3–СН=СН–СН3 может существовать в виде 2-х изомеров, которые различаются расположениями метильных групп в пространстве относительно плоскости двойной связи.
или 1,2-диметилциклопропан существует в виде двух изомеров, которые различаются расположением метильных групп в пространстве относительно плоскости цикла:
Для обозначения конфигурации геометрических изомеров используют цис-,транс-систему. Если одинаковые заместители расположены по одну сторону от плоскости двойной связи или цикла – конфигурацию обозначают цис-. если по разные стороны – транс-.
Для соединений, у которых при атомах углерода с двойной связью находятся различные заместители, применяют Z,E-систему обозначений.
Z,E-система является более обшей. Она применима к геометрическим изомерам с любым набором заместителей. В основе этой системы лежит старшинство заместителей, которое определяют у каждого атома углерода отдельно. Если старшие заместители из каждой пары расположены по одну сторону от двойной связи, конфигурация обозначается буквой Z(от нем. zusammen – вместе), если по разные стороны – буквой £(от нем. entgegen – напротив).
Так для 1-бром-1-хлорпропена возможно два изомера:
35
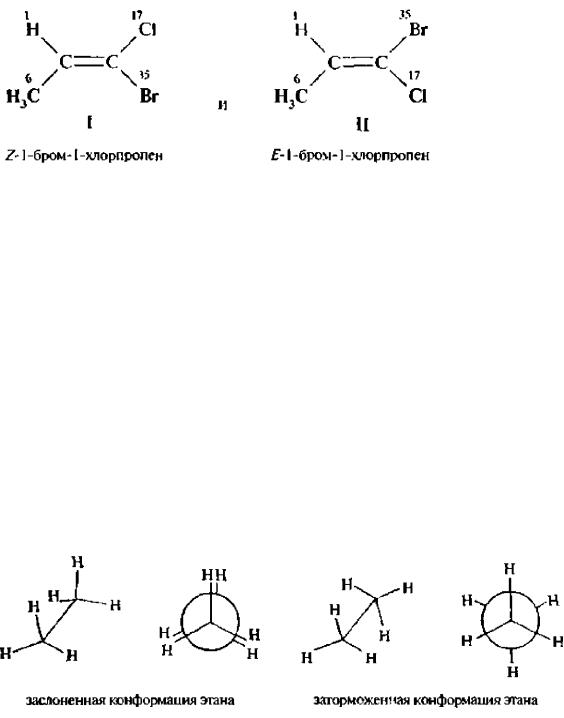
Старшим заместителем у одного атома углерода является метильная группа (заместители 1Н и 6СН3). а у другого – атом брома (заместители 17Сl и 35Вr). В изомере 1 старшие заместители расположены по одну сторону от плоскости двойной связи, ему приписывают Z-конфигурацию, а изомеру II Е-конфигурацию (старшие заместители расположены по разные стороны плоскости двойной связи).
Геометрические изомеры имеют разные физические свойства (температуру плавления и кипения, растворимость и т. д.), спектральные характеристики и химические свойства. Такое различие в свойствах позволяет довольно легко установить их конфигурацию с помощью физических и химических методов.
9) КОНФОРМАЦИОННАЯ ИЗОМЕРИЯ
Конформанионная (поворотная) изомерия обусловлена вращением атомов или атомных групп вокруг одной или нескольких простых σ-связей. В результате вращения вокруг С–С-связей молекулы могут иметь различные пространственные формы, которые называют конформациями.
Например, молекула этана вследствие врашения вокруг углерод-углеродной связи может принимать бесконечное множество конформаций. каждая из которых характеризуется определенным значениемпотенциальной энергии. Две крайние конформации называют
заслоненной и заторможенной.
Для представления конформаний на плоскости используют формулы Ньюмена и перспективные формулы.
В заслоненной конформации этана атомы водорода метильных групп, если смотреть вдоль связи углерод-углерод, расположены друг за другом, В заторможенной – атомы водорода одной метильной группы максимально удалены от атомов водорода другой. Между заслоненной и заторможенной конформацией молекула в процессе вращения принимает множество скошенных
конформаций.
Каждая из конформаций молекулы этана характеризуется различной потенциальной энергией. Заслоненная конформация имеет максимальную энергию, а заторможенная – минимальную.
Энергетическая равноценность различных конформаций объясняется существованием в молекуле так называемого торсионного напряжения (напряжения Питцера), которое обусловлено взаимодействием (отталкиванием) электронных облаков противостоящих связей. В
36
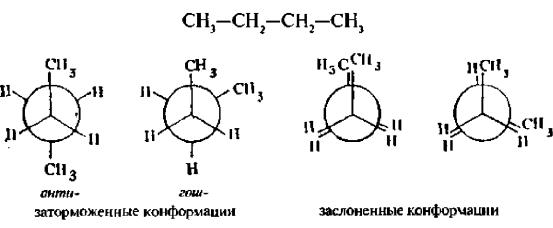
заслоненной конформаиии противостоящие связи максимально сближены, поэтому взаимодействие между ними наибольшее. Разность энергий заслоненной и заторможенной конформаций называется энергетическим барьером вращения. Для этана энергетический барьер невелик, он составляет около 12 кДж/моль и легко преодолевается молекулой при обычных температурах за счет энергии теплового движения.
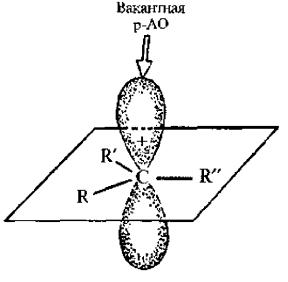
При вращении вокруг С2–С3 связи в н-бутане возможны четыре крайние конформаций, из которых две заторможенные и две заслоненные:
Заторможенная конформация. в которой метильные группы (объемные заместители) максимально удалены друг от друга, получила название анти-конформаиии. Другая заторможенная конформация называется гош-конформаиией.
Заторможенная гош-конформация обладает несколько большей потенциальной энергией (за счет метил-метильного взаимодействия), чем анти-конформация (в ней взаимодействие между метилами вообще отсутствует).
Хотя в молекуле н-бутана существует свободное вращение вокруг центральной С–С связи, однако в каждый момент времени большая часть молекул представлена наиболее энергетически выгодной конформацией.
Конформации с наименьшим запасом энергии называют конформерамн или
конформационными (поворотными) изомерами.
Так, н-бутан при 25 *С существует примерно на 70 % в форме анти-конформера и на 30 % гош-конформера.
В отличие от конфигурационных изомеров, конформеры превращаются друг в друга без разрыва химических связей и не поддаются разделению. Они обнаруживаются только физикохимическими методами.
37
10) КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ И РЕАГЕНТОВ
Наиболее широко в органической химии используют классификацию химических реакций, основанную на представлениях об их механизме. Учитывается способ разрыва химической связи, природа интермедиатов, природа реагента и другие факторы.
В соответствии со способом разрыва связи реакции делятся на гемолитические (симметричный разрыв двухэлектронной ковалентной связи с
образованием двух свободных радикалов A·|·В → А· + В·),
гетеролитические (несимметричный разрыв связи, приводящий к появлению двух частице противоположными зарядами A:|В → А– + В+) и
перициклические (молекулярные).
По природе интермедиатов реакции могут быть ионными, радикальными и др.
Ионные реакции осуществляются при участии заряженных частиц. К этому же типу относятся многие органические реакции, интермедиатами в которых являются карбкатионы или карбанионы, образующиеся в результате гетеролитического распада исходных веществ,
Карбкатионами называют органические катионы, содержащие положительно заряженный атом углерода. Атом углерода в карбкатионе, несущий положительный заряд, находится в sp2- гибридном состоянии: три его σ-связи расположены в одной плоскости, а p-атомная орбиталь является вакантной.
Карбанионами называют органические анионы, содержащие отрицательно заряженный атом углерода, т. е. трехвалентный атом углерода с неподеленной парой электронов,
Неподеленная пара электронов находится нa sp3-гибридизованной атомной орбитали в случае карбанионов ряда алкинов, а карбанионы, в которых неподеленная пара электронов сопряжена с кратной связью, содержат эту пару электронов на p-атомной орбитали.
Радикальные реакции протекают с участием свободных радикалов.
Свободными радикалами называют незаряженные частицы, содержащие неспаренный электрон (одноэлеклронную атомную орбиталь).
Неспаренный электрон может находиться на sp3-гибридизованной атомной орбитали или на p- атомной орбитали. В зависимости от этого свободный радикал может иметьтетраэдрическое или плоское строение.
38
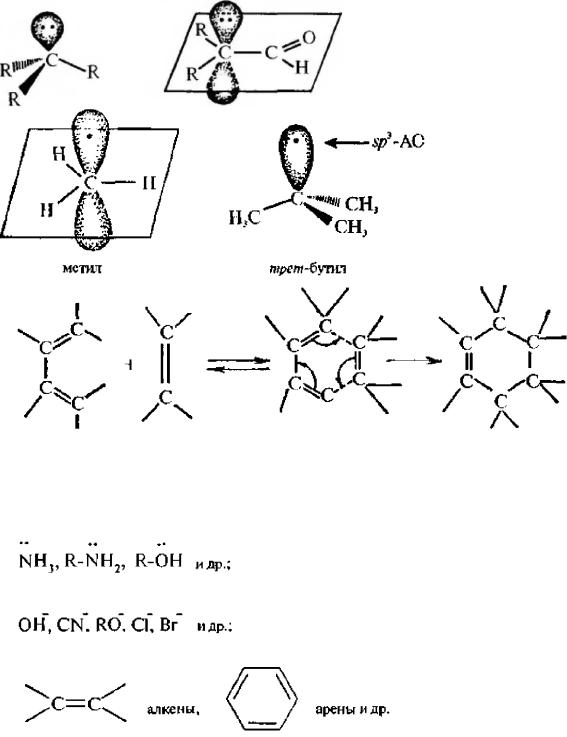
Плоское строение имеют простые алкильные радикалы (неспаренный электрон находится нарАО).
Третичные алкильные радикалы имеют тетраэдрическое строение (неспаренный электрон занимает sp3-гибридную орбиталь).
Периииклические реакции протекают без образования промежуточных активных частиц, в таких реакциях происходит синхронный разрыв старых и образование новых химических связей.
Например:
Реакции, протекающие по ионному механизму, делят на нуклеофильные и электрофильные в зависимости от природы атакующего реагента.
Нуклеофнльными называют реагенты, которые предоставляют электронную пару для образования химической связи с субстратом. К нуклеофильным реагентам относятся: молекулы, содержащие хотя бы одну неподеленную пару электронов,
ионы, несушие отрицательный заряд (анионы).
молекулы, имеющие центры с повышенной электронной плотностью,
Нуклеофилы способны образовывать ковалентную связь с субстратом, атакуя в его молекуле центры с пониженной электронной плотностью.
Электрофильными называют реагенты, принимающие электронную пару от субстрата при образовании с ним химической связи. К электрофильным реагентам относят катионы (Н+, NO2+,
39
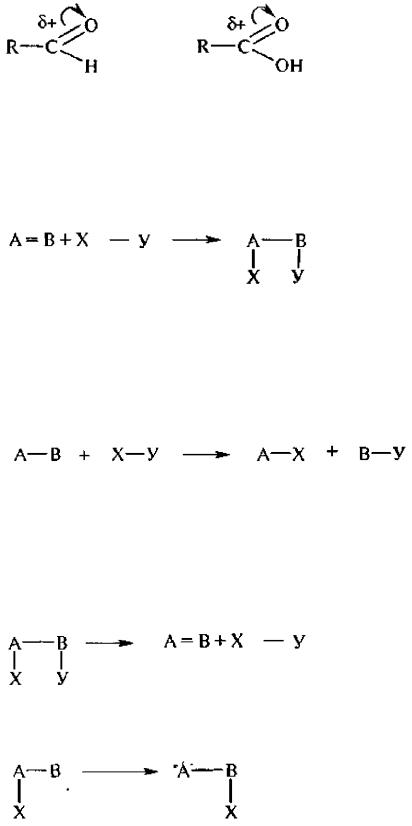
Cl+ и др.), нейтральные молекулы, имеющие вакантную орбиталь (АlСl3, FeBr3 и др.) или центры с пониженной электронной плотностью,
галогены Сl2, Вr2, I2 (в присутствии кислот Льюиса).
Электрофильные реагенты способны образовывать ковалентную связь с субстратом, атакуя в его молекуле центры с повышенной электронной плотностью.
Заслуживает внимания широко используемая в органической химии классификация химических реакций по формальным признакам:
1. Реакции присоединения обозначаются символом «А» (от англ. addition – присоединение).
Эти реакции характерны для соединений, имеющих кратные связи. Реакции присоединения могут протекать по следующим возможным механизмам:
а) электрофильное присоединение (AE);
б) нуклеофильное присоединение (АN);
в) свободнорадикальное присоединение (AR); г) молекулярное (синхронное) присоединение.
2, Реакции замещения обозначаются символом «S» (от англ, substitution – замещение).
Они характерны для всех классов органических соединений и могут протекать по следующим механизмам:
а) электрофильное замешение (SE):
б) нуклеофильное замещение (SN);
в) свободнорадикальное замешение (SR).
3. Реакции отщепления (элиминирования) обозначаются символом «Е» (от англ, elimination – отщепление)
Реакции отщепления характерны для галогенопроизводных углеводородов, спиртов, гетерофункциональных карбоновых кислот (галогено-. гидрокси-, аминокислот).
4. Перегруппировки.
Происходит переход (миграция) отдельных атомов или групп атомов от одного фрагмента молекулы к другому.
5. Реакции окисления и восстановления. Сопровождаются изменением степени окисления атома углерода, являющегося реакционным центром. Механизм реакции окисления органических веществ достаточно сложен.
40
