
Орг химия / 1-10_Nomenklatura_svyazi_izomeria
.pdf
Мезомерный эффект обозначают буквой M, а смещение электронной плотности в сопряженной системе – изогнутой стрелкой. По направляющему действию заместителя мезомерный эффект делится на положительный (+М) и отрицательный (–М).
Положительный мезомерный эффект проявляют заместители (электронодонорные атомы или атомные группы), предоставляющих электроны в сопряженную систему, т. е. имеющие неподеленные пары электронов или отрицательный заряд:
Максимальный +М у атомов с отрицательным зарядом. Заместители, содержащие неподеленные пары электронов, имеют тем больше +М, чем меньше в пределах периода электроотрицательность атомов, содержащих неподеленные пары электронов.
Отрицательный мезомерный эффект проявляют заместители, смещающие на себя электронную плотность сопряженной системы:
Максимальный –М проявляют заместители, несущие положительный заряд. В ненасыщенных группировках –М-эффект возрастает с увеличением разности электроотрицательности атомов кратной связи.
Рассмотрим несколько примеров проявления мезомерного эффекта:
21

Мезомерный эффект по сравнению с индуктивным вызывает более сильное смещение электронной плотности и практически не затухает.
Совместное проявление индуктивного и мезомерного эффектов заместителя
Мезомерный и индуктивный эффекты одного заместителя могут совпадать и не совпадать по
направлению. Например, в молекуле акролеина альдегидная группа |
проявляет –I и – |
M, а гидроксильная группа в молекуле фенола обладает –I, но +M-эффектом, |
|
Как видно из приведенного примера, в молекуле фенола противоположное электронное смешение приводит к тому, что эти два эффекта как бы «гасят» друг друга. А в молекуле акролеина индуктивный и мезомерный эффекты усиливают друг друга. Мезомерный эффект заместителя обычно больше, чем индуктивный, так как л-связи поляризуются легче, чем σ-связи.
Поляризация, обусловленная мезомерным эффектом, имеет альтернирующий характер: под влиянием заместителя смешаются не только π-электронные облака, но и облака σ-связей. Это явление наблюдается в системах с открытой и замкнутой цепью сопряжения:
22

Хотя аминогруппа проявляет –I-эффект, вызывает понижение электронной плотности на всех атомах углерода ароматического цикла, но за счет +M-эффекта пары электронов атома азота, который больше –I в целом наблюдается повышение электронной плотности на атомах углерода бензольного кольца, особенно в положениях 2. 4. 6. Происходит альтернирующая поляризация.
В молекулах с открытой цепью сопряжения обычно указывают частичные заряды, которые сосредоточены на концах сопряженной системы:
Эффект сверхсопряжения (гиперконъюгация). Наряду с π,π- и р,π-сопряжением имеет место особый вид сопряжения – гиперконъюгация (сверхсопряжение) или σ,π-сопряжение.
Эффект сверхсопряжения – взаимодействие, которое возникает при перекрывании электронного облака о-орбиталей связи С–Н с π-орбиталями кратной связи. Такой вид перекрывания электронных облаков представляет собой σ,π-сопряжение, которое присутствует как в алифатическом, так и в ароматическом ряду соединений. Смешение электронов при этом изображают с помощью изогнутой стрелки. Любая из σ-связей метильной группы пропена может участвовать в σ,π-сопряжении.
Рис. 2.10. Схема перекрывания σ-орбиталей связи С–Н с π-орбиталью кратной связи в молекуле пропена
Величина эффекта гиперконъюгации тем выше, чем больше атомов водорода при углероде, связанном с ненасыщенной системой. Понятие о сверхсопряжении объясняет повышенную реакционную способность, подвижность α-водороцных атомов в молекулах альдегидов, кетонов, кислот и их производных. Иногда сверхсопряжение называют по имени открывших его ученых эффектом Натана – Бекера.
23
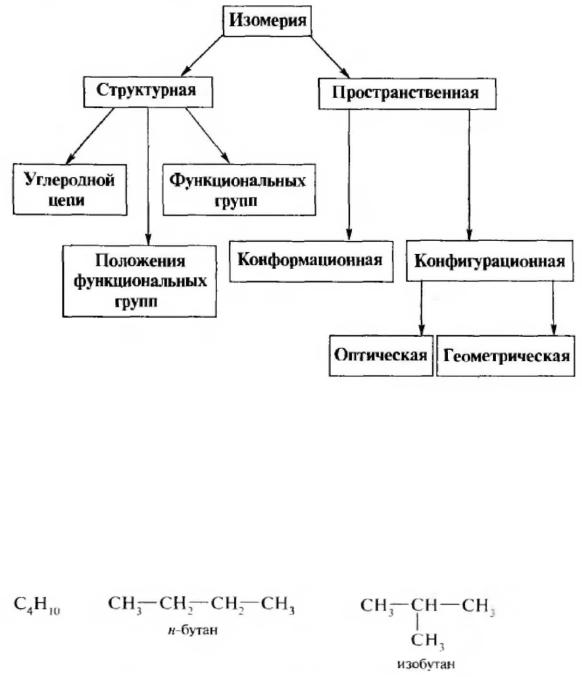
6) ИЗОМЕРИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИИ. ПРОСТРАНСТВЕННОЕ
СТРОЕНИЕ МОЛЕКУЛ
Термин изомерия (от греч. isos – одинаковый, meros – часть) впервые был введен в 1830 г., когда стали известны вещества, имеющие одинаковый качественный и количественный состав, но обладающие различными физическими и химическими свойствами.
Изомерия – это явление, заключающееся в существовании соединений, имеющих одинаковую молекулярную формулу, но различающихся порядком связывания атомов в молекуле или расположением атомов в пространстве, и вследствие этого различающихся по физическим и химическим свойствам
Такие соединения называются изомерами. Различают два основных вида изомерии – структурную (изомерия строения) и пространственную (стереоизомерия).
СТРУКТУРНАЯ ИЗОМЕРИЯ Структурные изомеры – это соединения, имеющие одинаковую молекулярную формулу, но
отличающиеся друг от друга порядком связывания атомов в молекуле.
Структурная изомерия подразделяется на изомерию углеродной цепи, изомерию положения и изомерию функциональных групп.
Изомерия углеродной цепи. Обусловлена различной последовательностью связывания атомов, образующих углеродный скелет молекулы. Например, для алкана состава С4Н10 можно написать два изомера;
Для органических соединений циклического строения изомерия цепи может быть вызвана величиной цикла.
24
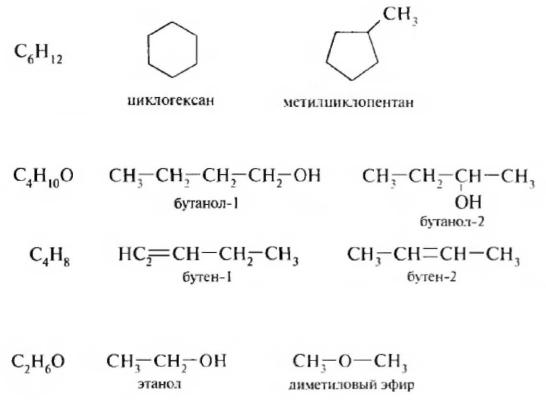
Изомерия положения обусловлена разным положением функциональных групп, заместителей пли кратных связей в молекуле.
Изомерия функциональных: групп обусловлена присутствием в изомерах одинакового состава различных по природе функциональных групп.
ПРОСТРАНСТВЕННАЯ ИЗОМЕРИЯ (СТЕРЕОИЗОМЕРИЯ)
Пространственные изомеры – это соединения, имеющие одинаковую молекулярную формулу, одинаковый порядок связывания атомов в молекуле, но отличающиеся друг от друга расположением атомов в пространстве.
Пространственные изомеры называют также стерео изомерам и (от греч. stereos – пространственный).
Пространственная изомерия подразделяется на конфигурационную и конформационную.
Но прежде, чем перейти к рассмотрению этих видов стереоизомерии, остановимся на способах изображения пространственного строения молекул органических соединений.
Для изображения пространственного строения молекул, их конфигурации или конформаиии используют молекулярные модели и специальные стереоформулы.
Молекулярные модели – наглядное изображение молекул органических и неорганических соединений, позволяющее судить о взаимном расположении атомов, входящих в состав молекулы.
Наиболее часто используют три основных типа моделей: шаростержневые (модели Кекуле
– Вант – Гоффа), скелетные (модели Драйдин-га) и полусферические (модели Стюарта – Бриглеба), Модели позволяют судить не только о взаимном расположении атомов в молекуле, но они удобны и для рассмотрения валентных углов и возможности вращения вокруг простых связей. Модели Драйдинга учитывают и межатомные расстояния, а модели Стюарта – Бриглеба отражают и объемы атомов. Ниже на рисунке приведены модели молекул этана и этилена.
25

Рис. 3.1. Модели молекул этана (слева) и этилена (справа); а – шаростержневые; б – Драйдинга; в – полусферические (Стюарта – Бриглеба)
Стереоформулы. Для изображения пространственного строения молекулы на плоскости чаще всего используют стереохимические и перспективные формулы, а также проекционные формулы Ньюмена.
В стереахимических формулах химические связи, расположенные в плоскости чертежа, изображают обычной чертой; связи, находящиеся над плоскостью – жирным клином или жирной чертой, а расположенные псщ плоскостью – штриховым клином или пунктирной линией:
Перспективные формулы описывают пространственное строение на плоскости с учетом рассмотрения молекулы вдоль одной из углерод-углеродных связей. По внешнему виду они напоминают лесопильные козлы:
26

При построении проекционных формул Ньюмена молекулу рассматривают в направлении одной С–С-связи таким образом, чтобы атомы, образующие данную связь, заслоняли друг друга. Из выбранной пары ближний к наблюдателю атом углерода изображают точкой, а дальний – окружностью. Химические связи ближнего атома углерода с другими атомами представляют линиями, берущими начало отточки в центре круга, а дальнего – от окружности:
Существуют проекционные формулы Фишера, которые применяют обычно для изображения на плоскости пространственного строения оптических изомеров.
Рассмотрим получение проекционной формулы Фишера для бутанола-2 (СН3–СН(ОН)–СН2– СН3). Для этого модель молекулы располагают таким образом, чтобы атом углерода, связанный с гидро-ксильной группой находился в плоскости чертежа, а заместители, расположенные горизонтально, были над плоскостью, расположенные вертикально – за плоскостью чертежа. При проецировании такой модели на плоскость получают проекционную формулу Фишера, в которой связи, находящиеся над плоскостью, изображают горизонтальной линией, а связи, находящиеся за плоскостью, – вертикальной линией. В точке пересечения этих линий находится атом углерода, который обычно не обозначается символом:
27

7) ОПТИЧЕСКАЯ ИЗОМЕРИЯ КОНФИГУРАЦИОННАЯ ИЗОМЕРИЯ (оптическая и геометрическая изомерия)
ОПТИЧЕСКАЯ ИЗОМЕРИЯ
В 1815 г. Ж. Био открыл существование оптической активности для органических соединений. Было установлено, что некоторые органические соединения имеют способность вращать плоскость поляризации поляризованного света. Вещества, которые обладают такой способностью, называются оптически активными.
Если луч обычного света, в котором, как известно, электромагнитные колебания распостраняются в разных плоскостях, перпендикулярных к направлению его распространения, пропустить через призму Николя, то выходящий свет будет плоскополяризованным, В таком луче электромагнитные колебания совершаются только в одной плоскости. Эту плоскость называют плоскостью поляризации (рис. 3.2).
При прохождении поляризованного луча света через оптически активное вещество плоскость поляризации поворачивается на определенный угол α вправо или влево. Если вещество отклоняет плоскость поляризации вправо (при наблюдении навстречу лучу), его называют правовращающим, если влево – левоврашаюшим. Правое вращение обозначают знаком (+), левое – знаком (-).
Рис. 3.2. Схема образования поляризованного света и врашения плоскости поляризаиии оптически активным веществом
Оптическую активность измеряют с помощью приборов, называемых поляриметрами. Явление оптической активности распространено среди органических веществ, особенно среди
природных (гидрокси- и аминокислот, белков, углеводов, алкалоидов).
Оптическая активность большинства органических соединений обусловлена их строением. Одной из причин возникновения оптической активности органических молекул является
наличие в их структуре sp3-гибридизированного атома углерода, связанного с четырьмя разными заместителями. Такой атом углерода называется хиральным или асимметрическим. Часто для него применяют более общее название – хиральный центр. В структурных формулах асимметрический атом углерода принято обозначать звездочкой – С*:
28

Соединения, содержащие один асимметрический атом углерода, существуют в виде двух изомеров, относящихся друг к другу как предмет к своему зеркальному отображению. Такие изомеры называются энантиомерами.
Рис. 3.3. Модели энантиомерных молекул бромиодхлорметана
Для изображения пространственного строения оптических изомеров на плоскости могут быть использованы стереохимические формулы. Например, энантиомеры бутанола-2, изображенные с помощью стереохимических формул, имеют следующий вид:
Однако стереохимические формулы не всегда удобны для описания пространственного строения молекул. Поэтому чаше всего оптические изомеры изображают на плоскости с помошью проекционных формул Фишера. Например, так выглядят энантиомеры 2-бромбутана, изображаемые с помошью проекции Фишера.
Энантиомеры очень похожи друг на друга, но тем не менее не тождественны. Они имеют одинаковый состав и последовательность связывания атомов в молекуле, но отличаются друг от друга относительным расположением их в пространстве, т. е, конфигурацией. В том, что эти молекулы разные, легко убедиться при попытке наложения их моделей друг на друга.
Свойство молекул не совмещаться со своим зеркальным изображением называется хиральностью (от греч, cheir– рука), а также молекулы называют хиральными. Наглядным примером могут служить левая и правая руки, которые являются зеркальным отражением друг друга, но вместе с тем их нельзя совместить. Молекулы, которые совместимы со своим зеркальным изображением называют ахиральными.
Хиральность молекул является обязательным условием для проявления веществом оптической активности.
Как установить является ли молекула хиральной? Хиральность молекулы можно легко обнаружить путем построения модели молекулы и модели ее зеркального изображения с последующим их совмещением. Если модели не совмещаются – молекула хиральна, если совмещаются – ахиральна. Такой же вывод можно сделать и на основе стереохимических формул
29

молекул по наличию ил и отсутствию элементов симметрии, так как причиной оптической активности органических соединений является их асимметрическое строение. Поскольку молекула представляет собой трехмерное образование, ее строение можно рассматривать сточки зрения симметрии геометрических фигур. Основным элементами симметрии являются плоскость, центр и ось симметрии. Если в молекуле отсутствует плоскость симметрии, то такая молекула хиральна.
Энантиомеры обладают одинаковыми физическими и химическими свойствами (температура кипения, температура плавления, растворимость, электропроводность и другие константы будут одни и те же), вращают плоскость поляризации поляризованного луча на один и тот же по величине угол, но имеются и различия.
Энантиомеры отличаются знаком вращения, один вращает плоскость поляризации поляризованного луча влево, другой – вправо; они с различной скоростью реагируют с другими хиральными соединениями, а также имеется различие в физиологическом действии. Например, лекарственный препарат левомицин – антибиотик широкого спектра действия. Если его эффективность принять за 100, то правовращающая форма составит только 2 % от эффективности левовращающсй формы.
Если молекула имеет один асимметрический атом, то она существует в виде двух изомеров, если же молекула имеет несколько асимметрических атомов углерода, то число возможных
изомеров увеличивается. Число оптических изомеров определяют по формуле:
N = 2n,
где N – число изомеров; п – число асимметрических атомов углерода.
Так при наличии в молекуле двух асимметрических атомов углерода число изомеров равно 22 = 4, трех – 23 = 8, четырех – 24 = 16 и т. д.
Например, бромяблочная кислота, содержащая два асимметрических атома углерода, существует в виде четырех стереоизомеров (I–IV).
Стереомеры I и II, а также III и IVотносятся друг к другу как предмет и его зеркальное изображение и являются энантиомерами.
Стереоизомеры 1 и III, 1 и IV, а также II и HI, Н и IV не являются зеркальными отображениями друг друга, они отличаются конфигурацией при одном из асимметрических атомов углерода. Такие стереоизомеры называют диастереомерами. В отличие от энантиомеров диастереомеры имеют различные физические и химические свойства.
Для соединений, содержащих два хиральных атома углерода, связанных с одинаковыми заместителями, общее число стереоизомеров уменьшается до трех. Например, винная кислота должна существовать в виде четырех стереоизомеров (22 = 4), а известно лишь три. Это обусловлено появлением у одного из стереоизомеров такого элемента, как плоскость симметрии.
30
