
Орг химия / 11-22_Uglevodorody
.pdf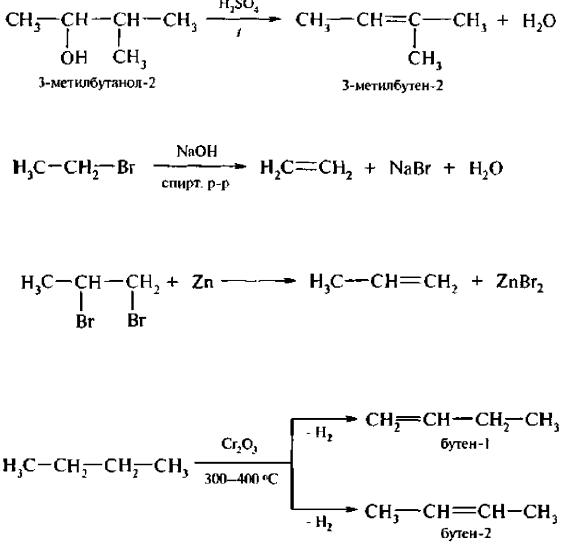
Реакция протекает на границе раздела между твердой фазой и газообразной (гетерогенный катализ).
Отщетение воды от спирта с разветвленной структурой подчиняется правилу А. Зайцева
(1875 г.): при образовании молекулы воды водород отщепляется от наименее гидрогенизированного атома углерода, находящегося в β-положении по отношению к ОНгруппе.
4.Отщепление галогеноводородов от галогеналканов. При действии спиртового раствора щелочи на моногалогенопроизводные отщепляется галогеноводород и образуются алкены.
5.Дегалогенирование дигалогеналканов. Вицинальные дигалогеналканы (с атомами галогена у соседних атомов углерода) при нагревании c Zn или Mg в водноспиртовом растворе отщепляют два атома галогена, образуя алкены:
6.Дегидрирование алканов. Это промышленный метод получения алкенов. Реакцию проводят при температуре не выше 600 °С во избежание разрыва С-С связей (крекинг). В качестве катализатора используют мелкораздробленный никель, оксид хрома (III) Сr2O3 и др.
Физические свойства
Первые представители гомологического ряда алкенов (С2–С4) – это газы, дальше – (C5–С17) жидкости и твердые вешества. С увеличением молекулярной массы увеличивается их температура плавления, температура кипения, удельный вес
Алкены с нормальным строением кипят при более высокой температуре, чем их разветвленные изомеры. Температура кипения цис-изомеров выше, чем транс-изомеров, а температура плавления – наоборот.
Алкены практически нерастворимы в воде, сами являются хорошими растворителями. Они горят более коптящим пламенем, чем алканы, что объясняется большим процентом содержания углерода.
21

16) ХИМИЧЕСКИЕ СВОЙСТВА АЛКЕНОВ
Химические свойства алкенов обусловлены наличием двойной С=С-связи (углеродуглеродной).
Двойная связь значительно короче (0,134 нм) простой σ-связи и прочнее. Энергия этой связи 611 кДж/моль, на разрыв σ-связи приходится 339,6 кДж/моль. тогда энергия разрыва л-связи будет равна: 611 – 339 = 272 кДж/моль, то есть энергия π-связи невелика. Этим объясняется легкость, с которой непредельные углеводороды вступают в реакции присоединения.
В свою очередь двойная связь влияет на реакционную способность связей С–Н у соседнего с ней sp3-гибридизированного атома углерода (α-атом) (благодаря σ,π-сопряжению). Атомы водорода приобретают подвижность и способность вступать в реакции замещения (SR).
Для алкенов характерны также реакции окисления, восстановления и полимеризации.
1.Гидрогенизация (гидрирование) – присоединение водорода протекает в присутствии катализаторов (тонкоизмельченных Pt, Pd или Ni).
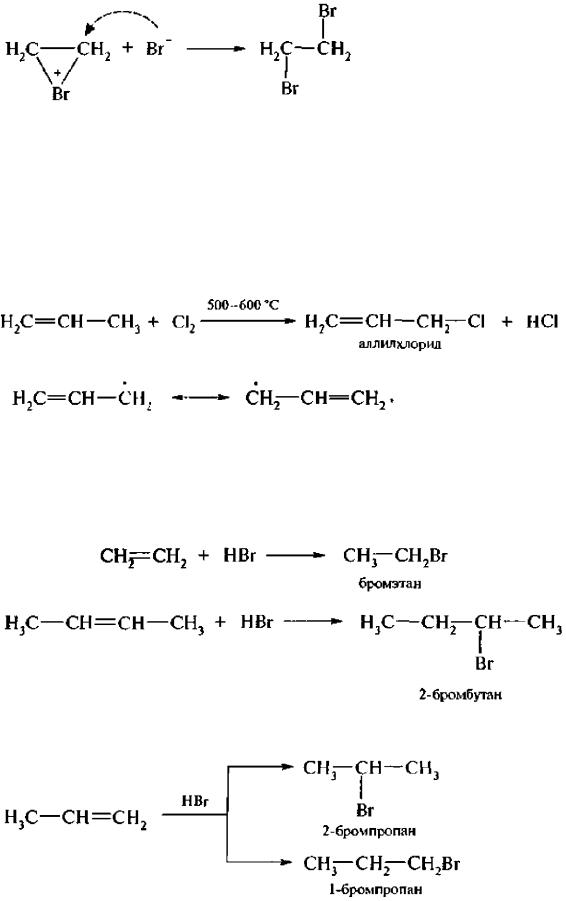
2.Присоединение галогенов (галогенирование). Алкены легко присоединяют хлор и бром, труднее – йод, в результате образуются вицинальные дигалогенопроизводные алканов.
Электронодефицитный атом брома забирает пару электронов π-связи на образование σ-связи с атомом углерода, в результате образуется σ-комплекс:
σ-Комплекс представляет собой равновесную систему, состоящую из карбкатиона и бромонийиона.
Взаимодействие σ-комплекса с бромид-ионом происходит стерео-селективно, то есть бромидион атакует σ-комплекс с противоположной стороны от имеющегося галогена. Такое присоединение называется транс-присоединением.
Присоединение происходит по элекгрофильному механизму – АЕ (присоединение электрофильное). Под влиянием π-электронной плотности двойной связи молекула брома поляризуется, при этом образуется π-комплекс:
22
Эта реакция имеет аналитическое значение для качественного и количественного определения соединений, содержащих двойную углерод-углеродную связь.
Направление реакции галогенирования может изменяться в зависимости от условий реакции. Так, алкены с галогенирующими реагентами (хлором, N-бромсукцин имидом) в присутствии инициаторов процесса образования свободных радикалов (пероксиды, температура, УФ-свет) вступают в реакцию свободнорадикального замещения. При этом атом водорода у атома углерода в α-положении к двойной связи замещается на галоген. Такое замещение получило название аллильного.
Реакция идет через образование аллильных радикалов
которые являются более устойчивыми по сравнению с обычными алкильными.
3. Присоединение галогеноводородов (гидрогалогенирование). Алкены вступают в реакцию присоединения со всеми галогеноводородами, В случае этилена или симметричных алкенов образуется один продукт реакции независимо оттого, к какому атому углерода присоединяется водород или галоген:
Если галогеноводород присоединяется к несимметричному алкену, то во время реакции могут образоваться два продукта, например:
В 1869 г, русский химик В. В. Марковников на основании экспериментальных данных установил закономерность в присоединении галогеноводородов и родственных им соединений к несимметричным алкенам, известную под названием правила Марковникова. Его сущность в следующем:
23

прн взаимодействии галогеноводоров н родственных им соединений с несимметричными алкенами атом водорода присоединяется к более гидрогенизированному атому углерода, т. е. к атому углерода, содержащему большее число атомов водорода.
Это эмпирическое правило, а теперь, используя электронные представления, дадим пояснения к нему.
Направленность присоединения определяется поляризацией алкена в нереагирующем состоянии. Вследствие +I-эффскта и σ,π-сопряжения со стороны алкильных групп π-электронная плотность двойной связи смещена к более гидрогенизированному атому углерода, что определяет наиболее вероятное место присоединения протона.
Кроме того, из двух возможных вариантов присоединения протона преимущественно реализуется тот, при котором в качестве промежуточного продукта присоединения образуется более устойчивый карбкатион:
4. Присоединение воды (гидратация). Гидратация алкенов идет в присутствии минеральных кислот, чаше всего серной, и приводит к образованию спиртов:
Механизм реакции следующий:
24

5.Присоединение гипогалогенных кислот (гипогалогенирование). Гипогалогенные кислоты (HOCl, НОВr, HOI) присоединяются к алкенам по двойной связи с образованием галогенгидринов. Механизм реакции электрофильный:
j
6.Озонирование алкенов. При взаимодействии алкенов с озоном образуются перекисные соединения, которые называются озонидами. При обработке цинком в уксусной кислоте они разрушаются с образованием альдегидов или кетонов в зависимости от строения алкена.
Сопоставляя продукты окисления, можно судить о наличии и положении двойной связи в этиленовом углеводороде.
7. Окисление раствором калия перманганата (реакция Вагнера, 1888г.) – гидроксилирование.
Большое значение имеет реакция окисления алкенов КМnO4, которая известна как реакция Е. Вагнера. При взаимодействии алкенов с разбавленным водным раствором КМnO4 в слабощелочной или нейтральной среде образуются двухатомные спирты (гликоли):
25

Эта реакция является качественной на кратные связи, по обесцвечиванию раствора перманганата калия можно судить о непредельности соединения.
8. Полимеризация алкенов. Полимеризация является важным свойством этиленовых углеводородов. Полимеризация – это образование высокомолекулярных соединений (полимеров) из низкомолекулярных (мономеров) в результате соединения молекул мономера.
Группа –(–СН2-СН2–)--это элементарное звено полимера, то есть элементарный состав полимера не отличается от состава мономера.
26

17) НОМЕНКЛАТУРА, ИЗОМЕРИЯ И СПОСОБЫ ПОЛУЧЕНИЯ АЛКАДИЕНОВ (ДИЕНОВЫЕ УГЛЕВОДОРОДЫ, ДИОЛЕФИНЫ)
Диеновые углеводороды – это углеводороды» содержащие в своей структуре две двойные связи. Общая формула – СnН2n.
Простейшим представителем алкадиенов является аллен, или пропадиен Н2С=С=СН2.
Названия алкадиенов по заместительной номенклатуре ИЮПАК образуют путем прибавления к корню предельного углеводорода суффикса -диен с указанием положения каждой из двойной связи. Например:
Для некоторых алкадиенов сохранились тривиальные названия.
В зависимости от взаимного расположения двойных связей алкадиены делятся на три группы.
1. Алкадиены с кумулированными двойными связями – алленовые углеводороды, В
алленовых углеводородах двойные связи находятся в положении 1,2.
Представителем является аллен.
2. Алкаднены с изолированными двойными связями. Двойные связи отделены друг от
друга двумя и большим числом простых связей.
3. Алкалиены с сопряженными, конъюгяроваиными двойными связями. Двойные связи разделяются одной простой связью. Первым представителем этого ряда является дивинил, или бутадиен-1,3.
Строение алкадиенов
27

Строение алкадиенов с кумулированным и двойными связями рассмотрим на примере аллена. В его молекуле центральный атом углерода находится в sp-гибридизации, а атомы углерода метиленовых групп – в sp2-гибридизации. Все три атома углерода расположены в пространстве линейно, а гг-связи находятся в двух взаимно перпендикулярных плоскостях.
Рис. 9.1. Строение молекулы аллена
В молекулах алкадиенов с сопряженными двойными связями происходит дополнительное перекрывание p-электронных облаков соседних π-связей (π,π-сопряжение) и образуется единая π- электронная система. Ниже (рис. 9.2) показано образование единого π-электронного облака в молекуле бутадиена-1,3.
Рис. 9.2. Строение молекулы аллена
В результате π,π-сопряжения происходит укорачивание σ-связей.
Так, в молекуле бутадиена-1,3 длина связи С2–С3 составляет 0.148 нм, тогда как длина связи С–
Св этане – 0,154 нм. Энергия сопряжения бутадиена-1,3 составляет примерно 15 кДж/моль. Алкадиены с изолированными двойными связями построены аналогично алкенам.
Особенности строения алкадиенов различных типов сказываются на их реакционной способности. Диены с кумулированными и изолированными связями напоминают по химическим свойствам алкены, вступая в реакции присоединения с участием двух двойных связей самостоятельно.
Для сопряженных диенов характерны некоторые особенности в химических свойствах.
АЛКАДИЕНЫ С СОПРЯЖЕННЫМИ СВЯЗЯМИ
Способы получения
1. Каталитическое дегидрированиеалканов и алкенов. Это промышленный метод получения дивинила (бутадиена-1,3) и изопрена (2-ме-тилбутадиена-1,3). Катализаторами реакции являются Сr2О3/А12O3 (смешанный оксидный алюмохромовый катализатор).
28

2. Способ С.В. Лебедева, По этому метолу бутадиен-1,3 получают из этилового спирта путем одновременного каталитического дегидрирования и дегидратации на смешанном цинкалюминиевом катализаторе:
29

18) ХИМИЧЕСКИЕ СВОЙСТВА ДИЕНОВ
Сопряженные диены проявляют ненасыщенный характер. Наличие сопряженной системы в их молекуле приводит к тому, что они присоединяют различные вещества не только по месту одной двойной связи (1,2-присоединения), но и к крайним атомам сопряженной системы с перемещением двойной связи (1,4-присоединение). Соотношение этих продуктов зависит от условий проведения реакции и природы электрофильного реагента.
1. Гидрирование, Водород в момент выделения образуете ал кал ие-нами-1,3 обычно продукты 1.4-присоединения, например:
Вприсутствии катализаторов (Ni, Pt) диены-1,3 присоединяют водород в 1 ,2- и 1,4-положения
собразованием соответствующих алкенов, которые подвергаются дальнейшему гидрированию до алканов:
2. Присоединение галогенов. Присоединение галогенов приводит к образованию смеси продуктов 1,2- и 1,4-присоединения. Как правило, при повышении температуры и переходе от хлора к йоду возрастает выход продукта 1,4-присоединения. Например, в процессе бромирования бутадиена-1,3 при температуре –80 °С образуется преимущественно продукт 1,2-присоединения, а при 40°C – продукт 1,4-присоединения:
Присоединение галогенов к сопряженным алкадиенам происходит по электрофильному механизму Особенность механизма состоит в том, что электрофильная частица атакует концевой атом углерода сопряженной системы, поскольку при этом образуется мезомерно стабилизированный карбкатион, строение которого можно представить граничными структурами I
и II:
30
