
Орг химия / 11-22_Uglevodorody
.pdf
11) НОМЕНКЛАТУРА, ИЗОМЕРИЯ И СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ
Алканами называют углеводороды алифатического ряда, в молекулах которых атомы углерода
связаны между собой только простыми σ-связями. |
|
|
|
||
Общая формула алканов – СnН2n+2 |
Алканы образуют гомологический ряд, в котором каждый |
||||
представитель отличается от последующего на группу -СН2– (гомологическая разность): |
|||||
СН4 |
метан |
С2Н6 |
этан |
С3Н8 |
пропан |
С4Н10 |
бутан |
С5Н12 |
пентан |
С6Н14 |
гексан |
С7Н16 |
гептан |
С8Н18 |
октан |
С9Н20 |
нонан |
С10Н22 |
декан |
|
|
|
|
Номенклатура алканов
Первые четыре члена гомологического ряда алканов – метан, этан, пропан и бутан – имеют тривиальные названия. Названия последующих углеводородов с нормальной углеродной цепью образуют от названия греческих числительных, указывающих количество атомов углерода в молекуле, с добавлением суффикса -ан.
Названия алканов с разветвленной углеродной цепью образуются согласно заместительной номенклатуре ИЮПАК следующим образом:
I. Для построения названия выбирают наиболее длинную неразветвленную углеродную цепь (главную углеродную цепь); если имеется несколько цепей одинаковой длины, выбирают ту, которая имеет наибольшее число разветвлений:
2. Нумерацию атомов углерода главной цепи проводят с того конца, к которому ближе заместитель:
Если одинаковые заместители равноудалены от обоих концов молекулы, начало нумерации определяется алфавитным порядком:
Если одинаковые заместители равноудалены от обоих концов молекулы, нумерацию начинают с того конца, где число заместителей больше:
1

3. Составляют название соединения, учитывая следующие правила:
•названия заместителей перечисляют в алфавитном порядке, указывая цифровой локант, соответствующий положению каждого заместителя в главной углеродной цепи;
•число одинаковых заместителей обозначают множительными приставками ди-, три-, тетра- и
т. д,;
•затем называют углеводород, в основе которого выделена главная углеродная цепь.
Если в молекуле алкана две метальные группы расположены на одном конце углеродной цепи и другие ответвления отсутствуют, используют приставку изо-; если три метальные группы – приставку нео-:
Алкил – остаток углеводорода, образующийся в результате отщепления атома водорода. Необходимо обратить внимание на то, что не следует путать понятия «углеводородный
радикал» как остаток алкана (R–) со «свободным радикалом» (R•), который имеет неспаренный электрон.
Важно запомнить, что при переходе от алкана к алкилу следует заменить суффикс -ан на -ил. Для двухвалентных радикалов с двумя свободными валентностями возле одного углеродного атома суффикс -ан изменяется на -илиден, для трехвалентных радикалов с тремя свободными валентностями возле одного углеродного атома соответственно суффикс -ан изменяют на -илидин.
Наиболее часто встречающиеся радикалы:
Алканы по рациональной номенклатуре рассматривают как производные метана, в молекуле которого один или несколько атомов водорода замещены на углеводородные радикалы. Заместители вокруг «метанового» углерода перечисляют в порядке увеличения сложности их строения:
2
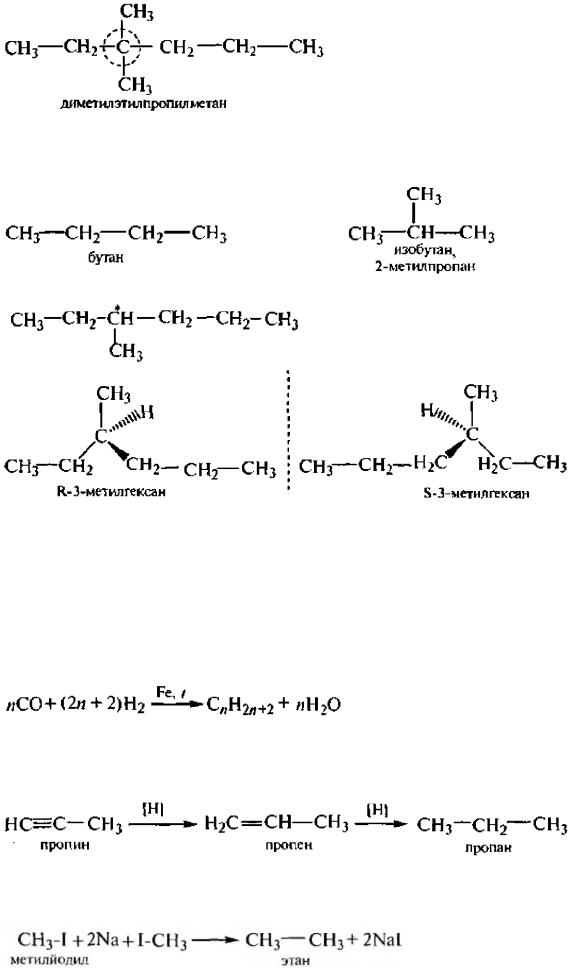
Изомерия
Структурная изомерия алканон обусловлена различной последостельностью связывания атомов углерода в молекуле (изомерия цепи):
В ряду алканов, начиная с гептана С7Н16, возможно проявление оптической изомерии:
Способы получения алканов
Природными источниками алканов являются нефть, газ, уголь, торф, сланцы и др. Основная цель промышленного получения алканов – выделение различных фракций или индивидуальных соединений.
Синтетические способы получения
Оксосиитез алканов (метод Фишера – Тропша). Каталитическое гидрирование оксида углерода (II) позволяет получить алканы нормального строения (состав С6– C10). Смесь оксида углерода (II) и водорода пропускают над катализатором Fe – Со при температуре 180-300 °С.
Каталитическое гидрирование алкенов и алкинов. Присоединение водорода по месту разрыва кратной связи алкенов и алкинов осуществляют в присутствии катализаторов (тонко измельченных Pt, Pd или Ni),
Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца). Используется для синтеза симметричных алканов и протекает через стадию образования металлорганических соединений.
Реакция Вюрца протекает в две стадии:
3

Если в качестве исходных веществ используют два разных галогеналкана, образуется смесь алканов, которую трудно разделить.
Сплавление солей карбоновых кислот со щелочами. Соли шелочных металлов карбоновых кислот при сплавлении со щелочью образуют алканы.
Гидролиз металлорганических соединений. Действием воды на карбид алюминия получают метан в лабораторных условиях.
Электролиз водных растворов солей карбоновых кислот (реакция Кольбе). Чаще электролизу подвергают калиевые или натриевые соли карбоновых кислот:
На аноде анион карбоновой кислоты окисляется, образуя свободный радикал, который легко декарбоксилируется. Алкильные радикалы вследствие рекомбинации превращаются в алкан. На катоде образуется водород и соответствующий гидроксид щелочного металла.
Физические свойства
Первых четыре представителя гомологического ряда алканов – газы, Алканы нормального строения состава С5–С17 – жидкости, последующие представители – твердые вещества. Физические константы (tкип, tпл) в гомологическом ряду алканов возрастают с увеличением молекулярной массы.
Большое влияние на физические свойства алканов оказывает строение углеродной цепи: температура кипения алканов разветвленного строения ниже, чем алканов нормального строения.
4
Алканы газообразные и твердые – без запаха, жидкие – обладают характерным «бензиновым» запахом. Не растворимы в воде, хорошо растворимы в неполярных растворителях. Увеличение молекулярной массы алканов приводит к уменьшению их растворимости.
5

12) ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВ
Предельные углеводороды называют парафинами (от лат. parum affimtas – мало свойств), что указывает на их сравнительно низкую реакционную способность. Алканы – инертные, малоактивные соединения, устойчивы к действию кислот, щелочей и окислителей.
Чем же обусловлена их химическая инертность? Следует отметить прочностьо-связей С–С и С- Н. Различие значений электроотрицательности sp3-гибридизованного атома углерода (2,5) и атома водорода (2.1) незначительно. Поэтому σ-связи С–С и С-Н в алканах практически неполярны и не склонны к гетеролитическому разрыву.
Химические превращения алканов сопровождаются гомологическим расщеплением связей. Характерны реакции свободнорадикального замещения (SR). При высоких температурах возможен гомолитический разрыв углерод-углеродных связей.
I. Реакции радикального замещения (SR).
1. Галогенирование. Алканы реагируют с галогенами с образованием моно- и поли галогеналканов. Реакция протекает по цепному свободнорадикальному механизму.
При взаимодействии метана с хлором, протекающем при освещении или нагревании, происходит постепенное замещение атомов водорода атомами хлора:
Механизм данной реакции был изучен академиком, лауреатом Нобелевской и Государственной премии СССР Н.Н. Семеновым.
В цепной реакции выделяют три последовательные стадии: инициирование, рост цепи и
обрыв цепи.
Инициирование. Молекула галогена под действием квантов света (hv) или нагревании претерпевает гемолитический разрыв связи с образованием свободных радикалов:
Рост цепи. Образовавшиеся свободные радикалы хлора атакуют связь С-Н в молекуле СН4, отрывают атом водорода с образованием НСl и свободного метильного радикала СН3.
Метильный радикал атакует молекулу хлора, отрывает атом галогена и образует хлорметан СН3С1 и свободный радикал хлора:
6

Образовавшийся радикал Cl повторяет цикл указанных превращений, т. е. происходит цепная реакция, в которой атом хлора, прореагировавший на предыдущей стадии роста цепи, способствует высвобождению нового радикала хлора на последующей стадии. Образуется смесь моно-, ли-, три- и тетрахлорпроизводных метана.
Цепная реакция завершается только после исчезновения всех образовавшихся входе превращений свободных радикалов.
Обрыв цепи происходит в результате рекомбинации (димеризации) свободных радикалов.
Следует обратить внимание на региоселактивность (избирательность) галогенирования (особенно бромирования) алканов. В первую очередь замещается атом водорода при третичном углеродном атоме, затем – при вторичном и в последнюю очередь – при первичном.
Такую последовательность замещения определяет устойчивость образующихся свободных радикалов. Региоселективность галогенирования алканов возрастает при понижении температуры реакции. Чем активнее галогенирующий реагент, тем ниже избирательность процесса,
2. Нитрование алканов проводят разбавленной азотной кислотой при нагревании и повышенном давлении (реакция Коновалова):
Механизм SR:
Следует отметить, что алканы в обычных условиях не взаимодействуют с концентрированной азотной кислотой,
3. Судьфохлорирование. Алканы при совместном действии оксида серы (IV) и хлора в условиях УФ-облучения образуют алкансульфонилхлорилы R-SO2Cl.
Реакция протекает по свободнорадикальному механизму (SR):
7

Сульфохлорирование алканов позволяет получить смесь первичных и вторичных алкансульфохлоридов. Третичные алкансульфохлориды в силу пространственных препятствий не образуются.
II. Окисление. Алканы в избытке кислорода или на воздухе горят с выделением большого количества теплоты:
Окисление алканов в присутствии катализатора (соли марганца, хрома и др.) и при нагревании (150–200 °С) протекает по радикальному механизму и сопровождается разрывом С-С связей.
III. Крекинг алканов – это процесс термического расщепления алканов.
Термический крекинг проводят при t = 800 °С и выше, каталитический – при t = 450...550 °С в присутствии алюмосиликатных катализаторов.
Высшие алканы в условиях термического крекинга образуют смесь низших алканов и алкенов.
Крекинг-процесс имеет важное промышленное значение: получение высокооктановых
бензинов, |
непредельных |
и |
ароматических |
углеводородов. |
|
|
|
8 |
|

13) НОМЕНКЛАТУРА, ИЗОМЕРИЯ И СПОСОБЫ ПОЛУЧЕНИЯ ЦИКЛОАЛКАНОВ
Цнклоалканами называют алициклические углеводороды, в которых углеродные атомы, образующие цикл, находятся в sp3-гибрндизации.
Классификация циклоалканов
Циклоалканы классифицируют по величине цикла, числу циклов и способу соединения циклов в молекуле. По величине цикла различают:
•циклоалканы с малыми циклами (трех- и четырехчленные);
•циклоалканы с обычными циклами (пяти-, шести- и семичленные);
•циклоалканы со средними циклами (от восьмидо одиннадцати членных);
•макроциклы (двенадцатичленные и более».
В зависимости от числа циклов в молекуле выделяют:
•моноциклические;
•бициклические;
•полициклические.
Бициклические циклоалканы по способу соединения циклов подразделяют на 3 группы: спираны (два кольца имеют один общий атом углерода); конденсированные (два кольца имеют два общих соседних атома углерода); мостиковые (два кольца имеют три и более общих атомов углерода).
Номенклатура циклоалканов
Названия моноциклических циклоалканов образуют в соответствии с правилами ИЮПАК путем добавления к названию алкана с соответствующим количеством атомов углерода префикса
цикло-.
Названия одновалентных радикалов образуют путем замены в названии соответствующего циклоалкана суффикса -ан на -ил.
Бициклические циклоалканы называют в зависимости от числа углеродных атомов циклической системы и способа соединения циклов/
Спираны называют путем прибавления префикса спиро- к названию алкана с соответствующим числом атомов углерода. Между префиксом и корнем (названием алкана) в квадратных скобках указывают в порядке возрастания число атомов углерода в каждом из циклов, исключая общий. Нумерацию атомов углерода спирановой системы начинают с меньшего цикла, с углеродного атома, расположенного рядом с общим.
9
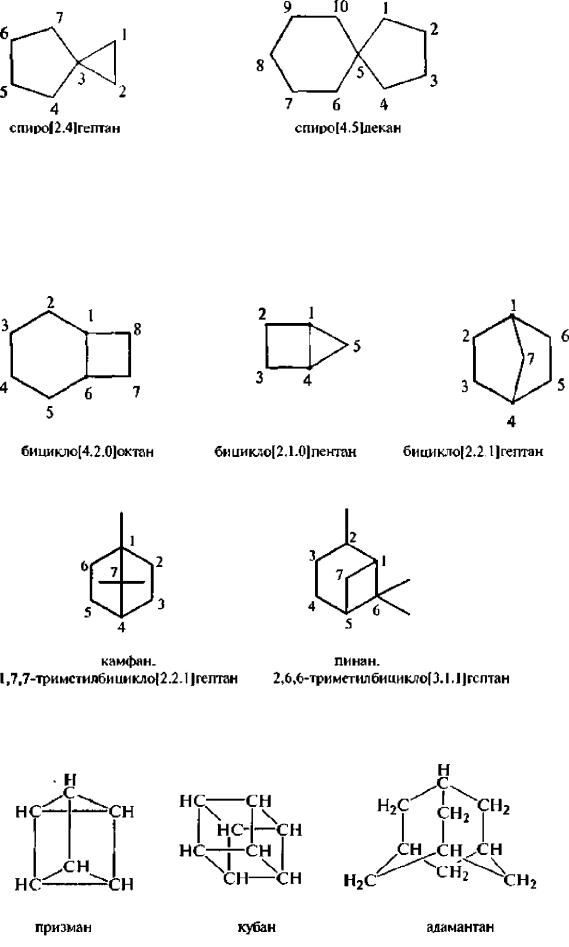
Конденсированные и мостиковые бициклические циклоалканы называют путем прибавления префикса бицикло- к названию алкана с соответствующим числом углеродных атомов. В квадратных скобках между префиксом и названием алкана в порядке убывания указывают число углеродных атомов в каждой из трех цепей, соединенных общими узловыми (третичными) атомами углерода. Нумерацию атомов углерода следует начинать с одного из узловых атомов. В первую очередь нумеруют самую длинную углеродную цепь, затем – более короткую. В мостиковых системах в заключение нумеруют самую короткую углеродную цепь – мостик:
Наряду с систематическими названиями многие бициклические системы имеют тривиальные названия.
Полициклические соединения содержат более двух циклов, соединенных мостиками. Названия каркасных гтолициклических углеводородов происходят от эмпирических названий соответствующих геометрических фигур, напоминающих их строение.
Изомерия циклоалканов
10
