
Орг химия / 63-76_KOLLOIDNAYa_KhIMIYa
.pdf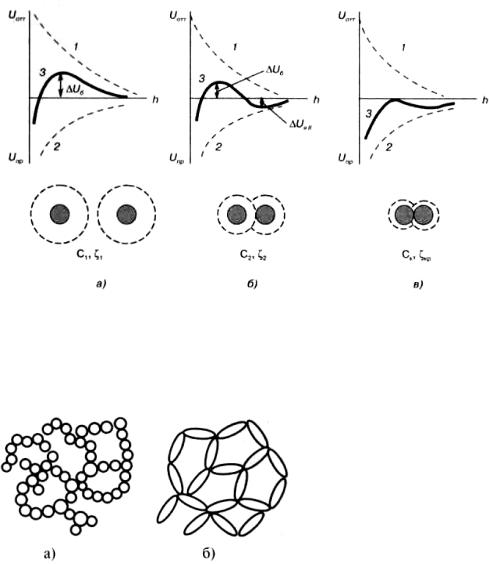
яму, притом частицы вступают в ближнее взаимодействие, т.е. непосредственно соприкасаются, и
происходит элементарный акт коагуляции (рис. 9.3 в). Коагуляция в первичном минимуме, как правило, необратима.
Рис. 9.3. Потенциальные кривые взаимодействия частиц: а – агрегативно устойчивая система; б
– коагуляция во вторичном энергетическом минимуме; в – коагуляция при достижении порога быстрой коагуляции (ск); с1 < с2 < ск, ζ1 > ζ2 > ζкр
Рис. 9.4. Схема пространственной сетки геля: а – из сферических частиц; б – из удлиненных частиц
Приведенные закономерности хорошо согласуются с поведением гидрофобных золей и корректно объясняют влияние электролитов на коагуляцию. Если частицы золя имеют высокий электрический потенциал и достаточной толщины диффузный слой (большой ^-потенциал), то при перекрывании ДЭС двух частиц энергия электростатического отталкивания преобладает над энергией межмолекулярного притяжения. Возникает энергетический барьер, препятствующий слипанию частиц. Сблизившиеся частицы вновь отдаляются друг от друга. Следовательно,
система является агрегативно устойчивой (см. рис. 9.3 а). Сжатие диффузного слоя, например при добавлении электролитов, приводит к уменьшению величины ζ-потенциала, снижению сил электростатического отталкивания и, как следствие, понижению величины потенциального
51
барьера и углублению потенциальных ям (рис. 9.3 б). При определенном значении ζ-потенциала и концентрации электролита наблюдается полное исчезновение потенциального барьера (ΔUб = 0).
В таком состоянии дисперсной системы все столкновения частиц эффективны и наблюдается
быстрая коагуляция (рис. 9.3 в).
Минимальная концентрация электролита, при которой начинается быстрая коагуляция,
называется порогом быстрой коагуляции (ск), а величина ζ-потенциала, соответствующая ск, –
критическим ζ-потенциалом или ζкр.
Характерно, что, согласно теории ДЛФО, быстрая коагуляция наступает не при отсутствии заряда на поверхности частиц, как считалось ранее, а при некотором критическом значении ζ-
потенциала.
Рассмотренный вариант теории ДЛФО не учитывает ряда факторов, в частности размера сближающихся частиц. Анализ влияния размера сферических частиц на энергетичекие кривые показывает, что чем больше радиус частиц, тем выше потенциальный барьер ΔUб, но и глубже дальняя потенциальная яма Аияп. Это подтверждается тем важным фактом, что в грубодисперсных системах (пасты и т.д.) особенно характерна агрегация при сохранении прослоек жидкости.
Подход к рассмотрению устойчивости системы через энергетические кривые и расклинивающее давление, предложенные в теории ДЛФО, является универсальным. Естественно,
что дисперсная система агрегативно устойчива только при высоком энергетическом барьере сил отталкивания. Поэтому все те факторы, которые снижают величину энергетического барьера ΔUб,
неизбежно понижают агрегативную устойчивость системы.
§9.5. Скорость коагуляции
При коагуляции изменяются физико-химические свойства систем: появляется мутность,
снижается осмотическое давление, изменяются электрическая проводимость и характер вязкости,
изменяется характер кривых седиментации и т.д. На изменении физико-химических свойств основаны методы наблюдения и изучения процесса коагуляции. Наиболее информативным методом изучения коагуляции является метод непосредственного счета количества частиц в единице объема, проводимый с помощью поточного ультрамикроскопа.
Скорость коагуляции. Медленная и быстрая коагуляция. Ход коагуляции в зависимости от концентрации коагулирующего электролита можно подразделить на две стадии (рис. 9.5):
медленную и быструю. При медленной коагуляции изменение концентрации коагулирующего электролита сопровождается резким изменением скорости медленной коагуляции. В области быстрой коагуляции увеличение концентрации коагулирующего электролита не вызывает изменения скорости коагуляции, достигшей своего максимального значения. Концентрацию
52
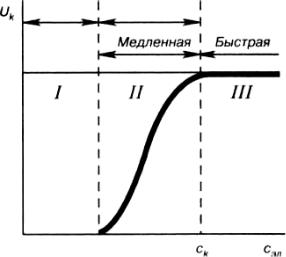
электролита, начиная с которой скорость коагуляции остается постоянной, является порогом быстрой коагуляции ск.
Рис. 9.5. Зависимость скорости коагуляции от концентрации электролита
Быстрая коагуляция начинается при полном исчезновении потенциального барьера (рис. 9.3 в,
ΔU6 = 0). В этом случае все столкновения частиц являются эффективными, скорость коагуляции становится максимальной и постоянной (область III на рис. 9.5), а вычисления скорости коагуляции несколько упрощаются, поскольку сводятся к подсчету числа столкновений. Если U6
несколько выше нуля, в системе протекает медленная коагуляция (область II на рис. 9.5).
Естественно, что столкновения эффективны только в том случае, если энергия сталкивающихся частиц превышает величину потенциального барьера. Поскольку с ростом концентрации электролита высота барьера снижается и доля эффективных соударений увеличивается, то растет и скорость медленной коагуляции.
Кинетика медленной коагуляции развита в работах Н.А. Фукса (1934). Помимо учета эффективности соударений им было введено понятие коэффициента замедления или фактора устойчивости W, учитывающего, во сколько раз скорость медленной коагуляции ниже, чем скорость быстрой. Фуксом показано, что коагуляция резко замедляется с ростом величины энергетического барьера AU6, увеличением толщины диффузного слоя и уменьшением радиуса частиц. Если же AU6 много больше кТ, то скорость коагуляции близка к нулю и система может быть агрегативно устойчивой. Согласно теории ДЛФО эта ситуация соответствует низкой концентрации электролита (область I на рис. 9.5) и энергетической кривой на рис. 9.3 а.
Кинетика быстрой коагуляции разработана М. Смолуховским (1916). Рассматривая коагуляцию как бинарную реакцию второго порядка, можно написать следующее выражение для скорости реакции:
 (9.2)
(9.2)
53
где V – скорость коагуляции; v – частичная концентрация; Кб – константа скорости реакции; t –
время. Поскольку сближение частиц на достаточно близкие расстояния обусловлено броуновским движением, константа скорости выражается через коэффициент диффузии Кб = 4πlD (D –
коэффициент диффузии, l – расстояние между центрами частиц, равное их удвоенному радиусу).
При расчетах следует учитывать, что начиная с некоторого момента происходит столкновение не только одиночных частиц, но и уже образовавшихся агрегатов-двойников, тройников и т.д.
Смолуховский получил уравнения для расчета числа частиц, скоагулировавшихся или оставшихся в золе к определенному моменту времени. Так, число частиц, оставшихся ко времени t, составляет:
 (9.3)
(9.3)
где v0 – первоначальное число частиц; i – порядок частиц (одиночные, двойники, тройники и т.д.); t – время от начала коагуляции; t1/2 – время половинной коагуляции, в течение которого число частиц уменьшается в два раза (v0/2).
Суммарное число частиц всех порядков ко времени t дается уравнениями:
 (9.4)
(9.4)
Из выражений следует, во-первых, что при t = t1/2 Σvi= v0/2, во-вторых, что К6 и tI/2 связаны между собой соотношением:
 (9.5)
(9.5)
Учитывая эффективность всех соударений, теория дает для константы скорости быстрой коагуляции простую формулу:
 (9.6)
(9.6)
где η – вязкость среды; k – константа Больцмана. Таким образом, Кб скорости быстрой коагуляции зависит только от температуры и вязкости дисперсионной среды.
Дальнейшее развитие теории быстрой коагуляции связано с учетом дополнительных факторов,
влияющих на скорость коагуляции, например, выяснилось, что для анизометричных частиц скорость коагуляции гораздо больше, чем для сферических, поскольку увеличивается частота столкновений при броуновском движении. Значительное развитие теория быстрой коагуляции получила в работах российских ученых, в частности В.М. Муллера, рассматривающего обратимую коагуляцию, т.е. возможность распада образовавшихся агрегатов в процессе быстрой коагуляции,
не только в первичном, но и в достаточно глубоком вторичном минимуме.
54
72) ЗАКОНОМЕРНОСТИ КОАГУЛЯЦИИ ГИДРОФОБНЫХ ЗОЛЕЙ ПОД ДЕЙСТВИЕМ ЭЛЕКТРОЛИТОВ
Данные, полученные с помощью визуальных методов определения порога коагуляции (ск),
зависят от ряда условий: от времени и метода наблюдения, от концентрации исследуемого золя и т.д. Поэтому при представлении результатов необходимо указывать условия, в которых они получены.
Пороги коагуляции для типично гидрофобных золей как правило находятся в пределах 10-4 – 10- 2 моль/л. Величину, обратную порогу коагуляции, называют коагулирующей способностью и
обозначают Vк (Vк = 1/cк). Коагулирующая способность выражает объем золя, скоагулированный 1
моль иона-коагулятора.
Правило Шульце-Гарди. Наблюдения Г. Шульце (1882) показали, что коагулирующей способностью обладает один из ионов добавляемого электролита (ион-коагулятор).
Коагулирующая способность иона-коагулятора возрастает с увеличением его заряда (правило Шульце). Несколько позже М. Гарди (1900) нашел, что заряд коагулирующего иона всегда противоположен заряду коллоидной частицы (правило Гарди). Для золя с положительно заряженными частицами ионы-коагуляторы – анионы, для золя с отрицательно заряженными частицами – катионы.
Закономерности, найденные Шульце и Гарди и подтвержденные многочисленными
исследователями, известны как правило Шульце–Гарди: Коагулирующим действием обладает тот ион электролита, который имеет заряд, противоположный заряду гранулы; коагулирующее действие тем сильнее, чем выше заряд иона-коагулятора (правило значности).
Правило Шульце-Гарди на основании опытных данных дает для 1-, 2- и 3-х зарядных противоионов соотношение (ряд Шульце–Гарди)
 (9.7)
(9.7)
Это правило находит свое объяснение при анализе зависимости ζ-потенциалов от концентрации добавляемых электролитов (рис. 9.3). Если обозначить на данном графике значение критического
ζ-потенциала (ζкр), то соответствующие ему концентрации электролита являются фактически порогами коагуляции ск. Они будут тем меньше, чем выше заряд противоиона (рис. 9.6).
Правило Шульце-Гарди получило свое подтверждение при разработке теории ДЛФО. Б.В.
55
Дерягин и Л.Д. Ландау показали, что энергетический барьер между коллоидными частицами исчезает (ΔUб = 0) при достижении критической концентрации (ск), которая обратно пропорциональна шестой степени заряда иона-коагулятора (закон 6-й степени):
 (9.8)
(9.8)
Таким образом, для порогов коагуляции типично лиофобных золей имеем:
 (9.9)
(9.9)
Дальнейшая разработка теории ДЛФО, учитывающая коагуляцию во вторичном минимуме,
дает также показатель степени 2,5. Количественное отличие экспериментально найденных рядов Шульце–Гарди от теоретического значения может быть связано с различными факторами, в
частности степенью лиофилизации частиц, специфической адсорбцией ионов электролита и т.д.
Следует отметить, что из правила Шульце–Гарди существуют исключения, обусловленные также химическим взаимодействием ионов с поверхностью, специфической адсорбцией многозарядных ионов. Особым случаем является коагуляция под действием сложных органических ионов (алкалоиды, красители), проявляющих коагулирующее действие вне связи с валентностью. Причем часто органические ионы оказывают большее коагулирующее действие,
чем соответствующие им по валентности ионы неорганических соединений. В ряде случаев такое отличие обусловлено особым механизмом коагуляции – флокуляцией.
Влияние электролитов на φ- и ζ-потенциалы. Механизм коагуляции. Поскольку устойчивость лиофобных коллоидов в большинстве случаев изменяется параллельно с изменением
ζ-потенциала, следовательно, величина ζ-потенциала представляет собой важнейший
электростатический фактор стабилизации данной дисперсной системы.
Согласно теории ДЛФО, при быстрой коагуляции коллоидных систем электролитами возможны
два основных механизма:
1. концентрационная коагуляция, при которой потеря устойчивости коллоидов
вызывается сжатием диффузной части двойного электрического слоя при постоянном (ζ-
потенциале поверхности; |
|
|
|
|
|
|
2. |
нейтрализационная |
коагуляция, |
происходящая |
в |
результате |
снижения |
поверхностного φ-потенциала, и, как следствие, ζ-потенциала частиц.
Тип коагуляции зависит как от свойств коллоида, так и от характера прибавляемых электролитов.
Концентрационная коагуляция. Наблюдается в золях с высоким φ-потенциалом частиц при увеличении концентрации электролита, точнее, ионной силы раствора. Этот механизм коагуляции
56

осуществляется при действии индифферентных электролитов, не способных к специфической адсорбции. Добавление таких электролитов не изменяет величину φ-потенциала во внутренней обкладке двойного слоя. В этом случае одновременно с ионным обменом наблюдается электростатический эффект сжатия двойного электрического слоя и связанное с ним уменьшение
ζ-потенциала (см. рис. 9.6; 9.7 ), что и приводит к коагуляции.
Рис. 9.6. Зависимость ζ-потенциала отрицательно заряженного золя AgI от концентрации введенных электролитов: 1 – KNO3, 2 - Ca(NO3)2, 3 - Al(NO3)3. Доказательство правила Шульце– Гарди
При концентрационной коагуляции наблюдается две основные закономерности,
обусловливающие величину ск:
1.Влияние заряда иона-коагулятора согласно правилу Шульце-Гарди (см. рис. 9.6)
2.Влияние размера иона-коагулятора
Рис. 9.7. Зависимость ζ-потенциала и порогов коагуляции отрицательно заряженного золя от концентрации однозарядных катионов в лиотропном ряду
57
Влияние размера иона-коагулятора индифферентного электролита. Лиотропные ряды.
Ионы щелочных металлов по их порогам коагуляции располагаются в следующий ряд: Li+ > Na+ >
К+ > Rb+ > Cs+ (см. рис. 9.7). Наибольший порог коагуляции (и соответственно наименьшая коагулирующая способность) характерен для ионов лития. Это можно объяснить тем, что развитая гидратная оболочка значительно увеличивает общий радиус иона и препятствует его вхождению в адсорбционный слой.
Для ионов щелочноземельных металлов лиотропный ряд проявляется не так закономерно.
Например, по отношению к золю сульфида сурьмы Sb2S3 пороги коагуляции для нитратов этих металлов располагаются в последовательности Са2+ > Sr2+ > Ва2+ > Mg2+.
Анионы также можно расположить в лиотропный ряд, но разница в их коагулирующей способности незначительна.
Нейтрализационная (адсорбционная) коагуляция. Происходит в результате уменьшения ζ-
потенциала твердой поверхности и характерна для коллоидных систем со слабозаряженными частицами. Этот вид коагуляции вызывают электролиты, имеющие ион, способный к
специфической адсорбции на поверхности частиц и заряженный противоположно им, т.е.
определенные неиндифферентные электролиты. Способность к специфической адсорбции резко возрастает с увеличением заряда иона-коагулятора. Такие ионы, находясь в адсорбционном слое,
нейтрализую ζ-потенциал и снижают его. Параллельно идет снижение ζ-потенциала.
Специфическая адсорбция ионов может привести к перезарядке поверхности частиц, поэтому нейтрализационная коагуляция ограничена определенными пределами концентрации электролита
(рис. 9.8, 2, участок дж). Потерю агрегативной устойчивости золями при специфической адсорбции ионов-коагуляторов объясняют не только снижением электрических потенциалов частицы, но и образованием на поверхности частиц менее растворимых или менее диссоциированных соединений. При этом уменьшается взаимодействие частиц с растворителем и увеличивается поверхностное натяжение на границе частица-среда, что усиливает тенденцию к агрегации.
58
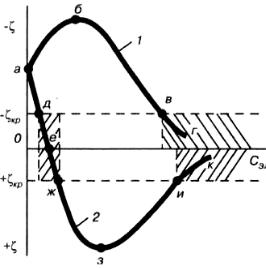
Рис. 9.8. Зависимость ζ-потенциала от концентрации неиндифферентных электролитов,
содержащих специфически адсорбирующиеся ионы, заряженные по отношению к заряду коллоидной частицы: 1 – одноименно, 2 – противоположно (на примере отрицательно заряженного золя AgI)
Порог нейтрализационной коагуляции обратно пропорционален квадрату величины заряда z
иона-коагулятора:
 (9.10)
(9.10)
Неправильные ряды. Многовалентные катионы и анионы обладают способностью не только уменьшать ζ-потенциал и тем вызывать коагуляцию, но могут, кроме того, изменять знак ζ-
потенциала на противоположный.
Рассмотрим изменение ζ-потенциала отрицательно заряженного золя при добавлении электролита, содержащего ион-коагулятор А13+ (рис. 9.6, кривая 3). Снижение отрицательного ζ-
потенциала до критического значения свидетельствует о начале зоны коагуляции,
соответствующей скIII (точка а на рис. 9.6, кривая 3). Затем идет дальнейшее понижение ζ-
потенциала, его значение переходит через изоэлектрическую точку, в которой ζ = 0. Происходит перезарядка и повышение уже положительного ζ-потенциала за счет сверхэквивалентной адсорбции Аl3+ (см. §7.2). Однако вплоть до положительного значения в системе наблюдается коагуляция. Таким образом, в области концентрации, соответствующей отрезку аб на рис. 9.6,
система коагулирует. Последующее увеличение концентрации ионов Аl3+ приводит к росту ζ-
потенциала и повышению агрегативной устойчивости системы. Значение ζ-потенциала достигает максимума, а затем уменьшается до второго критического значения, при котором золь коагулирует уже под действием ионов NO3-. С концентрации, соответствующей точке в на рис. 9.6,
начинается вторая зона коагуляции. Таким образом, при действии многозарядных ионов-
59
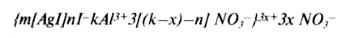
коагуляторов золь последовательно проходит через две зоны стабильности и две зоны коагуляции.
После перезарядки за счет сверхэквивалентной адсорбции ионов Аl3+ мицелла золя AgI имеет вид:
Чередование зон устойчивого и неустойчивого состояния называют неправильными рядами. В
этом случае нельзя сделать однозначного заключения о том, что с увеличением концентрации электролита стабильность золя снижается.
Естественно, что если многовалентные катионы дают неправильные ряды с отрицательно заряженным золем, то в отношении положительно заряженных золей такую же роль играют многовалентные анионы. Так, при действии лимоннокислого натрия на положительно заряженный золь гидроксида железа наблюдаются две зоны отсутствия коагуляции и две зоны коагуляции в той же последовательности, что и в случае неправильных рядов у отрицательных золей.
Аналогичным образом на агрегативную устойчивость золя могут действовать и некоторые потенциалобразующие ионы. Влияние потенциалобразующего иона на ζ-потенциал золя зависит от знака заряда этого иона: будет ли он одноименным или противоположным по отношению к частицам золя.
Допустим, что к золю AgI с отрицательно заряженными частицами добавили раствор иодида калия. Входящий в его состав ион I- способен к специфической адсорбции согласно правилу Панета-Фаянса. Знак его заряда совпадает с зарядом коллоидных частиц. Если на поверхности микрокристаллов AgI, образующих агрегаты мицелл, имеются свободные адсорбционные центры,
происходит достройка кристаллической решетки за счет адсорбции I-. При этом увеличивается плотность заряда в адсорбционном слое ПОИ и возрастают значения как φ-потенциала, так и ζ-
потенциала (рис. 9.8, 1, участок аб). После насыщения адсорбционных центров адсорбция ионов I
прекращается. Дальнейшее увеличение концентрации электролита приводит к снижению ζ-
потенциала (при неизменном φ-потенциале) в результате сжатия диффузного слоя под действием добавляемых ионов (участок бв кривой). По достижении критического ζ-потенциала (точка в кривой) золь начинает коагулировать.
При отсутствии свободных адсорбционных центров ионы I- добавленного электролита не адсорбируются на поверхности твердых частиц и не влияют на величину φ-потенциала. Но увеличение концентрации противоионов К+ приводит к сжатию диффузного слоя, снижению ζ-
потенциала до критического (рис. 9.8, 7, участок бв) и коагуляции золя (за точкой в) по
концентрационному механизму.
При добавлении к такому же золю AgI нитрата серебра неиндифферентным ионом будет ион
Ag+. Поскольку потенциалобразующими в мицелле золя являются ионы I-, при введении в раствор создаются благоприятные условия для взаимодействия указанных ионов с
60
