
Орг химия / 63-76_KOLLOIDNAYa_KhIMIYa
.pdfиспользованы электрофильтр-прессы (рис. 7.10), основную часть которых составляют две металлические пластины П, подключенные к источнику напряжения и расположенные горизонтально одна над другой. Нижняя пластина перфорирована (имеет множество отверстий).
Подлежащую обезвоживанию кашицеобразную массу помещают между этими пластинами.
Вследствие электроосмоса происходит электроосмотический перенос жидкости через перфорированную пластину, в то время как твердая масса отжимается к верхней пластине вследствие электрофореза.
21
66) РАЗДЕЛЕНИЕ МЕТОДОМ ЭЛЕКТРОФОРЕЗА. КАПИЛЛЯРНЫЙ ЭЛЕКТРОФОРЕЗ.
Государственная Фармакопея (XI) включает метод электрофореза для разделения лиофильных коллоидных систем типа белков, пептидов и др.
Для разделения применяют главным образом два способа: фронтальный электрофорез (или метод подвижной границы) и зональный электрофорез. Оба метода используют различия в электрофоретической подвижности компонентов смеси.
При фронтальном электрофорезе (в жидкой среде) разделяемую смесь вносят в прибор,
аналогичный рис. 7.8 б, и создают четкую границу между смесью и буферным раствором. В
процессе разделения первоначальная граница расходится на ряд границ по числу компонентов,
причем каждый компонент смеси после разделения имеет лишь одну четкую границу – фронт зоны. Вторая граница (тыл зоны) размыта, и на нее наслаивается фронт следующего компонента.
Вследствие этого невозможно выделить чистые компоненты. Однако данный метод является единственным способом прямого определения абсолютной электрофоретической подвижности
иэф. Его применяют для веществ с высокой молекулярной массой, обладающих слабой диффузией.
При зональном электрофорезе процесс разделения производят в закрепленной среде
(стабилизированная жидкость или носители). В этом случае на эффективность разделения могут влиять дополнительные факторы: адсорбция, ионообменные свойства носителя, электроосмос и капиллярные эффекты. Данный метод дает четкое разделение компонентов смеси на зоны,
ограниченные двумя границами («фронтом» и «тылом»). Для получения зон с четкими границами различными способами ограничивают диффузию и осуществляют антиконвекционную стабилизацию зон.
Зональный электрофорез. В зональном электрофорезе закрепленной средой является свободная жидкость или различные носители, пропитанные жидкостью. В методе электрофореза в свободной жидкости различают электрофорез в градиенте плотности и изоэлектрическое фокусирование. При электрофорезе в градиенте плотности в качестве среды используют жидкость,
стабилизированную добавлением глицерина, гликолей или сахарозы, создающих градиент плотности. Через колонку с электродами на концах, заполненную данной жидкостью, пропускают фракционируемый раствор. В изоэлектрическом фокусировании в колонке создается не только градиент плотности, но и градиент pH, позволяющий разделить белки согласно значениям их изоэлектрических точек – ИЭТ (см. §18.4).
Наиболее распространены методы разделения на пористых носителях. Рассмотрим некоторые из них.
Зональный электрофорез на бумаге. Различают бумажный электрофорез низковольтный (при градиенте напряжения 20–30 В/см) и высоковольтный (с градиентом потенциала до 200 В/см).
Высоковольтный электрофорез применяют для разделения низкомолекулярных соединений.
22

Приборы оборудуют устройствами для отвода джоулевой теплоты (выделяющейся при прохождении электрического тока через электрофоретическую ячейку), для чего используют инертные жидкости (тетрахлорид углерода, толуол), в которые помещают пропитанные буферным раствором бумажные полоски (фореграммы). Сама жидкость охлаждается с помощью погруженного в нее холодильника.
Рис. 7.11. Схема аппарата для электрофореза: 1 – электродные сосуды с буферным раствором; 2
– полоска хроматографической бумаги; 3 – мостики из фильтровальной бумаги; 4 – стеклянная крышка
Исследуемые пробы наносят на стартовую линию, проходящую посередине бумажной полосы,
пропитанной буферным раствором (рис. 7.11). В процессе разделения нейтральные незаряженные соединения остаются на старте; компоненты основного характера передвигаются от стартовой линии по направлению к катоду, соединения кислотного характера – к аноду. На стандартном листе ватмана можно одновременно анализировать до 20 проб, если габариты электрофоретической камеры соответствуют размеру листа. При напряжении 1500 В длительность анализа составляет 60–90 мин.
Рис. 7.12. Электрофореграмма белков сыворотки крови кролика на бумаге
Наиболее широко используется данный метод для фракционирования белков. В качестве буферного раствора для разделения белков крови и многих других биологических жидкостей чаще всего используют веронал-мединаловый буфер (барбитуровая кислота и ее натриевая соль) с pH 8,6 и невысокой ионной силой 0,05. При данном pH большинство белков заряжены отрицательно и движутся к аноду. По окончании процесса бумагу высушивают и проявляют зоны соответствующим реактивом. Например, для смеси глобулинов используют краситель бромфеноловый синий (рис. 7.12). Поскольку многие заболевания характеризуются изменением соотношения различных белков в плазме крови, то метод электрофореза можно использовать не
23
только для фракционирования белков, но в диагностике и лечении заболевания.
Зональный электрофорез на ацетатцеллюлозной мембране. Мембрана ацетатцеллюлозы как носитель для электрофореза имеет ряд преимуществ по сравнению с бумагой:
однородность и строго определенный размер пор, пониженная адсорбционная способность,
что исключает образование размытых полос позади зон, как это бывает на бумаге.
Конструкции аппаратов для электрофореза на мембранах просты, но поскольку тонкие ацетатцеллюлозные мембраны легко высыхают, они должны обеспечивать высокое насыщение водяными парами пространства камеры.
Для окрашивания зон применяют методы, аналогичные методам окрашивания зон на бумаге, за исключением использования таких растворителей, в которых мембрана растворяется или набухает
(ацетон, хлороформ). Объем наносимого образца, как правило, составляет 0,2–1,0 мкл на полоску мембраны толщиной 0,2-0,5 мм и шириной 2,5 см.
Тонкослойный электрофорез (ТСЭ). Аналогично ТСХ, ТСЭ проводят на тонких слоях высокодисперсных сорбентов. Преимуществом метода ТСЭ является возможность использования универсальных обнаруживающих реагентов, применяемых в ТСХ.
В качестве сорбентов для получения незакрепленного слоя применяют тонкодисперсный силикагель, тонкогранулированную целлюлозу с добавкой небольшого количества сефадекса или крахмала для усиления гидрофильных свойств, что важно для сохранения влажности и улучшения прилипания слоя к подложке.
Длительность разделения в зависимости от типа разделяемых смесей составляет от 20 до 120
мин.
Гель-электрофорез. Электрофорез на геле и крахмале применяют для аналитических целей.
Здесь следует учитывать также молекулярно-ситовой эффект геля. Наиболее важным применением гель-электрофореза является иммуноэлектрофорез, сочетающий в себе процесс электрофореза с реакцией преципитации (осаждения). Для этого вида анализа используют макропористые гели, в частности гели агара и агарозы. Метод иммуноэлектрофореза основан на том, что после разделения электрофорезом происходит диффузия разделенных веществ – антигенов – в направлении, перпендикулярном направлению электрофореза. (После электрофореза делают боковые углубления, заполненные соответствующей антисывороткой). Навстречу этим соединениям диффундируют антитела. При соединении антигенов и антител образуются характерные дуги осаждения. Метод иммуноэлектрофореза очень чувствителен при обнаружении антигенов, специфических для данных антител. В настоящее время применяют метод введения радиоактивной метки в антигены, благодаря чему радиоиммуноэлектрофорез является одним из самых чувствительных методов анализа биополимеров.
Методом электрофореза можно разделять белки, нуклеиновые кислоты, антибиотики, смеси
24

лекарственных веществ в лекарственных формах. Электрофорез применяют для определения чистоты лекарственных препаратов.
67) КОНДЕНСАЦИОННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ КОЛЛОИДНЫХ СИСТЕМ.
Коллоидные растворы (золи) занимают промежуточное положение между молекулярными и грубодисперсными системами. Этим определяются два возможных пути получения коллоидных растворов. Один путь состоит в укрупнении частиц при агрегации молекул или ионов – такой метод называют конденсационным (рис. 8.1 а). Второй путь заключается в измельчении крупных частиц до коллоидной дисперсности, его осуществляют методом диспергирования (рис. 8.1 б).
Рис. 8.1. Схема получения дисперсных систем (2): а – конденсация из истинного раствора (1), б
– диспергирования крупных частиц (3)
§ 8.1. Конденсационные методы получения коллоидных систем
Конденсация может протекать как химический и как физический процесс. И в том и в другом случае метод конденсации основан на образовании в гомогенной среде новой фазы, имеющей коллоидную дисперсность. Общим условием образования новой фазы является состояние
пересыщения раствора или пара. При возникновении местных Пересыщений в каких-то участках раствора образуются агрегаты из нескольких молекул, которые и становятся зародышами новой фазы. Роль зародышей могут выполнять имеющиеся или вносимые в систему центры кристаллизации – пылинки, небольшие добавки готового золя и др. Чем
больше число центров кристаллизации и меньше скорость роста кристаллов, тем выше дисперсность получаемых золей. Согласно современной теории образования в гомогенной среде зародышей новой фазы, этот процесс является флуктуационным. Условия образования зародышей твердом фазы выражает уравнение:
(8.1)
где r – радиус кристалла; σ – поверхностное натяжение на границе кристалл–раствор; Кл/ –
молярный объем кристаллической фазы; с∞ – концентрация насыщенного раствора; сr –
концентрация пересыщенного раствора, необходимая для образования мелких кристаллов с радиусом r.
25

Образование зародышей возможно при условии, когда сr > с∞. Из пересыщенного раствора может быть получена высокодисперсная система только в том случае, если скорость образования зародышей v, намного больше, чем скорость их роста v2, т.е. v1 >> v2. В противном случае образуются крупные частицы, которые не обладают кинетической устойчивостью и выпадают в осадок.
Химическая конденсация. В случае химической конденсации новая фаза возникает при протекании реакций, приводящих к образованию нерастворимых в данной среде веществ. Это могут быть реакции восстановления, окисления, обмена, гидролиза.
Для различных химических реакций, используемых при получении золей, оптимальные условия образования и роста зародышей подбирают опытным путем:
1.Для образования высокодисперсных систем необходимо, чтобы скорость образования зародышей новой фазы намного превышала скорость роста кристаллов. Это условие выполняется при внесении в разбавленный раствор одного из реактивов небольшого количества более концентрированного раствора второго реактива при интенсивном перемешивании. При такой методике образовавшиеся зародыши твердой фазы быстро прекращают рост, так как разбавленный раствор скоро истощается. Свежеобразованная дисперсная фаза, состоящая из агрегатов нерастворимого вещества, часто имеет аморфное строение. С течением времени (от нескольких минут до суток) идет процесс кристаллизации нерастворимых частиц и они приобретают кристаллическую структуру.
2.Поскольку при образовании дисперсной системы повышается вероятность обратного процесса – объединения частиц в агрегаты – необходимо введение стабилизаторов. В ряде случаев для гидрофобного золя достаточно наличия двойного электрического слоя с развитой диффузной частью (значительным ζ-потенциалом). Это условие реализуется при
нестехиометрическом соотношении смешиваемых реагентов (избытке одного из компонентов).
Роль стабилизаторов могут выполнять также высокомолекулярные вещества (см. §9.7).
Реакции восстановления. Для получения золей благородных металлов (платины, золота,
серебра) применяют обычно реакции восстановления. Восстановление может проводиться с применением защитных коллоидов или без них. В качестве защитных коллоидов используют ВМС, которые адсорбируются на поверхности коллоидных частиц и образуют защитные пленки.
В фармацевтической практике в присутствии защитных коллоидов получают препарат колларгол,
представляющий собой коллоидный раствор серебра, защищенный солями лизальбиновой и протальбиновой кислот.
Реакция восстановления аурата калия формальдегидом протекает по уравнению
26

При получении золя золота золотохлористоводородная кислота превращается в аурат калия по реакции
На образующихся микрокристаллах золота адсорбируются ионы аурата, являющиеся потенциалобразующими ионами. Противоионами служат ионы К+.
Состав мицеллы золя золота схематически можно изобразить так:
Согласно этой схеме, частицы золота имеют отрицательный заряд, равный х~.
Золь металлического серебра можно получить, восстанавливая разбавленные растворы солей серебра в щелочной среде танином. Танин (пентадигаллоилглюкоза) С76Н52O46, окисляясь, дает нерастворимые вещества – флобафены C76H52O49:
Строение мицеллы золя можно представить следующим образом:
Процессы окисления. Окисление применяют, в частности, для получения золей серы по реакции
Наряду с серой в реакциях окисления обычно образуются политионовые кислоты, главным образом пентатионовая кислота H2S5O6. Учитывая возможность стабилизации золя пентатионовой кислотой, можно записать формулу мицеллы следующим образом:
Реакции двойного обмена. Реакции двойного обмена позволяют получать многие золи труднорастворимых соединений. Например, при смешивании разбавленных растворов нитрата бария и сульфата калия при условии избытка одного из реагентов сульфат бария не выпадает в осадок, а образует коллоидный раствор.
Реакция между нитратом бария и сульфатом калия протекает по схеме
При проведении реакции в присутствии избытка нитрата бария мицелла золя будет иметь строение
Избыток сульфата калия приводит к образованию золя с частицами другого знака заряда:
27
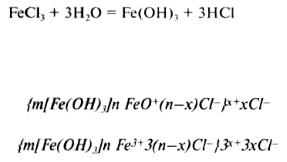
Методы гидролиза. Для получения золей гидроксидов тяжелых металлов применяют гидролиз.
Так, золь гидроксида железа получают по реакции
Степень гидролиза возрастает с повышением температуры и с увеличением разведения.
Возможны следующие схемы строения мицелл золя:
При получении золей методами химической конденсации следует отдавать предпочтение реакциям, при которых попутно с труднорастворимым соединением образуются вещества,
являющиеся неэлектролитами или слабыми электролитами. Это способствует получению более стабильных золей, так как в системе не образуются излишние электролиты, астабилизирующие золь. Примером такой реакции может служить окисление сероводорода кислородом воздуха.
Химическая конденсация в микрореакторах. В последнее время появились методы химической конденсации, связанные с образованием частиц очень мелких размеров – наночастиц
(размером порядка 10-9 м). В качестве микрореактора используется микроэмульсия, имеющая капли дисперсной фазы очень маленького размера. Рассмотрим пример образования нанодисперсных частиц полупроводника CdS. Если эмульсия представляет собой микрокапли водной фазы в органической дисперсионной среде, то в водной среде одной эмульсии может быть раствор Cd(NO3)2, а в другой – раствор NaS. При слиянии и перемешивании этих эмульсий и правильном выборе условий происходит попарное объединение капель и образование CdS в ходе реакции ионного обмена. Размер частиц дисперсной фазы ограничивается размерами капель, что позволяет получать практически монодисперсную систему.
Физическая конденсация. При физической конденсации дисперсная фаза получается без протекания химической реакции, но при возникновении условий, когда вещество переходит в пересыщенное состояние.
Замена растворителя. Этот метод основан на том, что раствор вещества прибавляют понемногу к жидкости, которая хорошо смешивается с растворителем, но в которой растворенное вещество настолько малорастворимо, что выделяется в виде высокодисперсной фазы. Примером могут служить гидрозоли серы, холестерина или канифоли, получаемые вливанием спиртовых растворов этих веществ в воду.
Конденсация паров. При пропускании паров какого-либо простого вещества в жидкость в результате конденсации могут образоваться стойкие золи. Сюда относятся электрические методы получения дисперсий металлов, распыляемых под водой или в органической жидкости в
28
вольтовой дуге (метод Бредига) и в искровом высокочастотном разряде (метод Сведберга).
Стабилизаторами для образующихся при конденсации паров дисперсий служат оксиды этих же металлов, являющиеся побочными продуктами процесса распыления. Оксиды адсорбируются на частицах металла и создают защитный слой. В природе при конденсации водяных паров в атмосфере образуются туман и облака.
С.З. Рогинским и А.И. Шальниковым был разработан эффективный способ получения золей из так называемых молекулярных пучков. Сущность метода заключается в том, что совместно испаряют в вакууме диспергируемое вещество и растворитель. Смешанные пары конденсируются и замораживаются на охлажденной поверхности. Затем смесь размораживают и собирают в сосуд.
Таким путем были получены труднодоступные золи многих веществ. Метод обеспечивает высокую чистоту получаемых золей.
29

68) ПОЛУЧЕНИЕ КОЛЛОИДНЫХ СИСТЕМ МЕТОДАМИ ДИСПЕРГИРОВАНИЯ
Диспергированием называют тонкое измельчение твердых материалов или жидкостей и распределение их частиц в жидкой или газообразной среде, в результате чего образуются
дисперсные системы: порошки, суспензии, эмульсии, аэрозоли.
Диспергирование может быть самопроизвольным и несамопроизвольным. Как известно, при
самопроизвольном процессе, в том числе и диспергировании, ΔG = Н – TΔS < 0.
В процессе диспергирования затрачивается определенная работа или эквивалентное ей
количество тепла. Эти затраты определяются изменением энтальпии Н. Для разрушения
существующих связей внутри тела необходимо преодолеть когезию (связь между молекулами,
атомами или ионами) внутри тела в пределах одной фазы и затратить определенную работу Wc.
После образования новых поверхностей раздела фаз реализуется определенная работа адгезии Wa
по отношению к окружающей среде. Поэтому изменение энтальпии можно представить в виде Н
= Wc + Wa.
При самопроизвольном диспергировании, соответствующем уменьшению свободной энергии Гиббса системы (ΔG < 0) должно реализовываться соотношение4 Н < 0, т.е. Wa > Wc.
Самопроизвольное диспергирование характерно для лиофильных систем. К таким системам относятся критические эмульсии, получаемые при введении большого количества (до 40%)
стабилизатора, высокодисперсные золи парафина в углеводородах и т.д.
При несамопроизвольном диспергировании ΔG > 0, тогда Н > 0 и Wa < Wc. Такая ситуация характерна для лиофобных систем, где адгезия веществ дисперсной фазы и дисперсионной среды незначительна. Здесь процесс диспергирования осуществляется за счет внешней энергии. Методы измельчения крупных образований до коллоидного состояния подразделяются на механические,
физические и физико-химические.
Механическое диспергирование. Это один из основных путей образования коллоидных систем в природе: при обвалах, выветривании, эрозии почв и т.д. Искусственное механическое диспергирование осуществляют с помощью различных способов измельчения. Такой процесс включает грубое, среднее и мелкое дробление. В основу действия машин-измельчителей положены принципы раздавливания, раскалывания, истирания, удара и др. Свойство материала противостоять разрушению называют прочностью. В процессе измельчения твердое тело испытывает деформации упругие и пластические. Упругие (обратимые) деформации после снятия нагрузки практически полностью исчезают. При пластических (необратимых) деформациях прекращение внешнего воздействия не приводит к восстановлению формы и размеров твердого тела. Прочность материала нарушается, форма его изменяется.
4 При диспергировании всегда ΔS > 0, поэтому следует учитывать также соотношение между TΔS и Н в величине ΔG.
30
