
Орг химия / 63-76_KOLLOIDNAYa_KhIMIYa
.pdfпротивоионов. Причем противоины адсорбционного слоя достаточно прочно связаны с твердой поверхностью и при движении частиц дисперсной фазы увлекаются частицами и перемещаются вместе с ними. В результате возникает второй потенциал, характеризующий ДЭС. Он называется
электрокинетическим или ζ-потенциалом (дзета-потенциалом) и представляет собой электрический потенциал в двойном слое на границе между частицей, способной к движению в электрическом поле, и окружающей жидкостью, ζ-потенциал является потенциалом поверхности скольжения. Величина ζ-потенциала определяет интенсивность электрокинетических явлений и рассчитывается по результатам их исследования В двойном электрическом слое точное расстояние от твердой поверхности до поверхности скольжения неизвестно, поэтому полагают, что поверхность скольжения проходит по границе между слоями противоионов: адсорбционным и диффузным. Следовательно, ζ-потенциал близок, хотя и не идентичен по величине, потенциалу на границе адсорбционного и диффузного слоев.
Электрокинетический потенциал численно равен работе, необходимой для переноса единичного положительного заряда из бесконечно удаленного элемента объема раствора на поверхность скольжении. Он является частью (φ-потенциала и всегда меньше, чем φ-потенциал
(рис. 7.1 в). Его знак совпадает со знаком φ-потенциала. Величина ^-потенциала непосредственно связана с числом противоионов в диффузном слое и изменяется пропорционально этому числу.
Поскольку электрокинетический потенциал относится к коллоидной частице и обусловливает ее подвижность в электрическом поле, величина этого потенциала может быть измерена экспериментально по скорости движения частиц. Направление же перемещения частиц к катоду или аноду указывает на знак ζ-потенциала.
Благодаря наличию ζ-потенциала на границах скольжения всех частиц дисперсной фазы возникают одноименные заряды и электростатические силы отталкивания противостоят процессам агрегации. Таким образом, ζ-потенциал является одним из основных факторов агрегативной устойчивости гидрофобных золей. Величина, а иногда и знаки φ- и ζ-потенциалов могут изменяться под влиянием внешних воздействий (электролитов, разведения, повышения температуры). Особенно чувствителен к этим факторам ζ-потенциал.
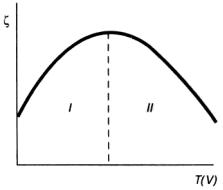
Зависимость ζ-потенциала золя от температуры и разведения V имеет вид, представленный на рис. 7.2. На участке 1 кривой в области умеренного повышения температуры ζ-потенциал растет.
Это можно объяснить тем, что с повышением температуры увеличивается кинетическая энергия противоионов. Преодолевая электростатические и ван-дер-ваальсовы силы притяжения, часть противоионов переходит из адсорбционного в диффузный слой, что приводит к увеличению его толщины.
Толщина диффузного слоя может быть рассчитана по аналогии с ионной атмосферой по теории Дебая-Гюккеля для растворов бинарных сильных электролитов:
11
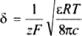 (7.2)
(7.2)
где z – заряд ионов, F– число Фарадея, Т – абсолютная температура, R – газовая постоянная, ε –
диэлектрическая проницаемость раствора, с – концентрация электролита.
Рис. 7.2. Влияние температуры и разведения на ζ-потенциал
Например, для 1–1 -зарядного электролита и Т = 300 К при с = 10-3 моль/л 5~10'8 м, при с = 10'5
моль/л 8~10-7 м. С ростом 8 возрастает и ζ-потенциал; устойчивость золя повышается. Второй участок кривой (область II) характеризуется понижением ζ-потенциала, объяснить которое можно проникновением процессов десорбции в глубинные области двойного электрического слоя.
Начинается отрыв ионов от внутренней обкладки ДЭС, т.е. потенциалобразующих ионов, что и приводит к понижению ^-потенциала и, как следствие, к уменьшению ζ-потенциала.
График зависимости ζ-потенциала от разведения имеет тот же вид. На участке I возрастание ζ-
потенциала связано переходом части противоионов из адсорбционного слоя в диффузный вследствие понижения общей концентрации электролита во всем объеме раствора; участок II
кривой, соответствующий чрезмерному разбавлению раствора, обусловлен дальнейшим развитием процесса десорбции, затрагивающего внутреннюю часть двойного слоя. Выход потенциалобразующих ионов в раствор приводит к уменьшению числа зарядов на поверхности частиц и понижению как φ-, так и ζ-потенциала.
12
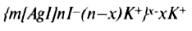
64) СТРОЕНИЕ КОЛЛОИДНЫХ ЧАСТИЦ ЛИОФОБНЫХ ЗОЛЕЙ.
Модельные представления о строении двойного электрического слоя позволяют построить мицеллу лиофобного золя. Согласно общепринятой мицеллярной теории строения коллоидных растворов, золь состоит из двух частей: мицелл и интермицеллярнои жидкости. Мицелла – это структурная коллоидная единица, т.е. частица дисперсной фазы, окруженная двойным электрическим слоем. Интермицеллярной (т.е. межмицеллярной) жидкостью называют дисперсионную среду, разделяющую мицеллы, в которой растворены электролиты, неэлектролиты и ПАВ, являющиеся стабилизаторами коллоидной системы. Частицы дисперсной фазы лиофобных золей имеют сложную структуру, которая зависит от условий получения золей.
Предположим, что золь иодида серебра образуется в ходе химической реакции между AgNO3 и
KI. При этом основу коллоидных частиц составят микрокристаллы труднорастворимого AgI,
включающие в себя т молекул AgI (а точнее, т пар ионов Ag+ и I-). Эти микрокристаллы называют агрегатами. Если реакция протекает в присутствии избытка иодида калия, то на поверхности агрегата возникает отрицательно заряженный слой в результате избирательной адсорбции п ионов I- . Ионы иодида в таком случае являются потенциалобразующими (ПОИ).
Агрегат вместе с потенциалобразующими ионами составляет частицу твердой фазы и его называют ядром. При адсорбции ионов I- ядро заряжено отрицательно и обладает поверхностным
φ-потенциалом. Под действием электростатических сил к ядру притягивается число п ионов противоположного знака – противоионов, компенсирующих заряд ядра. В данном случае эту роль выполняют ионы К+. Часть противоионов (п – х), наиболее близко расположенных к ядру,
находится в слое жидкости, смачивающем поверхность твердого ядра. Эти ионы испытывают действие не только электростатических, но и ван-дер-ваальсовых сил ядра, поэтому прочно удерживаются около него и образуют так называемый адсорбционый слой противоионов.
Остальные х противоионов, слабее связанных с ядром (только электростатически), под влиянием теплового движения располагаются в жидкой фазе диффузно и составляют диффузный слой противоионов. Все это образование вместе и является мицеллой. Мицеллы золей электронейтральны. Структуру мицеллы можно изобразить схемой (рис. 7.5) и записать в виде формулы:
где т – число молекул, входящих в состав агрегата; п – число потенциалобразующих ионов; (п
–х) – число противоионов, входящих в адсорбционный слой, х – число противоионов, образующих диффузный слой, численно равное формальному заряду коллоидной частицы. Числа т, п и x могут изменяться в широких пределах в зависимости от условий получения и очистки золя. Обычно т
>> п. Ядро вместе с адсорбционным слоем противоионов образуют собственно коллоидную
13
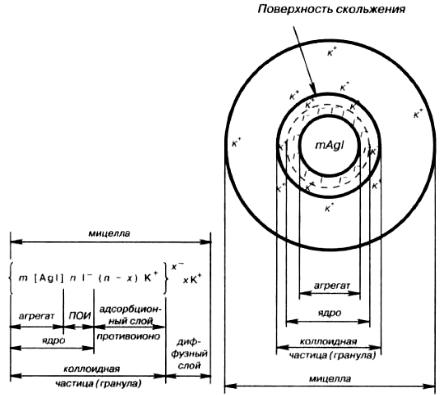
частицу, или гранулу. В отличие от электронейтральной мицеллы коллоидная частица имеет заряд, в данном случае – отрицательный (х-). Граница между коллоидной частицей и диффузным слоем практически является границей (или поверхностью) скольжения. В формуле мицеллы этой границе соответствует фигурная скобка между адсорбционным и диффузным слоями (на рис. 7.5 –
сплошная линия, отмечающая поверхность скольжения). Граница скольжения обозначает ту геометрическую поверхность, по которой происходит разделение («разрыв») мицеллы на коллоидную частицу и диффузный слой в случае ее перемещения относительно дисперсионной среды (например, при участии мицеллы в броуновском движении или при движении под действием электрического поля). Таким образом, коллоидная частица обладает зарядом, знак которого совпадает со знаком потенциалопределяющих ионов, а величина пропорциональна количеству противоионов в диффузном слое. Поскольку граница коллоидной частицы проходит по плоскости скольжения, то ее потенциал соответствует электрокинетическому или ζ-
потенциалу, определяющему агрегативную устойчивость гидрофобных золей и электрокинетические свойства дисперсных систем. Величина х, а следовательно, и ζ-потенциал зависят от концентрации и состава электролита в интермицеллярной жидкости.
Рис. 7.5. Схема строения мицеллы золя иодида серебра с отрицательно заряженными частицами
14
65) ЭЛЕКТРОКИНЕТИЧЕСКИЕ ЯВЛЕНИЯ
К электрокинетическим явлениям относят эффекты, связанные либо с относительным движением двух фаз под действием постоянного электрического поля, либо с возникновением разности потенциалов при относительном смещении двух фаз, на границе между которыми существует двойной электрический слой.
Электрокинетические явления основаны на взаимосвязи между электрическим полем и полем скоростей (кинетическим). Их принято подразделять по причинно-следственной связи на две группы: прямые и обратные. К прямым относят те электрокинетические явления, которые возникают под действием внешнего электрического поля (электрофорез и электроосмос).
Обратными называют электрокинетические явления, в которых при механическом перемещении одной фазы относительно другой возникает электрический потенциал (потенциал протекания и потенциал седиментации).
Электрофорез и электроосмос были открыты профессором Московского университета Ф.Ф.
Рейссом (1808). Исследуя электролиз воды, он заполнил U-образную трубку толченым кварцем и приложил внешнее напряжение к электродам. Через некоторое время в колене, где находился отрицательный электрод, наблюдалось поднятие уровня воды, в другом – опускание (рис. 7.6 а).
После выключения электрического поля уровни воды в коленах трубки уравнивались. Это явление перемещения дисперсионной среды относительно неподвижной дисперсной фазы в постоянном электрическом поле названо электроосмосом. В другой серии опытов было показано, что если во влажную глину погрузить две стеклянные трубки, заполнить их водой и поместить в них электроды, то при пропускании постоянного тока происходит движение частичек глины к положительному электроду (рис. 7.6 б). Явление перемещения частиц дисперсной фазы в постоянном электрическом поле было названо электрофорезом.
Позже Квинке (1859) обнаружил явление, обратное электроосмосу и названное потенциалом протекания. Оно состоит в том, что при течении жидкости под давлением через пористую диафрагму (рис. 7.7 а) возникает разность потенциалов. В качестве материала диафрагм были испытаны глина, песок, дерево, графит и т.п. Явление, обратное электрофорезу и названное
потенциалом седиментации, было открыто Дорном (1878). Часто потенциал седиментации называют эффектом Дорна. Оказалось, что при оседании частиц суспензии кварца под действием силы тяжести возникает разность потенциалов между уровнями разной высоты в сосуде (рис. 7.7
б).
15
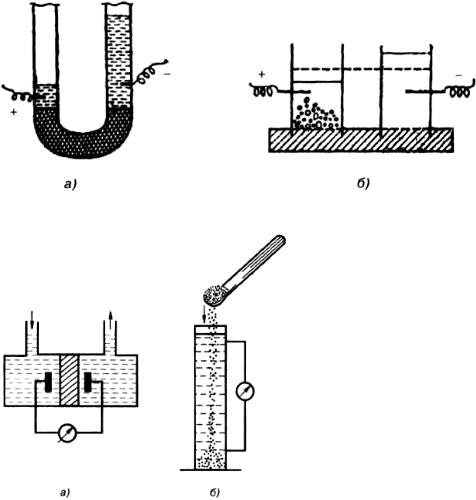
Рис. 7.6. Схемы опытов Рейсса по электроосмосу (а) и электрофорезу (б)
Рис. 7.7. Схема установок для наблюдения за потенциалом протекания (а) и потенциалом седиментации (б)
Все электрокинетические явления основаны на наличии двойного электрического слоя на границе твердой и жидкой фаз. Поскольку относительное смещение фаз происходит по плоскости скольжения, то все электрокинетические явления выражены тем сильнее, чем более подвижен заряд диффузного слоя и выше ζ-потенциал границы скольжения. Таким образом, ζ-потенциал является мерой электрокинетических явлений и может быть вычислен на основе измерения их параметров.
Наиболее широкое применение из всех описанных электрокинетических явлений имеют электрофорез и электроосмос.
Электрофорез. При электрофорезе под действием постоянного электрического поля происходит направленное перемещение частиц дисперсной фазы к электроду, знак которого противоположен знаку заряда частиц. Движение частиц в электрическом поле обусловлено разрывом двойного электрического слоя частиц по границе скольжения, в результате которого частицы получают заряд, соответствующий ζ-потенциалу. Противоионы диффузного слоя перемещаются при этом к противоположному электроду. Согласно рис. 7.8 а, отрицательно
16
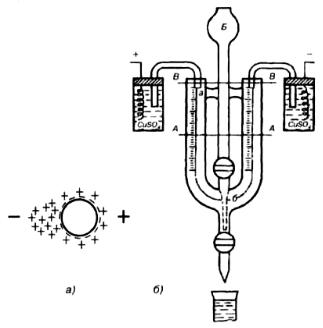
заряженные частицы перемещаются к аноду, а диффузный слой – к катоду. Скорость движения частиц дисперсной фазы пропорциональна величине их ζ-потенциала. Наблюдая электрофоретическое движение частиц, можно определить знак и величину ζ-потенциала.
Техника проведения электрофоретических измерений может быть различной: в виде
макроэлектрофореза (метод подвижной границы) или микроэлектрофореза, когда ведется наблюдение за отдельными частицами дисперсной фазы с помощью микроскопа. Основной частью прибора для проведения макроэлектрофореза является U-образная трубка, в оба колена которой помещены электроды (рис. 7.8 б). Трубку до уровня А–А заполняют контактной жидкостью, через воронку с краном Б вводят исследуемый золь до тех пор, пока жидкость не поднимется до уровня В- В. Контактная жидкость и исследуемый золь должны иметь одинаковую электрическую проводимость.
Рис. 7.8. Схема электрофореза (а) и прибор для электрофореза по методу подвижной границы
(б)
Величина ζ-потенциала связана со скоростью электрофореза заряженных непроводящих частиц уравнением Гельмгольца–Смолуховского, выведенного из баланса движущих сил процесса – электрической силы и силы трения в жидкости:
 (7.3)
(7.3)
где: η – вязкость среды (Па·с); v – линейная скорость перемещения частиц (или границы золя)(м/с); ε – относительная диэлектрическая проницаемость среды ( для воды ε = 81); ε0 –
электрическая постоянная (8,85·1012 Ф/м); Н – напряженность внешнего электрического поля
17
(градиент потенциала, В/м)).
Линейная скорость v изменяется пропорционально напряженности поля Н, поэтому не может служить характеристикой частиц. В связи с этим используют понятие подвижности иравной скорости движения частицы в единичном электрическом поле (Н = 1 В/м):
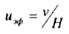 (7.4)
(7.4)
С учетом (7.4) уравнение Гельмгольца-Смолуховского принимает вид:
 (7.5)
(7.5)
Электрофоретическая подвижность различных частиц имеет величину, определяемую их природой: для золей иэф= (0,4-0,8)·10-8 м2/(с·В); для эритроцитов животных иэф = (1,0-1,7)·10-8
м2/(с·В). Экспериментально найденные значения подвижностей в ряде случаев оказываются меньше расчетных. Несовпадение этих величин объясняется релаксационным эффектом и электрофоретическим торможением, которые не учитываются теорией Гельмгольца-
Смолуховского. Первый из этих эффектов вызывается нарушением симметрии диффузного слоя вокруг частиц. Второй эффект обусловлен добавочным трением электрической природы при движении частиц и противоионов в противоположные стороны. Хюккель ввел в выражение для
иэф поправку 2/3 на электрофоретическое торможение. Позднее Генри показал, что учет электрофоретического торможения справедлив в случаях, когда размер частиц сравним с толщиной диффузного слоя (δ), уменьшаясь с увеличением радиуса (r) частиц. При r/δ > 100 для расчета иэф и ζ-потенциала справедливы уравнения (7.4) и (7.5). Данное условие соответствует r > 10-6 м в 10-3 М растворе 1-1 зарядного электролита или r > 10-5 м в 10-5 М растворе.
Если представить линейную скорость v как отношение линейного смещения границы золя s ко времени опыта t, а напряженность электрического поля Н – как отношение приложенного напряжения Е к межэлектродному расстоянию l (на рис. 7.8б, по линии абв), то величину электрофоретической подвижности иэф можно найти из эксперимента, воспользовавшись формулой:
 (7.6)
(7.6)
При определении ζ-потенциала частиц, находящихся в разбавленных водных растворах при
20°С, пригодно соотношение ζ = 1,42-106 иэф. Величину ζ-потенциала выражают в В или мВ.
Значения ^-потенциала для коллоидных растворов обычно лежат в пределах от 1,5 до 75 мВ.
Электрофорез является мощным средством для изучения биологических объектов. С его помощью изучают фракционный состав и свойства сложных природных белков (метод Тизелиуса), свойства энзимов, вирусов, бактерий, форменных элементов крови и др. С помощью электрофореза можно выделять из суспензий взвешенные частицы, а также производить покрытие
18
твердых частиц поверхностей слоем других веществ (декоративные и антикоррозийные покрытия,
электроизоляционные пленки и т.д.).
Электрофорез применяют для очистки фармацевтических препаратов. Так, возможно установление степени чистоты по электрофоретической однородности ряда антибиотиков,
витаминов и других веществ. Электрофорез (ионофорез) является одним из методов введения лечебных препаратов в организм человека.
Электрофорез на бумаге, агаровом или крахмальном геле, нашел широкое применение как аналитический и препаративный метод разделения и выделения различных лекарственных веществ и биологически активных соединений.
Наконец, методы электрофореза с успехом используются при диагностике ряда заболеваний
(путем сравнения фракционного состава нормальных и патологических биологических жидкостей).
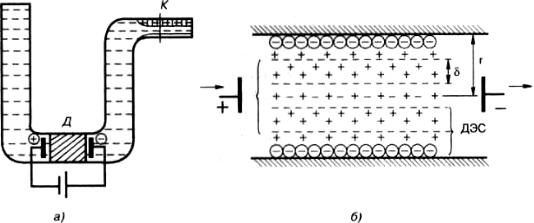
Электроосмос, как и электрофорез, нашел самое широкое применение. Для его наблюдения применяют приборы, схема одного из которых приведена на рис. 7.9.
Рис. 7.9. Прибор (а) и структура двойного электрического слоя в капилляре диафрагмы
(стрелками показано направление движения жидкости) (б)
Основными элементами прибора являются U-образная трубка, пористая диафрагма Д
(мембрана) и капилляр К. С обоих сторон от мембраны расположены электроды, соединенные с источником постоянного тока. В качестве материала для мембраны используют силикагель,
глинозем, стеклянные капилляры, толченое стекло или кварц, различные нерастворимые порошки.
Прибор заполняют раствором электролита и отмечают исходный уровень в капилляре. После включения тока уровень жидкости в капилляре смещается влево или вправо в зависимости от направления течения жидкости. Направление переноса жидкости указывает на знак ^-потенциала поверхности мембраны. Скорость переноса жидкости позволяет вычислить ^-потенциал по уравнению Гельмгольца–Смолуховского:
19
 (7.7)
(7.7)
где η – вязкость жидкости (Па с); κ – удельная электрическая проводимость жидкости (См/м); v
– объемная скорость течения жидкости (м3/с); I – сила тока (А); ε– диэлектрическая постоянная жидкости; ε0 – электрическая постоянная.
Для характеристики природы мембраны обычно используют не объемную скорость течения жидкости v, которая зависит от поперечного сечения пор мембраны, а отношение v к силе тока I,
т.е. v/I. Это отношение выражает объем жидкости, перенесенный в единицу времени на единицу количества электричества и при постоянной силе тока, является для данного состояния мембраны величиной постоянной.
Механизм электроосмоса поясняется рис. 7.9б. В порах мембраны при контакте с жидкостью формируется двойной электрический слой. При наложении внешнего электрического поля противоионы диффузного слоя перемещаются к электроду соответствующего знака. Ионы в воде всегда гидратированы, поэтому при их движении с ними увлекается определенный объем дисперсионной среды за счет сил молекулярного трения (вязкости) между гидратной оболочкой иона и окружающей жидкостью. Чем больше толщина диффузного слоя и меньше площадь поперечного сечения капилляра или поры мембраны, тем сильнее проявляется электроосмотический перенос жидкости. Например, силикаты, входящие в состав стекла, на границе с водой диссоциируют с образованием ионов SiO- и Na+. За счет ионов SiO- поверхность стеклянного капилляра заряжается отрицательно (потенциалобразующие ионы), а прилегающие слои воды приобретают положительный заряд в результате накопления ионов Na+ (противоионы).
При приложении постоянного электрического поля жидкость в капиллярах перемещается к отрицательному электроду.
Рис. 7.10. Схема сушки методом электроосмоса
При большом радиусе капилляров (r >3·10-3 м) доля в объеме капилляра, приходящаяся на двойной электрический слой, значительно уменьшается, ионы диффузного слоя не могут увлечь с собой значительный объем жидкости в капилляре и явление электроосмоса не наблюдается.
Электроосмос широко применяется в процессах обезвоживания и сушки многих пористых материалов или весьма концентрированных коллоидных систем. Для этой цели могут быть
20
