
Орг химия / 23-30_Galogenalkany_gidroxisoedinenia
.pdf
Физические свойства
Двухатомные и трехатомные спирты представляют собой жидкости или кристаллические вещества с высокими температурами кипения и плавления (наличие водородных связей). Отличительной особенностью спиртов с несколькими гидроксильными группами является их сладковатый вкус, усиливающийся с увеличением числа ОН-групп.
Химические свойства
Двух- и трехатомные спирты вступают в аналогичные одноатомным спиртам реакции. Однако различное количество гидроксильных групп в спиртах определяет и некоторые их особенности.
Кислотные свойства. С увеличением числа гидроксильных групп в молекуле кислотные свойства спиртов усиливаются. Это связано с электроноакцепторным влиянием одной гидроксильной группы на другую (–I-эффект).
Гликоли являются более сильными ОН-кислотами, чем одноатомные спирты. Они образуют алкоголяты (гликоляты) не только со щелочными металлами, но и другими активными металлами (Al, Mg и т. д.), а также со щелочами и гидроксидами тяжелых металлов.
α-Гликоли способны реагировать с гидроксилом меди (II) с образованием комплексных соединений. Данная реакция является качественной на спирты, содержащие α-гликольный фрагмент.
21

Образование простых и сложных эфиров. Гликоли образуют неполные и полные производные при взаимодействии со спиртами (простые эфиры), кислородсодержащими минеральными или карбоновыми кислотами (сложные эфиры).
Окисление. Окисление гликолем в зависимости от природы окислителя может протекать поразному:
Для идентификации α-гликолей используют реакцию окисления йодной кислотой НIO4.
При окислении происходит разрыв химической связи между углеродными атомами α- гликольного фрагмента и образуются соответствующие карбонильные соединения. По продуктам окисления устанавливают положение диольного фрагмента вмолекуле.
Дегидратация. Гликоли под действием водотнимающих реагентов подвергаются внутри- и межмолекулярной дегидратации. Направление реакций определяется условиями их проведения.
22

Глицерин подвергается внутримолекулярной дегидратации с образованием непредельного альдегида акролеина:
Поликонденсация. Этиленгликоль в результате реакции поликонденсации способен образовывать полиэфир – полиэтиленгликоль HO–[–CH2–CH2–O]n–H
Полиэтилен гликоль с молекулярной массой до 400 используют в фармации в качестве растворителя лекарственных веществ, основы для мазей, связывающего вещества в производстве таблеток.
23
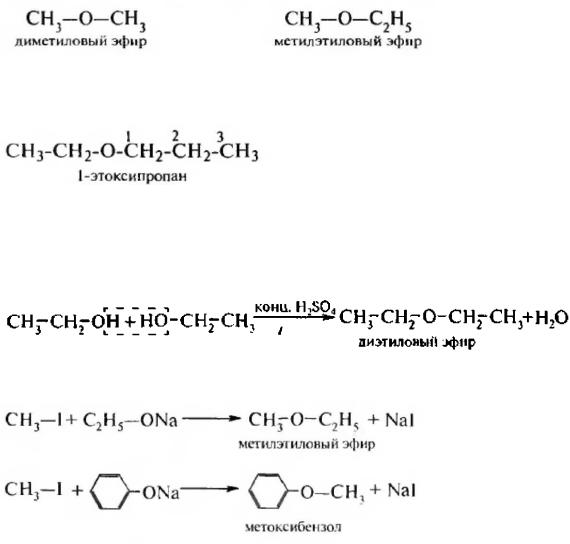
27) НОМЕНКЛАТУРА, ИЗОМЕРИЯ И СПОСОБЫ ПОЛУЧЕНИЯ ПРОСТЫХ ЭФИРОВ
Простыми эфирами называют органические соединения, в которых два углеводородных радикала соединены атомом кислорода.
Общая формула простых эфиров R–О–R', где R, R' –- углеводородные радикалы.
Различают симметричные простые эфиры (содержат одинаковые углеводородные радикалы) и несимметрические или смешанные (углеводородные радикалы различны).
По радикало-функциональной номенклатуре названия простых эфиров образуют путем добавления к названию углеводородных радикалов суффикса -овый и слова эфир. В смешанных простых эфирах углеводородные радикалы перечисляют в алфавитном порядке.
По заместительной номенклатуре ИЮПАК простые эфиры рассматривают как производные углеводородов, в которых атом водорода замешен алкоксигруппой RO–. Более сложный по структуре радикал принимают за родоначальную структуру.
Простые эфиры – бесцветные легколетучие жидкости с характерным запахом, плохо растворимы в воде, хорошо растворимы в органических растворителях.
Способы получения
1.Межлюлекулярная дегидратация спиртов. При нагревании спиртов в присутствии концентрированной серной кислоты образуются простые симметричные эфиры.
2.Синтез Вильямсона. Алкилирование алкоголятов и фенолятов алкилгалогенидам и позволяет получить несимметричные простые эфиры.
24

28) ХИМИЧЕСКИЕ СВОЙСТВА ПРОСТЫХ ЭФИРОВ
Простые эфиры являются достаточно инертными веществами.
Образование оксониевых солей. Наличие в молекуле простого эфира атома кислорода со свободной электронной парой определяет их основные свойства. При взаимодействии простых эфиров с концентрированными минеральными кислотами образуются оксониевыесоли.
Расщепление простых эфиров.
а) Расщепление под действием щелочных металов. Простые эфиры под действием щелочных металлов (Na, К, Li) при нагревании способны расщепляется с образованием алкоголятов и натрийорганических соединений.
б) Расщепление под действием кислот (ацидолиз). Простые эфиры разлагаются концентрированной йодоводородной кислотой уже на холоду с образованием алкилйодида и спирта.
Реакция проходит по механизму SN2.
Если реакцию проводят при нагревании, то образуется вторая молекула этилйодида.
Окисление простых эфиров. Простые эфиры окисляются на воздухе при нормальной температуре. Легче всего окисление протекает по α-углеродному атому
Образующиеся пероксиды неустойчивы, легко взрываются. Работать с эфирами необходимо с большой осторожностью, предварительно убедившись в отсутствии пероксидных соединений.
ТИОЛЫ. ТИОЭФИРЫ
Тиолами (тиоспиртами, меркаптанами) называют соединения общей формулы R–SH (аналоги спиртов). Их можно рассматривать как производные сероводорода H2S, в котором один атом водорода замешен углеводородным радикалом.
По систематической номенклатуре названия тиолов образуют путем добавления к названию родоначального углеводорода суффикса -тиол. Префикс меркапто- используют, если в молекуле SH-rpynna не является старшей.
По рациональной номенклатуре тиолы называют меркаптанами.
25
Тиолы представляют собой жидкие или твердые вещества (за исключением метантиола), с неприятным запахом, ядовиты.
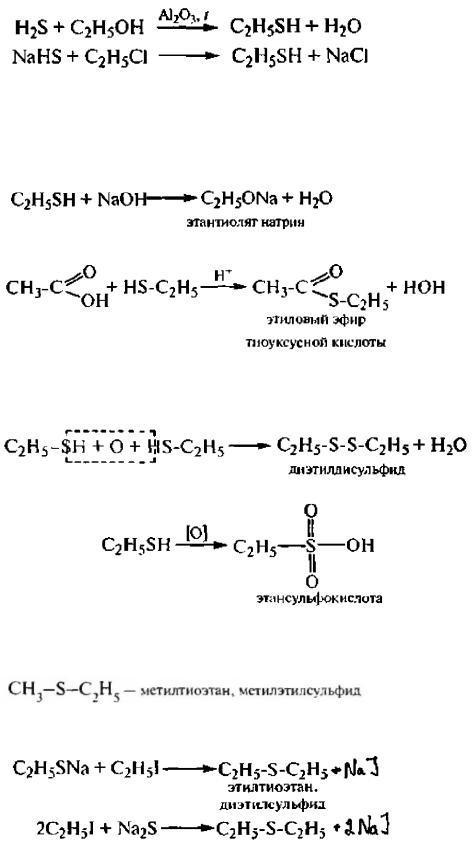
Получают тиолы из сероводорода и его кислых солей реакцией алкнлирования галогеналканами или спиртами.
Химические свойства
Тиолы во многом сходны со спиртами, обладают более выраженными кислотными свойствами. Реакции обусловлены поляризацией связи S–Н и нуклеофильными свойствами атома серы.
Образование тиолятов (меркаптидов). Тиолы образуют соли не только со щелочным и металлами, но и их гидроксидами, а также ионами тяжелых металлов.
Ацилирование. Реакция аналогична этерификации карбоновых кислот.
Окисление. В отличие от спиртов тиолы окисляются не по углеродному атому, а по атому серы. При окислении тиолов в мягких условиях (Н2О2, CuCl3 и др.) образуются диалкилдисульфиды, в жестких (КМnO4, HNO3 или НOI) – сульфокислоты.
Тиоэфирами (сульфидами) называют производные сероводорода H2S, в которых два атома водорода замещены углеводородными радикалами. Их можно рассматривать как тиоаналоги простых эфиров (R-S-R').
Получают сульфиды в результате алкилирования алкилгалогенидами тиолятов и сульфидов щелочных металлов.
Сульфиды – бесцветные вещества с неприятным запахом. Практически нерастворимы в воде. При взаимодействии с кислотами образуют сульфониевые соли:
26
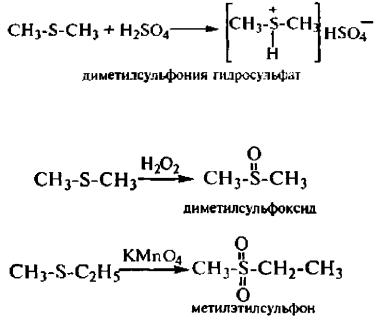
Окисление сульфидов в зависимости от природы окислителя и условий реакции протекает с образованием сульфоксидов R2SO или суль-фонов R2SO2
Сульфоксиды менее стабильны, чем сульфоны. Сульфоксиды относительно легко окисляются до сульфонов и восстанавливаются до сульфидов.
27

29) НОМЕНКЛАТУРА, ИЗОМЕРИЯ И СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ ФЕНОЛОВ
Фенолами называют производные ароматических углеводородов, у которых один или несколько атомов водорода в ароматическом ядре замешены на гидроксильную группу.
По числу гидроксильных групп фенолы делят на: одноатомные, двухатомные, трех- и полнатомные.
ОДНОАТОМНЫЕ ФЕНОЛЫ
К одноатомным фенолам относятся гидроксилсодержашие ароматические соединения, имеющие в своем составе одну гидроксильную группу:
Для названия фенолов применяют заместительную номенклатуру, в этом случае перед названием арена ставится префикс -гидрокси.
При наличии заместителей в ароматическом ядре за родоначальную структуру берут фенол. Наряду с заместительной номенклатурой в ряду фенолов широко применяются тривиальные
названия.
Метильные производные фенола называют крезолами, а 2-изо-пропил-5-метилфенол называют тимолом.
Для некоторых фенолов чаще используют тривиальные названия (ксилол, тимол и т. д.). Для названия гомологов фенола в качестве основы используют слово фенол.
Способы получения
1.Природные источники. Фенол получают при сухой перегонке каменноугольной смолы. Вторая фракция с tкип 150-230 °С содержит фенол. Впервые фенол был получен таким способом Ф. Рунге
в1834 г.
2.При нагревании галогенопроизводных бензола со щелочами в присутствии катализатора:
3.Сплавление натриевых солей сульфокислот со щелочами:
28
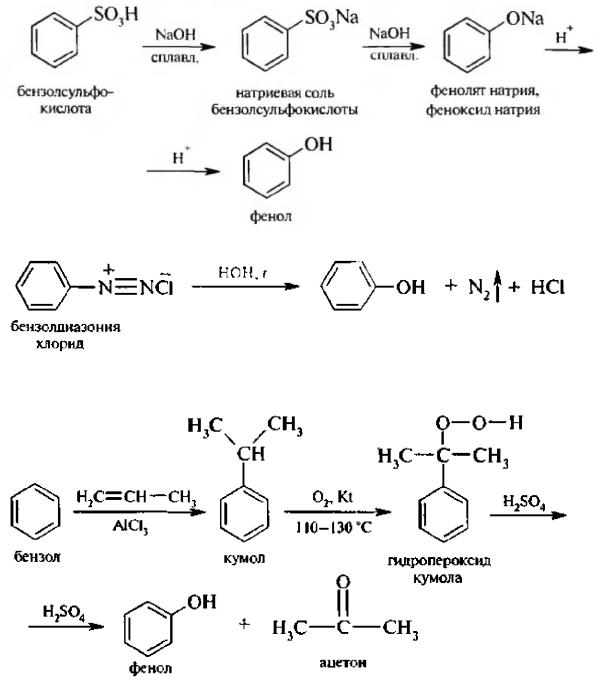
4.Разложение солей диазония:
5.Окисление кумола (кумольный способ). Это основной промышленный способ получения фенола:
Способ является экономически выгодным, так как позволяет кроме фенола получить и другой важный продукт – ацетон.
29

30) ХИМИЧЕСКИЕ СВОЙСТВА ФЕНОЛОВ
Для фенолов характерны два направления реакций: реакции по фенольному гидроксилу и по ароматическому ядру
Вмолекуле фенола имеет место сопряжение неподеленной пары электронов атома кислорода гидроксильной группы с π-электронами бензольного ядра. Это приводит к довольно сильной поляризации связи O←Н, что объясняет более выраженный кислотный характер фенолов в сравнении со спиртами. Атомы водорода гидроксильной группы приобретают подвижность и довольно легко замешаются на другие атомы или атомные группы.
С другой стороны, наличие положительного мезомерного эффекта приводит к укорачиванию связи С-ОН, что делает практически невозможными реакции замещения фенольного гидроксила.
Реакции с участием группы ОН
1. Кислотные свойства. Фенолы обладают кислотным характером, они способны образовывать соли уже при действии щелочей:
Вводном растворе феноляты подвергаются частичному гидролизу т. к. образованы слабой кислотой и сильным основанием. По этой причине их растворы имеют щелочную реакцию. Минеральные кислоты, втом числе и угольная, вытесняют фенолы из их солей.
На кислотность фенола оказывают влияние заместители в ароматическом ядре. При наличии в п-положении электроноакдепторных заместителей (–NO2, –Br, –Cl, –CN и др.) кислотные свойства усиливаются. Если в п-положение ввести электронодонорные заместители (-NH2, -ОСН3 и др.), то происходит снижение кислотных свойств, поскольку уменьшается смешение электронов связи О–
Нк атому кислорода, что затрудняет отрыв протона:
2. Образование простых и сложных эфиров. Простые эфиры фенола непосредственно из фенола получить не удается. Для их получения испапьзуют реакцию Вильямсона: взаимодействие феноксида натрия с галоидными алкилами или арилами.
При взаимодействии фенолятов с галогенаренами образуются ароматические простые эфиры:
30
