
Орг химия / 23-30_Galogenalkany_gidroxisoedinenia
.pdf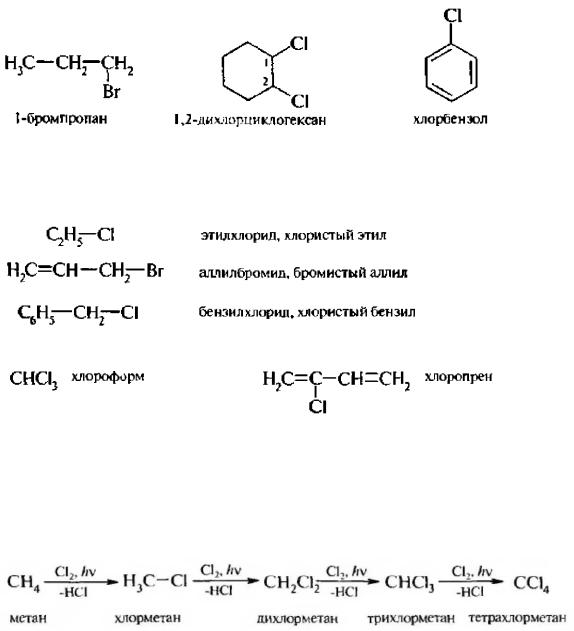
23) НОМЕНКЛАТУРА, ИЗОМЕРИЯ И СПОСОБЫ ПОЛУЧЕНИЯ ГАЛОГЕНОПРОИЗВОДНЫХ УГЛЕВОДОРОДОВ
К галогенопроизводным углеводородов относят соединения, у которых один или несколько атомов водорода замешены на атомы галогенов.
Галогенопроизводные углеводородов классифицируют в зависимости от природы углеводородного радикала (алифатические, ал и циклические и ароматические), числа атомов галогена в молекуле (моно-, ди-, три- и поли галогенопроизводные), характера галогена (фтор-, хлор-, бром-, иод-произволные). характера атома углерода, с которым связаны атомы галогена (первичные, вторичные и третичные галогенопроизводные).
Номенклатура
По заместительной номенклатуре ИЮПАК названия галогено-производных углеводородов составляют аналогично названиям соответствующих углеводородов. Вначале цифрой указывают положение замещения (если это необходимо), затем называют галоген (если нужно – перед ним количество атомов) и прибавляют название родоначальной структуры (в алифатических галогенопроизводных это главная углеродная цепь, в алициклических и ароматических – цикл).
Нумерацию начинают с ближнего к галогену конца углеродной цепи.
Простейшие галогенопроизводные называют и по радикало-функциональной номенклатуре. Тогда названия составляют из названия углеводородного радикала, связанного с галогеном, и суффикса -фторид, -хлорид, -бромид или -йодид или прибавлением слов: фтористый, хлористый, бромистый, йодистый.
За некоторыми галогенопроизводными сохранил нетривиальные названия:
Способы получения
Существует много разнообразных методов введения галогена в молекулу соединения. Рассмотрим наиболее общие,
1. Галогетрование алканов. Взаимодействие алканов с галогенами протекает по свободнорадикальному механизму SR при УФ-облучении.
1

Недостатком этого способа является образование смеси моно-, ди- и полигалогеналканов.
2. Присоединение галогеноводородов к алкенам. Реакция идет обычно на холоду, способ особенно удобен для получения моногалогенопроизводных, так как реакция не сопровождается образованием побочных продуктов полигалогенопроизводных.
Механизм реакции АЕ – электрофильное присоединение.
3. Взаимодействие спиртов с галогенирующими реагентами. Часто галогенопроизводные получают замещением гидроксильной группы спиртов на галоген. Для этого используют галогеноводороды (НСl, НВr, HI), галогениды фосфора (PCl3, PCl5, РВr3, РВr5), тионилхлорид
(SOCl2).
Взаимодействие спиртов с галогеноводородами протекает по схеме:
Легче всего замешается на галоген гидроксильная группа у третичного атома углерода. Проводить реакцию с первичными спиртами необходимо в присутствии катализаторов; минеральных кислот, галогенидов цинка и т.д.
С более высокими выходами галогеналканы образуются при взаимодействии спиртов с галогенидами фосфора (III) или фосфора (V), а также тионилхлоридом:
4.Взаимодействие галогеналкаков с солями галогеноводородных кислот (реакция Финкельштейна).
Реакцию используют для получения фторили йодалканов из более доступных хлорили бромпроизводных:
5.Реакциюгалогенироваиия аренов. Реакция протекает по ионному механизму в присутствии катализаторов хлоридов металлов АlСl3, FeBr3, SbCl3:
Катализатор способствует образованию положительного иона галогена, который осуществляет замещение в бензольном ядре.
6. Реакцию солей арилдиазония с галогеиидами меди:
2

Для введения галогена в боковую углеродную цепь используют:
Физические свойства
Низшие галогеналканы –газы или жидкости со своеобразным сладковатым запахом, средние – жидкости, высшие – твердые вещества. Большинство из них практически нерастворимы и воде, но легко растворяются в органических растворителях.
3

24) ХИМИЧЕСКИЕ СВОЙСТВА ГАЛОГЕНПРОИЗВОДНЫХ УГЛЕВОДОРОДОВ
Галогеналканы обладают высокой реакционной способностью и для них характерны реакции нуклеофильного замещения (SN), элиминирования (отщепления) (Е). Они также вступают в реакции восстановления и взаимодействуют с некоторыми металлами.
Реакции нуклеофильного замещения
Способность галогеналкаиов вступать в реакции SN обусловлено полярностью связи углеродгалоген. Атом галогена, имея большую электроотрицаггельность, чем атом углерода, смешает на себя электронную плотность связи С-Hal. В результате атом галогена приобретает частичный отрицательный заряд (δ-), а атом углерода – частичный положительный заряд (δ+). Галогеналканы вступают в реакции с нуклеофильными реагентами, и при этом происходит замещение галогена на нуклеофил.
В зависимости от строения галогеналкана, природы нуклеофила и растворителя реакции SN протекают по двум основным направлениям: SN1 и SN2.
Механизм SN2 (бимолекулярное нуклеофильное замещение)
По механизму SN2 реагируют первичные и несколько труднее вторичные галогеналканы. Реакция протекает в одну стадию через образование переходного состояния. Вначале нуклеофил атакует атом углерода, связанный с галогеном (электрофильный центр), со стороны, противоположной связи С-Hal , т. е. атака идет с тыла, В результате происходит постепенное вытеснение нуклеофилом галогенид-иона (уходящей группы). Этот процесс включает переходное состояние, т. е. момент, когда связь С-Hal еще не разорвалась, а связь C-Nu еще не полностью образовалась.
Образование переходного состояния сопровождается изменением гибридного состояния атома углерода с sр3 на sp2, Одна доля негибридизованной р-атомной орбитали атома углерода в переходном состоянии частично перекрывается с орбиталью атакующего нуклеофила, а вторая – с орбиталью атома галогена.
Возвращение атома углерода в sр3-гибридное состояние после отщепления галогенид-иона происходит с обращением конфигурации.
4

Протеканию реакции по механизму SN2 способствуют активные нуклеофильные реагенты – они легче образуют переходное состояние – и апротонные растворители. поскольку протонные полярные растворители сольватируют нуклеофил, тем самым снижая его реакционную способность.
По предложению английского химика К. Ингольда описанный механизм получил обозначение SN2. Буква S указывает на замещение. N – на нукдеофильный тип реакции, а цифра 2 обозначает, что реакция является бимолекулярной, т. е. в стадии, определяющей скорость реакции в целом (в данном случае образование переходного состояния), участвует два реагента (галогеналкан и нуклеофил). Скорость реакций, протекающих по механизму зависит от концентрации обоих реагентов.
Механизм SN1 (мономолекулярное нуклеофильное замещение)
Поэтому механизму происходит нуклеофильное замещение в третичных и, в определенных условиях, во вторичных галогеналканах. В молекуле третичных галогеналканов объемные заместители при атоме углерода, связанном с галогеном, создают пространственные препятствия для подхода нуклеофила к электрофильному центру, и его атака с тыла становится невозможной. Вместе с тем третичные галоген-алканы способны в сильнополярных средах к ионизации. По механизму SN1 реакция протекает в две стадии:
На первой стадии происходит диссоциация молекулы галогеналкана при участии молекул протонного полярного растворители. В результате образуются карбкатион и галогенил-ион. Поскольку процесс ионизации протекает медленно, то 1 стадия определеят скорость всей реакции. На второй стадии образовавшийся карбкатион быстро реагируете нуклеофилом.
Протеканию реакции по механизму SN1 способствуют высокая ионизирующая и сольватирующая способность растворителя, а также стабильность образующегося карбкатиона. Устойчивость алкильных карбкатионов обусловлена делокализацией положительного заряда за счет +I-эффекта алкильных групп и возрастает в ряду:
Поэтому третичные галогенопроиэводные легче всего подвергаются ионизации.
5

Механизм нуклеофильного замещения, протекающий по рассмотренной схеме, называется мономолекулярным, т. к. на стадии, определяющей скорость всего процесса (стадия 1), принимает участие молекула только одного реагента – галогеналкана. Такой механизм обозначают SN1.
Таким образом, на основании вышеизложенного можно сделать вывод, что первичные галогеналканы обычно реагируют по механизму SN2, третичные – по механизму SNl. Вторичные галогеналканы, в зависимости от природы нуклеофила и растворителя, могут реагировать как по механизму SN2, так и по механизму SN1.
1.Гидролиз галогеналканов. Галогеналканы гидролизуются до спиртов. Реакцию обычно проводят в присутствии водных растворов щелочей, т. к. с водой она протекает медленно.
2.Реакция Вильямсона. Эта реакция является одним из лучших способов получения простых эфиров. Она заключается во взаимодействии галогеналканов с алкоголятами или фенолятами.
3.Взаимодействие с солями карбоновых кислот (ацетолиз). При действии солей карбоновых кислот на галогеналканы образуются сложные эфиры. Реакцию проводят в среде апротонного полярного растворителя.
4.Взаимодействие с аммиаком, алкил- и ариламинамц (аммонолиз и аминолиз). При взаимодействии с аммиаком и аминами галогеналка-ныадкилируют их с образованием смеси первичных, вторичных и третичных аминов, а также солей – четвертичных аммониевых оснований. Например, первичный амин образуется по схеме:
5.Взаимодействие с солями цианоаодородной кислоты. Первичные и вторичные галогеналканы с цианидом калия или натрия в среде апротонного полярного растворителя образуют нитрилы (SN2):
6.Взаимодействие с солями азотистой кислоты. Продукты, образующиеся в результате этой реакции, зависят от условий ее проведения, строения галогеналкана и соли.
6
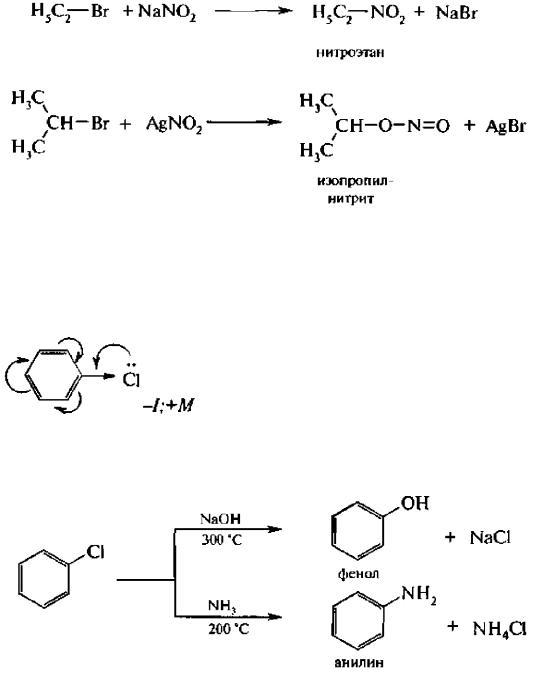
Реакции нуклеофильного замещения в ароматических галогенопроизводных
Соединения, в которых галоген непосредственно связан с бензольным ядром, характеризуются низкой реакционной способностью связи С-Hal. Это обусловлено сопряжением неподеленной пары электронов атома галогена с π-электрон ной системой бензольного ядра:
Галогенарены похожи в этом отношении на винилгалогениды. В результате сопряжения происходит укорочение и уменьшение полярности связи С-Hal. Поэтому реакции нуклеофильного замещения идут лишь в очень жестких условиях:
Подвижность атома галогена возрастает с введением в орто- или пара-положения по отношению к галогену электроноакцепторного заместителя в бензольное ядро, который увеличивает дробный положительный заряд на атоме углерода связи С-Hal. Реакция замещения галогена протекает в более мягких условиях и идет по механизму SN2:
7

Образование σ-комплекса является лимитирующей стадией реакции.
Реакции элиминирования
Реакции элиминирования сопровождаются отщеплением галоге-новодорода от галогеналкана и приводят к образованию алкенов.
Поскольку отщепление водорода происходит от β-атома углерода, то такие реакции называются β- или 1.2-элиминированием.
Реакции элиминирования (Е) и нуклеофильного замещения (SN2) конкурируют друг с другом, но в определенных условиях каждая из них может стать доминирующей. Отщепление галогеноводорода от галогеналкана становится основным процессом в присутствии нуклеофильных реагентов, обладающих высокой основностью. К ним относятся спиртовые растворы гидроксидов щелочных металлов или алкоголяты щелочных металлов. Элиминированию способствуют также повышение температуры реакционной смеси и концентрации реагентов. Так, при взаимодействии йодэтана с водным раствором щелочи основным направлением реакции является нуклеофильное замещение, а продуктом реакции – этиловый спирт. При использовании спиртового раствора щелочи доминирующим процессом становится реакция элиминирования, продуктом реакции – этилен.
Реакции элиминирования галогеналкаиов могут протекать по мономолекулярному (E1) и бимолекулярному (Е2) механизмам.
Механизм Е2 (бимолекулярное элиминирование).
В реакции отщепления по механизму Е2 наиболее легко вступают первичные галогеналканы.
8

Реакция отщепления, протекающая по бимолекулярному механизму, требует присутствия основания, идет волну стадию с образованием переходного состояния, в формировании которого принимаютучастие молекулы двух реагентов. И поэтому скорость такой реакции зависит от концентрации обоих реагентов. Процессы разрыва и образования связей в переходном состоянии происходят синхронно,
В отличие от механизма SN2 в механизме Е2 частица с неподеленной парой электронов или несущая отрицательный заряд действует не как нуклеофил, а как основание, атакуя атом водорода при β-углеродном атоме.
Механизм E1 (мономолекулярное элиминирование).
Наиболее легко происходит элиминирование поданному механизму у третичных галогеналканов. Реакция не требует основания как реагента, но для ее протекания необходим ионизирующий растворитель. Процесс является двустадийным.
Стадией, определяющей скорость реакции, является образование карбкатиона. Вторая стадия включает в себя стабилизацию карбкатиона путем отщепления протона.
Если в молекуле галогеналкана имеется несколько альтернативных путей отщепления галогеноводорода, то реализуется тот из них, при котором двойная связь образуется у наиболее замешенного атома углерода, то есть вместе с галогеном уходит водород от наименее гидрогенизированного соседнего атома углерода.
Эта закономерность получила название правила Зайцева;
9
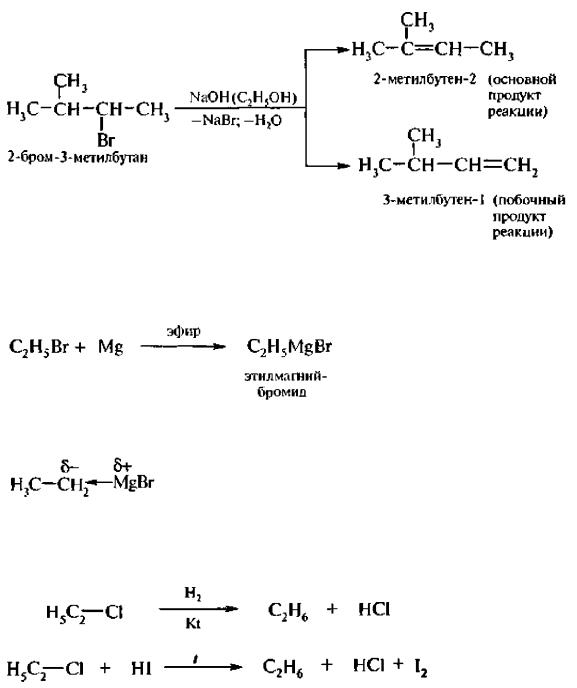
Взаимодействие с металлами
При взаимодействии галогеналканов с такими металлами, как магний, образуются магнийорганические соединения – реактивы Гриньяра:
Магнийорганические соединения являются сильными нуклеофильными реагентами и сильными основаниями. Их активность обусловлена полярностью связи углерод-магний:
Восстановление галогеналканов
При каталитическом гидрировании галогеналканов или действии на них водорода в момент выделения, а также йодоводородной кислотой происходит замещение атома галогена водородом:
10
