
Орг химия / 48-62_KOLLOIDNAYa_KhIMIYa
.pdf
величины π во времени. Исходя из уравнения (5.9) можно показать, что при одинаковой массовой концентрации частиц золя с разным размером частиц соотношение осмотических давлений подчиняется уравнению:
(5.10)
Такая сильная зависимость осмотического давления от размера частиц при наличии соответствующей аппаратуры может быть использована как для определения размеров частиц, так и для исследования их агрегирования в дисперсных системах.
Более благоприятным изучение осмотического давления представляется в растворах высокомолекулярных веществ (лиофильных коллоидов), поскольку уже при сравнительно небольших массовых концентрациях за счет относительно малых размеров молекул (на фоне коллоидных частиц) они показывают измеримые величины осмотического давления. Так,
осмотическое давление раствора яичного альбумина при концентрации белка 34 г/л оказалось равным 2270 Па, что соответствует (согласно уравнению (5.8)) 0,001 М раствору. Таким образом,
оказалось возможным рассчитать молекулярную массу белка М = 34/0,001 = 34 000, близкую к значению М, определенному другими независимыми методами. В результате разработаны методы определения молекулярной массы по осмотическому давлению для веществ с М от 10 тыс. до 200-
300 тыс., а в особых случаях до 1 млн., включая такие важные группы соединений, как белки,
каучуки, полисахариды и др.
Значение осмоса особенно велико в физиологических процессах, поскольку в любом организме каждая клетка снабжена полупроницаемой мембраной. Несмотря на то, что основной вклад в осмотическое давление вносят растворы низкомолекулярных соединений, вклад коллоидной составляющей нельзя недооценивать. Так, осмотическое давление человека составляет 780 кПа при 37°С. Оно обусловлено главным образом присутствием в крови ионов неорганических солей и в меньшей степени – наличием коллоидных частиц и белков. И если присутствующие в плазме крови коллоидные частицы (эритроциты, лейкоциты и др.) почти не влияют на осмотическое давление, то наличие белков приводит к составляющей осмотического давления, называемой
осмотическим давлением. Величина осмотического давления составляет порядка 2,5-4,0 кПа и не превышает 0,5% от общего осмотического давления плазмы крови. Однако осмотическое давление играет важную роль в обмене водой между кровью и тканями. Например, при воспалении повышается местный обмен веществ, что приводит к усилению распада макромолекул на более мелкие молекулы, т.е. увеличению количества структурных единиц в очаге и повышению в нем осмотического и осмотического давления; таким образом, в очаге увеличивается объем жидкости.
Использование гипертонических растворов (с повышенным осмотическим давлением) в повязках
итампонах приводит к оттоку жидкости, очистке раны от гноя и снятию отека.
Взаключение следует отметить, что осмотические свойства обнаруживаются не только при
61
наличии мембраны, препятствующей диффузии растворенных и диспергированных веществ.
Подобные явления отмечаются и в других системах, имеющих ограничения для перемещения коллоидных частиц или макромолекул полимеров, например в гелях, студнях, ионообменных адсорбентах, где частицы взаимно фиксированы в виде ажурной пространственной сетки.
Броуновское движение, диффузия и осмос являются молекулярно-кинетическими свойствами,
обусловленными тепловым хаотичным движением кинетических единиц. Поэтому данные свойства в равной мере присущи не только истинным молекулярным растворам, но и дисперсным системам, где в качестве кинетических единиц присутствуют частицы дисперсной фазы или молекулы ВМС (молекулярные коллоиды). Однако, как было показано, несмотря на общность закономерностей, в коллоидных растворах молекулярно-кинетические свойства выражены значительно слабее за счет низкой частичной концентрации. Тем не менее, изучение молекулярно-
кинетических свойств позволяет экспериментально определить важнейшую характеристику коллоидной системы – ее дисперсность, которую можно оценить и при исследовании процесса
седиментации.
62

59) СИДЕМЕНТАЦИЯ В ДИСПЕРСНЫХ СИСТЕМАХ СЕДИМЕПТАЦИОННЫЙ АНАЛИЗ
Седиментацией (от лат. sedimentum – осадок) называют процесс оседания частиц дисперсной фазы в жидкой или газообразной дисперсионной среде под действием силы тяжести. Всплывание частиц (например, капель в эмульсиях) носит название обратной седиментации.
Скорость оседания частиц не зависит от их природы, а определяется размером частиц,
разностью плотностей частиц ρ и среды ρ0 и вязкостью среды η. На каждую частицу в системе действует сила тяжести Fg и сила Архимеда FA. Поскольку эти силы направлены в разные стороны, равнодействующая сила, вызывающая седиментацию, Fceд равна:
 (5.11)
(5.11)
где т и т0 – масса частицы и вытесненной ей среды, ρ и ρ0 – плотности вещества частицы и среды, v– объем частицы, g – ускорение силы тяжести. Если ρ > ρ0, то происходит оседание частиц
(Fceд > 0), при ρ < ρ0 наблюдается всплывание (Fceд < 0) частиц (обратная седиментация). Для сферических частиц радиусом r
 (5.12)
(5.12)
При движении частиц возникает сопротивление со стороны среды в виде силы трения,
пропорциональной скорости движения частиц. Для сферических частиц сила трения Fmp
представлена в виде закона Стокса:
 (5.13)
(5.13)
где и – скорость движения частицы.
При установлении стационарного режима силы седиментации и трения выравниваются, и
движущая сила становится равной нулю. С этого момента скорость движения частицы становится постоянной и рассчитывается из условия Fceд = Fmp, приравняв уравнения (5.12) и (5.13), получаем уравнение для скорости оседания сферических частиц:
 (5.14)
(5.14)
Относительно радиуса частицы уравнение (5.14) принимает вид:
(5.15)
где
Для частиц произвольной формы уравнение (5.15) дает эквивалентный радиус (радиус сферической частицы, оседающей с той же скоростью). Уравнение (5.15) лежит в основе
63

седиментационного анализа, поскольку, измерив скорость оседания частиц, можно рассчитать их радиус. Седиментационный анализ является одним из видов дисперсионного анализа и имеет большое практическое значение, поскольку дисперсность – одна из основных характеристик,
определяющих показатели многих материалов, в частности в фармацевтической промышленности
(порошков, паст, мазей и др.).
Из уравнения (5.14) следует, что скорость оседания частиц зависит от их размера, разности плотностей частиц и среды, вязкости среды. Следовательно, седиментацией можно управлять,
изменяя плотность и вязкость среды. Способность к седиментации часто выражают через константу седиментации S, величина которой определяется как отношение скорости оседания к ускорению свободного падения S = u/g, или, согласно уравнению (5.14):
(5.16)
Константа седиментации зависит от размеров частиц и природы фаз. Единицей константы седиментации является сведберг (1 Св = 10-13 с) или просто секунда. Так, в аэрозолях константа седиментации во много раз выше, чем в лиозолях за счет низкой вязкости и плотности газовой среды. Например, для частиц кварца радиусом 10-5 м константа седиментации в воде равна 325
МСб = 3,25·10-5 с, в воздухе ~ 10-3 с. Величина, обратная константе седиментации, является мерой кинетической устойчивости дисперсной системы.
В монодисперсной системе все частицы движутся с одинаковой скоростью, поэтому в суспензиях спустя некоторое время возникает четкая опускающаяся граница. Если определить скорость ее движения (например, в мерном цилиндре), то по формуле (5.15) можно рассчитать радиус частиц. По мере роста дисперсности скорость оседания частиц резко уменьшается, и для частиц золя на установление равновесия могут потребоваться месяцы и годы. В табл. 5.1
представлены данные оседания монодисперсных частиц кварца в воде на высоту 10-2 м (1 см).
Таблица 5.1. Скорость седиментации сферических частиц кварца в воде
Радиус частиц, м-1 |
10-5 |
10-6 |
10-7 |
10-8 |
10-9 |
|
|
|
|
|
|
Скорость седиментации м/с |
3,6·10-4 |
3,6·10-6 |
3,6·10-8 |
3,6·10-10 |
3,6·10-12 |
|
|
|
|
|
|
Время оседания частиц на 1 см |
28 с |
46,5 мин |
77,5 ч |
323 дня |
89 лет |
|
|
|
|
|
|
Из данных таблицы видно, что частицы коллоидных размеров оседают чрезвычайно медленно.
В этом случае большую роль начинают играть молекулярно-кинетические свойства, в частности диффузия. Поскольку при оседании частиц происходит уменьшение их концентрации в верхних слоях и увеличение в нижних за счет седиментационного потока, то возникает встречный диффузионный поток снизу вверх согласно первому закону Фика (5.3). Анализом уравнений (5.3-
64

5.5) и (5.14) можно показать, что характер поведения частиц в дисперсных системах определяется их размером и разностью плотностей частиц и среды. Чем больше разность плотностей и больше размер частиц, тем значительнее роль седиментации по отношению к тепловому движению. Так,
для частиц грубодисперсных можно пренебречь диффузией. Для микрогетерогенных систем
(суспензий, эмульсий и т.д.) основная масса частиц дисперсной фазы за сравнительно короткое время оказывается в осадке, такие системы кинетически (седиментационно) неустойчивы. Для ультрамикрогетерогенных систем (золи) очень незначительна роль седиментации, такие системы
седиментационно устойчивы.
В целом в золях и суспензиях спустя некоторое время (иногда дни и недели) устанавливается
седиментационно-диффузионное равновесие, характеризуемое неоднородным распределением частиц по высоте. В суспензиях седиментационно-диффузионное равновесие реализуется для частиц размером не более 10-7 м, т.е. для частиц, которые перемещаются поступательно в процессе теплового движения. Путем подсчета числа частиц (с1 и с2) на двух различных уровнях (h1 и h2)
можно получить массу и, как следствие, радиус частиц. Для этого используют барометрическое уравнение Лапласа, выведенное для равновесного распределения частиц газа по высоте (что еще раз подтверждает близость молекулярно-кинетических свойств молекулярных и коллоидных систем):
(5.17)
где т – масса частицы.
Изучение седиментационно-диффузионного равновесия монодисперсной суспензии гуммигута позволило Перрену впервые рассчитать число Авогадро NA.
В отличие от газов (и аэрозолей), в системах с жидкой дисперсионной средой (суспензии, золи)
наблюдается очень резкое изменение концентрации по высоте. Так, в газах высота, на которой наблюдается уменьшение концентрации частиц в два раза (характеристическая высота – h1/2)
составляет порядка 5 км, в то время как для частиц микронного размера в жидкой среде не превышает несколько десятков микрон, что чрезвычайно затрудняет использование формулы
(5.17). С другой стороны, для растворов полимеров (в частности, белков) характеристическая высота может быть достаточно большой (при М ~ 40 000, ρ = 1300 кг/м3 h1/2– 20 м). В этом случае
всосудах небольшой высоты концентрация практически не изменяется по высоте. Для эффективного распределения концентрации по высоте используют исследование седиментационного равновесия полимеров в центробежном поле, т.е. увеличивают седиментацию с помощью центрифуги.
Для седиментации ультрамикрогетерогенных систем русским исследователем А. В. Думанским
в1912 г. было предложено использовать центробежное поле, позднее шведский ученый Сведберг разработал ультрацентрифугу для подобных измерений. Скорость седиментации в центробежном
65
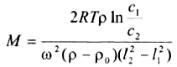
поле не остается постоянной, а растет пропорционально расстоянию от центра вращения, что характерно для ускоренного оседания частиц. Кроме того, она сильно зависит от частоты вращения центрифуги. Таким образом, определив различными способами (например, по почернению фотопластинки, помещенной за кюветой с центрифугируемой дисперсной системой)
зависимость концентрации частиц от расстояния до оси вращения / можно определить массу и размер частиц. В случае полимеров, с учетом того, что mNA = M, определяют молекулярную массу
(M) полимеров:
(5.18)
где ω – частота вращения. Этот метод является одним из основных для определения молекулярной массы полимеров. Однако следует учитывать, что при выводе седиментационных уравнений предполагалась сферическая форма частиц, что не всегда корректно и бывает причиной ошибок в определении дисперсности и молекулярной массы.
Помимо того, что в расчетах предполагается сферическая форма частиц, для соблюдения закона Стокса, а следовательно и для седиментационного анализа требуется выполнение ряда условий,
при которых соблюдаются закономерности, описываемые уравнениями (5.14-5.15). Во-первых,
должна быть обеспечена достаточно низкая концентрация частиц дисперсной фазы, т.е.
седиментация должна изучаться в разбавленных системах (не более 1–2%), где не наблюдаются столкновения и взаимное влияние частиц. Во-вторых, имеются ограничения по размерам частиц.
Большие частицы (более 10-4 м) могут двигаться ускоренно и вызывать турбулентности, а
слишком мелкие частицы (менее 10-7 м) практически не седиментируют, поэтому область дисперсности, изучаемая методом седиментации, ограничивается интервалом 10-4– 10-7 м. В
ультрацентрифугах определяемая область дисперсности расширяется до 10-8 м.
В-третьих, для седиментационного анализа следует подбирать жидкость, смачивающую данную твердую поверхность или добавлять стабилизирующие вещества, повышающее смачивание.
Данное требование связано с тем, что требуется отсутствие скольжения между оседающей частицей и средой, обусловленное полной смачиваемостью поверхности частиц. На седиментацию может влиять сольватация – это особенно существенно, когда толщина сольватных слоев соизмерима с размерами частиц (для малых частиц размером менее 10-6 м), поскольку следует учитывать толщину и вязкость жидкости в сольватном слое. И наконец, суспензия не должна коагулировать в процессе седиментации, т.е. размеры частиц должны в течение опыта оставаться постоянными.
Реальные дисперсные системы чрезвычайно редко бывают монодисперсными. Как правило,
частицы неоднородны по размерам и в задачу седиментационного анализа входит определение
распределения частиц по размерам, т.е. относительного содержания различных фракций в
66
полидисперсной системе. Фракцией называют совокупность частиц, имеющих размеры, лежащие в определенных интервалах, например фракция 1-5 мкм, 6–10 мкм и т.д. Каждую фракцию можно рассматривать как отдельную монодисперсную систему.
Определение дисперсного состава суспензий, порошков, аэрозолей и других микрогетерогенных систем основано на разнообразных седиментометрических методах дисперсионного анализа. К ним относят:
—Отмучивание – разделение суспензий на фракции путем многократного отстаивания и сливания.
—Измерение плотности столба суспензии, изменяющейся вследствие седиментации частиц.
—Пофракционное (дробное) оседание.
—Метод отбора массовых проб.
—Накопление осадка на чашечке весов.
—Электрофотоседиментометрия, основанная на изменении интенсивности пучка света,
проходящего через столб суспензии.
—Седиментометрия в поле центробежных сил.
Каждый метод ограничивается определенным интервалом дисперсности.
Известны и применяются на практике различные приборы – седиментометры. Наиболее широкое распространение получили методы накопления и взвешивания осадка. Принцип метода состоит в том, что через определенные интервалы времени взвешивают чашку, опущенную в суспензию, и по нарастанию ее массы судят о соотношении различных фракций в дисперсной системе. Роль весов могут выполнять различные приборы: от упругих стеклянных стержней (весы Фигурновского) до приборов с электронной системой регистрации и записи кинетического хода процесса. В лабораторной практике до настоящего времени широко используются торсионные весы (рис. 5.3). В данном методе анализа по мере оседания частиц их масса на чашке,
погруженной на определенную высоту (Н) суспензии, увеличивается по-разному. В случае оседания монодисперсной суспензии нарастание массы идет линейно до тех пор, пока все частицы не достигнут заданного уровня (рис. 5.4).
67

Рис. 5.3. Схема торсионных весов:
1 – арретир; 2 – стрелка весов; 3 – ряска; 4 – рычаг уравновешивания; 5 – стрелка циферблата; 6
– крючок для чашки; 7 – стеклянный цилиндр; 8 – чашка
Скорость накопления осадка является величиной постоянной и определяется как dm/dt, что соответствует тангенсу угла наклона прямой tgα на рис. 5.4. По прошествии времени t, масса осадка на чашке перестает расти. Метод позволяет определить линейную скорость оседания частиц данного размера как и = H/t, и, по уравнению (5.15), рассчитать радиус (или эквивалентный радиус) частиц:
(5.19)
Рис. 5.4. Кривая седиментации монодисперсной системы
Для полидисперсной системы характерен первоначальный резкий рост массы осадка, так как прежде всего оседают наиболее тяжелые частицы, затем все более медленные. Кривая седиментации, т.е. зависимость массы осевшего осадка от времени (рис. 5.5) в этом случае может
68

быть представлена как ломаная линия, отвечающая бесконечно большому числу фракций. По кривой седиментации можно рассчитать массы и скорости оседания отдельных фракций. Если в случае монодисперсной системы по массе осевшего осадка рассчитывают радиус частиц одного размера, то для полидисперсной системы можно определить долю каждой фракции в осадке на чашке и рассчитать кривую распределения частиц по размерам для данной суспензии (рис. 5.6).
Рис. 5.5. Кривая седиментации полидисперсной суспензии: тх – масса частиц, полностью выпавших к моменту времени tx
Рис. 5.6. Дифференциальная кривая распределения частиц по радиусам
Седиментометрический анализ кинетически устойчивых систем (золей, растворов ВМС)
проводят в ультрацентрифугах. Современная ультрацентрифуга представляет собой сложный аппарат, центральной частью которого является ротор (с частотой вращения 60 000 об/мин и выше) с точнейшей регулировкой температуры и оптической системой контроля за процессом осаждения. Кюветы для исследуемых растворов вмещают всего 0,5 мл раствора.
Помимо скоростных ультрацентрифуг, в которых седиментация преобладает над другими молекулярно-кинетическими процессами, широкое применение нашли ультрацентрифуги с меньшим числом оборотов (до 20 000 об/мин), в которых определения проводят в условиях седиментационно-диффузионного равновесия. Для определений на ультрацентрифуге применяют очень разбавленные растворы исследуемых веществ – не выше 0,02-0,1%- ной концентрации, с
69
тем, чтобы избежать ассоциации частиц при центрифугировании.
Ультрацентрифуги являются незаменимым средством изучения коллоидных систем:
определения размеров, формы, ассоциации и полидисперсности частиц, а также важнейшим средством для препаративного разделения и выделения фракций с различными свойствами, в том числе вирусов, белков, нуклеиновых кислот.
70
