
Орг химия / 48-62_KOLLOIDNAYa_KhIMIYa
.pdf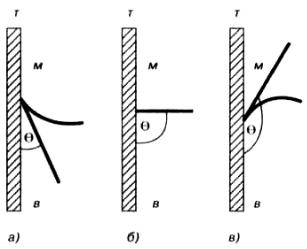
взаимодействия, хотя бы и очень малые, между жидкой и твердой поверхностью. Практически несмачиваемые водой материалы типа воска, парафина и фторопласта в обычных условиях дают краевой угол для воды порядка 120–130°. Полное смачивание имеет место, например, при взаимодействии воды с кварцем (в атмосфере воздуха θ = 0°), вода смачивает графит (θ = 55-60°),
тальк (θ = 69°), серу (θ = 78°), плохо смачивает полиэтилен (θ = 92–95°).
При изучении явления смачивания важно уметь предсказать для реальной системы значение θ,
используя знания о природе контактирующих фаз. Смачиванию способствуют:
1. Уменьшение σЖГ, т.е. чем меньше полярость жидкости, тем большее количество поверхностей она смачивает. Высокополярная ртуть смачивает только некоторые металлы; вода смачивает поверхности многих полярных веществ; органические жидкости (спирты, бензол,
гексан) смачивают большинство поверхностей.
Следствием смачивания является форма мениска в капилляре. Например, мениск в капиллярах ртутных термометров оказывается выпуклым (θ > 90°), а в спиртовых – вогнутым (θ < 90°)
2. Уменьшение σТЖ. Чем ближе по полярности твердая и жидкая фазы, тем меньше разность полярностей между ними, как следствие, работает правило «подобное смачивается подобным».
Краевые углы смачивания легко измеряются экспериментально. Для этого применяют методы проектирования капли на экран с помощью специального прибора.
Рис. 1.11. Избирательное смачивание.
а – избирательное смачивание водой; б – отсутствие избирательного смачивания; в – избирательное смачивание маслом. Т – твердая поверхность; В – водная фаза; М – органическая
(«масляная») фаза
Значительный интерес представляет смачивание на границе соприкосновения твердой фазы с двумя несмешивающимися жидкостями: полярной и неполярной. Каждая жидкость в отдельности
21

может смачивать твердую поверхность, но при совместном присутствии одна жидкость, как правило, будет лучше смачивать, чем другая. Жидкость, лучше смачивающую твердую поверхность, называют избирательно смачивающей. Очевидно, что с твердой фазой более активно взаимодействуют молекулы той жидкости, у которой разность полярностей с твердым телом наименьшая.
Рассмотримсистему (рис. 1.11), в которой твердая поверхность Т, контактирует с водой В и жидким углеводородом М (например, маслом).
Учтем, что угол смачивания θ всегда измеряют со стороны более полярной жидкости и
запишем для выбранной системы уравнение Юнга:
(1.29)
При избирательном смачивании твердой фазы водой 0 < θ < 90° и σТМ > σТВ, откуда следует, что разность полярностей между твердой фазой и водой меньше, чем между твердой фазой и углеводородом. Твердые поверхности, избирательно смачивающиеся водой, называют
гидрофильными (рис. 1.11 а).
Если твердое тело лучше смачивается неполярной жидкостью («маслом»), поверхность раздела вода–масло будет выпуклой (рис. 1.11 в) и можно написать: 90° < θ < 180°, что соответствует σТМ
< σТВ. В этом случае разность полярностей между твердой фазой и избирательно смачивающим углеводородом меньше, чем между твердым телом и водой. Твердые поверхности, избирательно смачивающиеся неполярными жидкостями, называются гидрофобными или олеофильными.
Общим правилом является то, что из двух жидкостей лучше смачивает твердую поверхность та,
у которой разность полярностей с твердым телом наименьшая, а энергия взаимодействия наибольшая.
Иммерсионное смачивание. При изучении характера взаимодействия поверхности порошкообразных (что особенно важно для решения фармацевтических задач) или пористых материалов с жидкостью измерение угла смачивания θ не представляется возможным, поэтому используют другие характеристики процесса смачивания. Например, можно количественно определить калориметрическим методом теплоту смачивания. Теплота смачивания – это количество теплоты, выделяющееся при погружении твердого вещества в жидкость. Ее обычно относят к единице поверхности или массы смачиваемого вещества и выражают в Дж/м2 или Дж/кг.
Смачивание твердой поверхности жидкостью приводит к образованию новой фазовой границы жидкость – твердое вместо исходной границы твердое–газ и сопровождается уменьшением поверхностной энергии Гиббса.
Теплоту смачивания экспериментально обычно определяют в расчете на единицу массы порошка и называют удельной теплотой смачивания qсм. Величина qсм, как величина любого
22

теплового эффекта процесса, протекающего при постоянной температуре и постоянном давлении,
равна изменению энтальпии, в данном случае изменению поверхностной энтальпии при переносе
1 кг вещества из воздуха в жидкость:
 (1.30)
(1.30)
где hsТГ и hsTЖ – поверхностные энтальпии, рассчитанные на единицу поверхности твердое–газ и твердое–жидкость соответственно; Syд – удельная поверхность твердого вещества, м2/кг.
Подставив в (1.30) уравнение (1.20), получим:
(1.31)
Величина qсм, как правило, положительна, а значит, смачивание является процессом экзотермическим и σТГ > σТЖ. Конкретное соотношение между σТГ и σТЖ приводит к тому, что для гидрофильных поверхностей теплота смачивания водой больше, чем органическими жидкостями,
адля гидрофобных поверхностей наблюдается обратная зависимость.
Вуравнение (1.31) входят величины, трудно поддающиеся экспериментальному определению, а
измерение qсм 1 кг порошка не всегда удобно, поэтому для оценки свойств поверхности порошка экспериментально измеряют теплоту смачивания при погружении одинаковой массы твердого тела в воду (qсмВ) и жидкий углеводород – масло (qсмВ). Отношение полученных теплот называется
коэффициентом гидрофильности Ь\
 (1.32)
(1.32)
Для гидрофильных поверхностей b > 1, для гидрофобных – 0 < b < 1. В табл. 1.2 приведены примеры гидрофильных и гидрофобных веществ. Активированный уголь обладает гидрофобными свойствами, остальные три вещества гидрофильны.
Таблица 1.2. Теплота смачивания и коэффициент гидрофильности порошкообразных веществ
Вещество |
Теплота смачивания, Дж/кг |
b |
|
|
|
|
|
|
Водой, |
Углеводородом, |
|
|
qсмВ 10-3 |
qсмВ 10-3 |
|
|
|
|
|
Прокаленный SiO, |
38.1 |
18.4 (гексан) |
2.1 |
|
|
|
|
Активированный уголь |
31.8 |
93.3 (гексан) |
0.34 |
|
|
|
|
Крахмал |
96.2 |
5.4 (бензол) |
17.8 |
|
|
|
|
Агар-агар |
146.0 |
4.2 (бензол) |
34.8 |
|
|
|
|
Инверсия смачивания. Процесс смачивания может быть целенаправленно изменен, путем изменения поверхностного натяжения (см. (1.28)), которым, как было показано выше, наиболее
23
эффективно можно управлять с помощью ПАВ, вводя их либо в жидкую фазу, либо обрабатывая их растворами или парами твердую поверхность. При этом может происходить не только изменение величины утла смачивания, но и инверсия, т.е. качественное изменение характера смачивания.
При адсорбции ПАВ на твердой поверхности удается гидрофилизировать гидрофобные поверхности и вызывать их смачивание водой и другими полярными жидкостями, либо придавать гидрофобные свойства первоначально гидрофильной поверхности, делать ее плохо смачиваемой водой. Инверсия смачивания имеет большое значение для хранения порошков. Если гидрофильный, и поэтому отсыревающий на воздухе порошок обработать небольшим количеством ПАВ, влагоемкость его существенно снижается, что увеличивает сроки хранения. С
другой стороны, мерная стеклянная посуда, стоящая длительное время в открытом виде в лаборатории, где используют ПАВ, гидрофобизируя свою поверхность, плохо смачивается водой,
что нарушает точность измерений. В основе одного из механизмов моющего действия ПАВ лежит улучшение смачивания загрязненных (гидрофобизированных жирами) поверхностей и тканей водой за счет адсорбции ПАВ и понижения σ раствора.
Адсорбция ПАВ на твердой поверхности влияет не только на величину, но и на знак cos0.
Зависимость cosθ от концентрации ПАВ при постоянной температуре называется изотермой смачивания. Кривая пересекает ось абсцисс в точке, соответствующей такой концентрации ПАВ,
при которой cosθ = 0 и происходит изменение знака cosθ. Точку А пересечения изотермы смачивания с осью концентрации ПАВ называют точкой инверсии смачивания (рис. 1.12).
Механизм инверсии смачивания связан с определенной ориентацией молекул ПАВ в адсорбционном слое. Если твердая поверхность сначала гидрофильна, то адсорбированные молекулы взаимодействуют своими полярными группами с поверхностью, а неполярными цепями обращаются наружу, вследствие чего твердая поверхность становится гидрофобной. Например,
при погружении стеклянной пластинки в раствор стеариновой кислоты в октане или бензоле на поверхности пластинки образуется монослой стеариновой кислоты. Адсорбированные молекулы кислоты на пластинке неполярными цепями обращены наружу, придавая поверхности гидрофобные свойства.
24

Рис. 1.12. Изотерма смачивания поверхности стекла растворами ПАВ
(додецилметиламмонийбромида) разных концентраций
В противоположном случае, когда поверхность гидрофобна, адсорбированные на ней молекулы ПАВ ориентированы к твердой фазе своими неполярными радикалами, а полярными группами – наружу. Поверхность становится гидрофильной.
Растекание жидкости рассмотрим на примере ее растекания по поверхности другой жидкости
(рис. 1.13). Пусть на поверхность воды (полярной жидкости) нанесена капля нерастворимой в ней жидкости (масла). Обозначим поверхностное натяжение на границе воды и газа через σВГ, на границе воды и масла – через σВМ и на границе масла и газа – через σМГ. В зависимости от соотношения между этими величинами замена поверхности границы вода–газ двумя поверхностями: вода-масло и масло-газ может быть энергетически выгодна или нет. Если
 (1.33)
(1.33)
замена оказывается энергетически выгодной, способствует уменьшению поверхностной свободной энергии Гиббса (dGS < 0), и при постоянной температуре и постоянном давлении, в
соответствии со вторым началом термодинамики, процесс будет протекать самопроизвольно – капля будет растекаться по поверхности (рис. 1.13а).
Рис. 1.13. Капля масла на поверхности воды при растекании (а) и без растекания (б)
В противном случае, т.е. при
 (1.34)
(1.34)
25

капля под влиянием поверхностного натяжения и силы тяжести примет округлую форму,
поскольку такой форме отвечает уменьшение поверхностной энергии за счет минимизации энергоемких поверхностей раздела вода–масло и масло–газ (рис. 1.13б).
Мерой растекания служит коэффициент растекания/(по Гаркинсу):
 (1.35)
(1.35)
Учитывая, что поверхностное натяжение представляет собой поверхностную энергию Гиббса,
пересчитанную на единицу поверхности gs (см. (1.4)) из (1.35), следует, что коэффициент растекания численно равен и з м е н е н и ю в процессе растекания, взятому с обратным знаком.
Поэтому условия растекания с помощью/можно представить следующим образом:
П р и f > 0 (dGS < 0) происходит растекание, при f < 0 (dGS > 0) растекание отсутствует.
Хорошо растекаются на поверхности воды высшие спирты, органические кислоты и их соли,
амины, сульфокислоты. Не растекаются на воде вазелиновое и машинное масло. В табл. 1.3
приведены коэффициенты растекания некоторых веществ на воде.
Поверхностные пленки. Конечный результат растекания нерастворимых в воде жидкостей – образование очень тонких слоев на поверхности воды. Такой процесс можно назвать двумерным растворением. При растекании пленки на достаточно большой поверхности образуется
мономолекулярный слои, поскольку с ростом площади пленки непрерывно уменьшается свободная поверхностная энергия.
Таблица 1.3. Коэффициенты растекания некоторых органических веществ на воде при 20°С
Вещество |
f 103 (Дж/м2) |
|
|
н-пропиловый спирт |
49.0 |
|
|
н-октиловый спирт |
36.7 |
|
|
Олеиновая кислота |
24.6 |
|
|
Анилин |
24.4 |
|
|
н-гексан |
3.1 |
|
|
н-октан |
0.2 |
|
|
Бромбензол |
-3.3 |
|
|
Вазелиновое масло |
-13.5 |
|
|
Керосин |
-13.6 |
|
|
Йодистый метил |
-26.5 |
|
|
26
Слой, толщина которого не превышает размеры отдельных молекул, называют
мономолекулярным слоем или монослоем.
Образующийся слой достаточно плотный, поскольку молекулы данной жидкости (в
дальнейшем будем рассматривать в основном нерастворимые в воде ПАВ) связаны между собой межмолекулярными силами, препятствующими «разбеганию» молекул. Для примера можно нанести на поверхность воды мельчайшие частицы талька, а затем внести каплю масла. Тогда при растекании пленки масла частицы талька будут смещаться на периферию, а капля, растекаясь,
займет определенный объем. Зная число молей (молекул) в капле масла ns и площадь пятна, можно рассчитать толщину мономолекулярной пленки. Интересно, что еще в восемнадцатом веке Б.
Франклин таким образом определил толщину пленки масла (~2,5 нм) и сделал вывод, что она соответствует размеру частиц, составляющих вещество. Он же показал, что при такой толщине пленки легко узнать количество масла, необходимого для гашения волн. (Этот метод,
использовавшийся еще в древние времена для гашения морских волн, был описан Плутархом и Плинием старшим). Так, чайная ложка масла образует пленку площадью 2000 м2. Кроме того,
скорость растекания пленок достаточно велика – для олеиновой кислоты она составляет 0,2 м/с.
Изучение поверхностных пленок, кроме всего прочего, дает большой материал для анализа состояния и структуры молекул в монослоях (поверхностных пленках).
Рассмотрим метод изучения монослоев с помощью пленочных весов Ленгмюра (рис. 1.14). Они состоят из кюветы 1, в которую помещают жидкость, служащую подложкой для монослоя (вода),
перемещаемого барьера 3 и динамометрического устройства 5. Если между поплавком 2 и
перемещаемым барьером 3, покрытым парафином, поместить каплю масла, то распространяющиеся по поверхности воды молекулы масла ударяют о преграды, создавая поверхностное давление π = σ0 – σ Поверхностное давление измеряется динамометром, который представляет собой весы со стрелкой-указателем. Смещение барьера 3 в сторону поплавка приводит к уменьшению площади поверхностной пленки и увеличению π. Измеряя π методом Ленгмюра и зная площадь, занимаемую монослоем масла (S), можно построить кривые сжатия,
характеризующие состояние пленки.
27

Рис. 1.14. Схема поверхностных весов Ленгмюра: 1 – кювета; 2 – поплавок; 3 – барьер; 4 –
линейка для измерения площади монослоя; 5 – динамометрическое устройство
Рассмотрим состояние мономолекулярной пленки ПАВ на поверхности воды. Состояние молекул в пленке зависит от свойств ПАВ, а также от температуры и степени сжатия.
Классический вариант зависимости поверхностного давления от площади монослоя приведен на рис. 1.15, 1.16.
Молекулы жирных кислот, находясь на поверхности воды в малой концентрации, ведут себя как газ, расположенный не в объеме, а на плоскости (двумерный газ). Они свободно перемещаются по поверхности, не взаимодействуя друг с другом. Этому состоянию отвечает область а на рис. 1.16. Кривая сжатия имеет вид гиперболы, подобно зависимости между давлением и объемом п молей идеального газа согласно уравнению Менделеева–Клапейрона pV = nRT.
 (1.36)
(1.36)
Отличие заключается в том, что объем газа (V) заменен поверхностью (5), а вместо давления газа (р) введено двумерное давление π. Участок а носит название газообразной пленки (рис. 1.17а).
Уравнение (1.36) применимо только в области очень низких π, т.е. для состояния идеального газа.
Сжатие пленки перемещаемым барьером приводит к уменьшению площади и росту поверхностного давления. При достижении некоторого критического давления π начинается фазовый переход газообразной пленки, представляющей собой двумерный пар, в двумерную жидкость (область b). Переход аналогичен процессу конденсации насыщенного пара при постоянном давлении. Далее происходит сжатие двумерной жидкости (область с). В этом состоянии пленка называется жидкорастянутой фис.1.17б).
28

Рис. 1.16. Общий вид кривой сжатия поверхностной пленки
Рис. 1.15. Вид кривой сжатия для мономолекулярной пленки жирной кислоты: 1 – лауриновая
(додекановая) кислота; 2 – миристиновая (тетрадекановая ) кислота
На участке d отмечается еще один фазовый переход. Вертикальный участок е характеризуется почти полной несжимаемостью. В этой области состояния молекулы ПАВ настолько плотно сдвинуты, что практически полностью соприкасаются друг с другом (рис. 1.1в). Пленка на участке
е называется конденсированной (или «частокол» Ленгмюра). Наконец, участок f соответствует разрушению монослоя, коллапсу пленки (рис. 1.17г). В случае жидкой пленки могут появляться отдельные капли жидкости, для твердых пленок, когда длина цепи ПАВ превышает 20–24 атома углерода, часто возникают многослойные образования.
В ряде случаев анализ кривой сжатия позволяет вычислить размеры молекул ПАВ и сделать вывод об их ориентации. Так, согласно рис. 1.15–1.17, на участке е, где молекулы сдвинуты практически вплотную и конденсированная пленка занимает площадь Sx, площадь, приходящаяся
29

на одну молекулу ПАВ S0 (м2), равна:
 (1.37)
(1.37)
где п – количество моль ПАВ, нанесенных на поверхность воды; NA – постоянная Авогадро,
равная 6,02·1023 моль-1.
Рис. 1.17. Зависимость строения мономолекулярной пленки ПАВ от площади поверхности,
занимаемой монослоем
Опыты Ленгмюра дали для всех жирных кислот S0 = 0,205 нм2, что хорошо согласовывалось с данными, полученными другими методами. Результаты определения площади поперечного сечения некоторых других молекул представлены в табл. 1.4.
Поперечное сечение молекул гомологического ряда ПАВ, находящихся в конденсированном монослое, не зависит от длины цепи, а значит, они ориентированы в слое вертикально. Полярные группы молекул ПАВ погружены в воду, углеводородные цепи обращены в неполярную среду
(воздух). Вычисление длины молекул ПАВ показало, что эта величина меняется пропорционально числу атомов углерода.
Таблица 1.4. Площадь поперечного сечения ряда молекул
Вещество |
S0, нм2 |
|
|
Триглицериды (площадь на одну цепь) |
0.206 |
|
|
Спирты |
0.216 |
|
|
Амиды жирных кислот |
0.205 |
|
|
Холестерин |
0.408 |
|
|
Лецитин |
0.520 |
|
|
Сложные эфиры жирных кислот |
0.220 |
|
|
30 |
|
