
Орг химия / 39-47_Karbonilnye_soed__Karbonovye_k-ty_i_ikh_proizvodnye
.pdf
Ангидриды карбоновых кислот являются активными ацилирующими средствами.
Замещение водорода при α-углеродном атоме (реакция Геля – Фольгарда – Зелинского). Под влиянием карбоксильной группы, которая проявляет отрицательный индуктивный эффект (–I), увеличивается подвижность атомов водорода при α-углеродном атоме.
При взаимодействии карбоновых кислот с галогенами в присутствии тригалогенилов фосфора атом водорода при α-углеродном атоме вмешается на галоген.
В результате реакции образуются галоген карбоновые кислоты. Реакция протекает через стадию образования галогенангидридов, которые галогенируются легче, чем кислоты:
Окисление Монокарбоновые кислоты устойчивы к действию окислителей, кроме муравьиной кислоты, которая легко окисляется КМnO4 и другими окислителями с образованием угольной кислоты:
В связи с особенностью строения муравьиная кислота обладает восстанавливающей способностью, она подобно альдегидам дает реакцию «серебряного зеркала»:
21
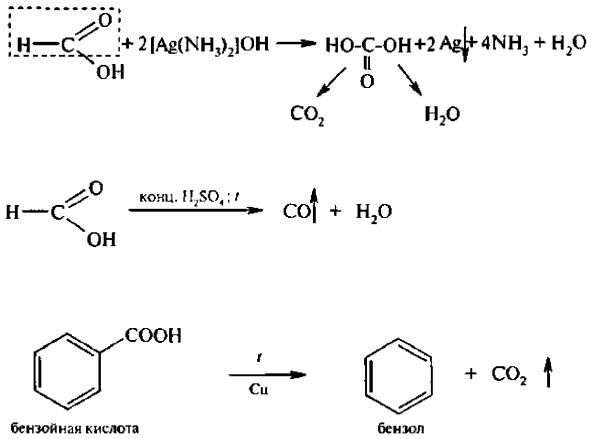
Отличительной реакцией муравьиной кислоты является также реакция ее разложения при нагревании с конц. H2SO4,
В результате выделяется оксид углерода (II) и вода.
При нагревании выше 200°С ароматические карбоновые кислоты в присутствии катализатора декарбоксилируются:
22

ДИКАРБОНОВЫЕ КИСЛОТЫ
Дикарбоновыми кислотами называют производные углеводородов, содержащие в своем составе две карбоксильные группы,
НАСЫЩЕННЫЕ ДИКАРБОНОВЫЕ КИСЛОТЫ
По заместительной номенклагуре название дикарбоновых кислот строят исходя из соответствующих углеводородов с добавлением множительной приставки ди- и суффикса -овая кислота. Наряду с заместительной номенклатурой широко применяются тривиальные названия.
Для них характерна структурная изомерия.
Простейшими представителями этого класса являются малеиновая и фумаровая кислоты, которые являются геометрическими изомерами 2-бутендиовой кислоты:
Ароматическими дикарбоновыми кислотами называют производные ароматических углеводородов, содержащие две карбоксильные группы, непосредственно связанные с ароматическим ядром.
Важными представителями этого класса являются фталевая, изо-фталевая и терефталевая кислоты:
Они имеют общее название – фталевые кислоты.
Физические свойства
Дикарбоновые кислоты представляют собой кристаллические вещества. Низшие гомологи хорошо растворимы в воде. С увеличением молекулярной массы кислоты ее растворимость уменьшается.
Способы получения
Дикарбоновые кислоты получают теми же методами, что и монокарбоновые кислоты, используя в качестве исходных веществ соответствующие бифункциональные соединения.
Окисление двуиервичных гликолей, диальдегидов и гидроксикислот:
23

Одной из важных реакций получения ликарбоновых кислот является реакция омыления
динитрилов.
Основным способом получения ароматических дикарбоновых кислот является каталитическое окисление ксилолов кислородом воздуха. Так, при окислении п-ксилола получают терефталевую кислоту:
Фталевую кислоту получают из о-ксилола или нафталина:
Химические свойства
Имея в своем составе две карбоксильные группы, дикарбоновые кислоты диссоциируют ступенчато, образуя анион (рКа1) и дианион (рКа2).
24

Высокая кислотность по первой ступени объясняется взаимным влиянием второй карбоксильной группы, которая способствует делокализации образующегося отрицательного заряда карбоксилат-иона и тем самым повышает его устойчивость. По мере удаления карбоксильных групп ослабевает их взаимное влияние и кислотность по первой ступени падает. Отрыв протона от второй карбоксильной группы происходит труднее вследствие низкой стабильности дианиона, поэтому кислотность дикарбоновых кислот по второй ступени значительно ниже, чем по первой.
При максимальном удалении карбоксильных групп последние не оказывают взаимного влияния и через 5–6 связей, каждая из них ведет себя независимо.
По химическим свойствам дикарбоновые кислоты, так же как и монокарбоновые, способны образовывать одни и те же функциональные производные. Только в зависимости оттого, одна или две карбоксильные группы участвуют в реакции, получают кислые или средние соли, полные и неполные эфиры, галогенангидриды, амиды и др. Например:
Вместе с тем следует отметить, что дикарбоновые кислоты проявляют и ряд специфических свойств. В частности, они по-разному относятся к нагреванию.
1. Отношение дикарбоновых кислот к нагреванию. Щавелевая и малоновая кислоты при нагревании свыше температуры плавления отщепляют оксид углерода (IV) и превращаются в монокарбоновые кислоты:
При нагревании янтарной и глутаровой кислот, взаимное влияние карбоксильных групп которых слабее, декарбоксилирования не происходит, а осуществляется процесс внутримолекулярной дегидратации с образованием циклических ангидридов:
25
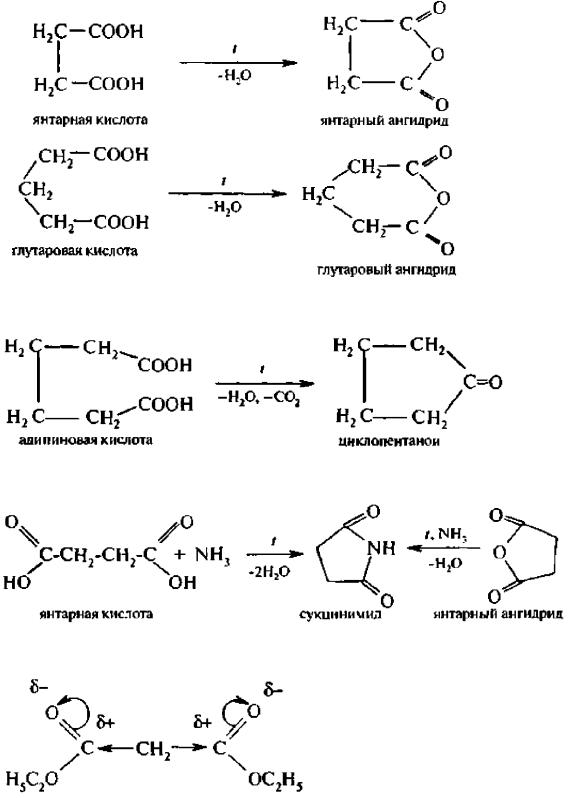
Адипиновая кислота в этих условиях подвергается декарбоксили-рованию и дегидратации с образованием циклического кетона – пиклопентанона:
2. Образование циклических амидов. При нагревании янтарной и глутаровой кислот или их ангидридов с аммиаком образуются циклические имиды:
Важное значение в органическом синтезе имеет диэтиловыи эфир малоновой кислоты или малоновый эфир:
В результате электроноакцепторного влияния двух сложноэфирных групп за счет –I-эффекта возрастает подвижность атомов водорода метиленовой группы, что обуславливает наличие СНкислотного центра. При действии на малоновый эфир алкоголята натрия образуется натриймалоновый эфир, который взаимодействует с электрофильными реагентами. Так. при алкилировании малонового эфира образуется алкилмалоновый эфир, который, гидролизуясь, дает алкилмалоновую кислоту. Поcледняя легко декарбоксилируется и образует монокарбоновую кислоту:
26
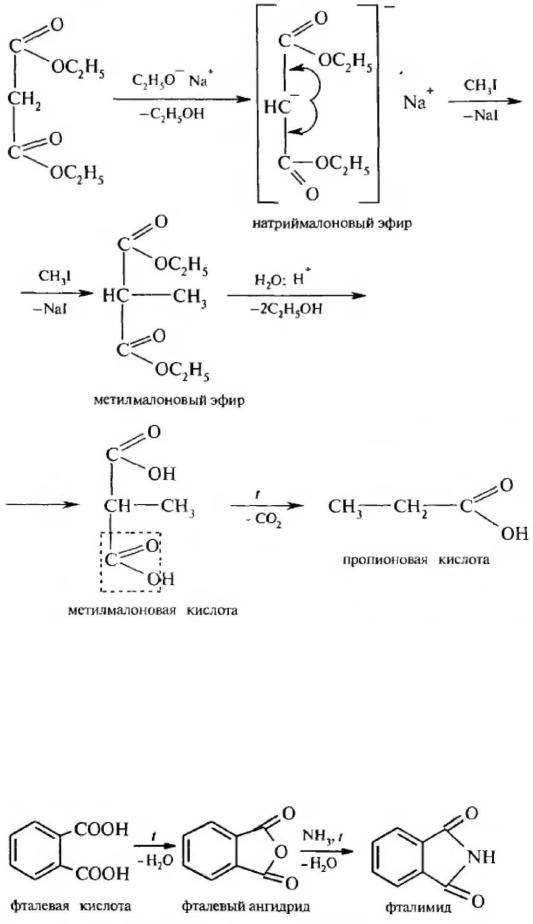
Алкилированию может подвергаться и второй атом водорода метиленовой группы, что дает возможность осуществлять синтез разнообразных монокарбоновых кислот.
При ацилировании натрий малонового эфира α-галогенкарбоновыми кислотами образуются различные дикарбоновые кислоты.
По степени кислотности они превышают бензойную кислоту. Арендикарбоновые кислоты образуют кислые и средние соли, полные и неполные сложные эфиры и амиды и т. д. Фталевая кислота в отличие от своих изомеров при нагревании легко теряет молекулу воды с образованием ангидрида, который при взаимодействии с аммиаком образует фталимид:
Фталимид широко используется в органическом синтезе.
27
ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ
К важнейшим функциональным производным карбоновых кислот относятся: галогенангидриды, ангидриды, сложные эфиры, амиды, гидразиды, гидроксамовые кислоты, нитрилы и др.
43) НОМЕНКЛАТУРА, ИЗОМЕРИЯ И СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ ГАЛОГЕНАНГИДРИДОВ КАРБОНОВЫХ КИСЛОТ (АЦИЛГАЛОГЕНИДЫ)
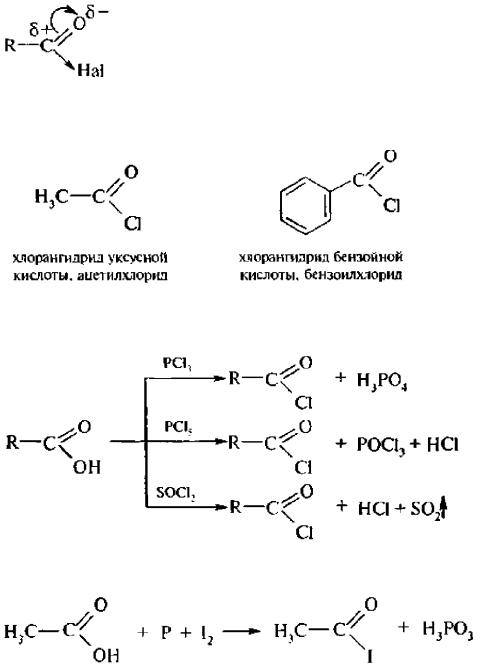
Ацилгалогетиды – это такие производные карбоновых кислот, t которых гидроксильная группа, входящая в состав карбоксильной замещена на атом галогена:
Номенклатура
Названия ацилгалогеншюв образуют из названий соответствующих кислот или ацильных групп и названий галогенов:
Способы получения
Хлор- и бромангидриды могут быть получены при действии галогенирующего реагента на карбоновые кислоты:
Йодпроизволные карбоновых кислот получают следующим образом:
Физические свойства
Низшие галогенангидриды карбоновых кислот – жидкости с резким запахом, раздражающие слизистые оболочки.
Химические свойства
Галогенангидриды – сильные электрофильные реагенты, сильнее карбоновых кислот. Галоген в этих соединениях обладает исключительно большой подвижностью:
28

Электрофильные свойства подобных соединений зависят от величины дробного положительного заряда (δ–) на углероде карбонильной группы. Со стороны галогена проявляется выраженный –I, который в статическом состоянии больше +M, поэтому на атоме углерода возникает выраженный δ+, что и обуславливает сильные электрофильные свойства галогенангидридов. Они легко вступают в реакции нуклеофильного замещения:
В подобных реакциях в молекулу нуклеофила вводится ацильная группа, поэтому такие реакции называют реакциями ацилировання, а галогенангидриды карбоновых кислот – ацилирующими агентами.
Галогенангидриды в силу своей высокой активности нашли чрезвычайно большое применение в органическом синтезе.
29
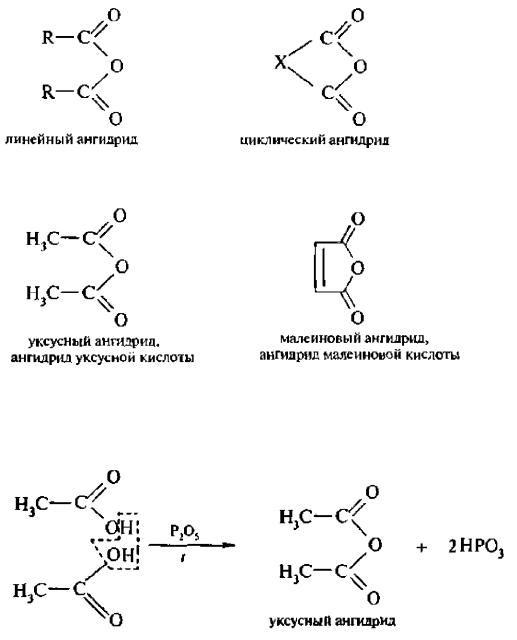
44) НОМЕНКЛАТУРА, ИЗОМЕРИЯ, СПОСОБЫ ПОЛУЧЕНИЯ И ХИМИЧЕСКИЕ СВОЙСТВА АНГИДРИДОВ КАРБОНОВЫХ КИСЛОТ
Ангидридами называют производные карбоновых кислот, в молекулах которых атом водорода карбоксильной группы замешен на ацильную группу:
Номенклатура
Названия ангидридов образуют из тривиальных названий соответствующих кислот:
Способы получения
1. Дегидратация карбоновых кислот. При пропускании паров кислоты над соответствующим катализатором (пентаоксид фосфора, трифторуксусный ангидрид) происходит выделение воды – реакция дегидратации:
2. В промышленном масштабе ангидриды получают взаимодействием галогенангидридов с
безводными солями карбоновых кислот:
30
