
Орг химия / 39-47_Karbonilnye_soed__Karbonovye_k-ty_i_ikh_proizvodnye
.pdf
39) НОМЕНКЛАТУРА, ИЗОМЕРИЯ И СПОСОБЫ ПОЛУЧЕНИЯ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ (АЛЬДЕГИДЫ И КЕТОНЫ)
Альдегидами и кетонами называют производные углеводородов, содержащие в своем составе
карбонильную группу Поэтому их еще называют карбонильными соединениями.
В альдегидах карбонильная группа связана с углеводородным радикалом и атомом водорода.
Общая формула альдегидов группировка толучила название альдегидная группа.
В кетонах карбонильная группа связана с двумя углеводородными радикалами.
Обшая формула кетонов |
Карбонильную группу в кетонах часто называют |
кетогруппой. |
|
В зависимости от строения углеводородного радикала альдегиды и кетоны подразделяют на алифатические, алициклические и ароматические. Среди алифатических альдегидов и кетонов различают насыщенные и ненасыщенные (предельные и непредельные).
Номенклатура альдегидов и кетонов весьма многообразна. Используют как тривиальные названия, так и номенклатуру ИЮПАК. Поэтому многие карбонильные соединения имеют несколько названий.
Тривиальные названия альдегидов происходят от названия кислот, в которые они превращаются при окислении. По заместительной номенклатуре ИЮПАК названия альдегидов образуют от названия углеводородов с тем же числом атомов углерода (включая углерод альдегидной группы), прибавляя суффикс -аль. Нумерацию главной углеродной цепи начинают с атома углерода альдегидной группы.
Нередко в названиях альдегидов положения заместителей указывают греческими буквами α, β, γ и т. д. При этом буквой α обозначают атом углерода, соединенный с альдегидной группой:
1

Кетонную группу по заместительной номенклатуре обозначают суффиксом -он и цифрой обозначают атом углерода, входящий в кетогруппу Нумерацию проводят таким образом, чтобы атом углерода карбонильной группы получил меньший номер:
По радикало-функциональной номенклатуре названия кетонов состоят из названия углеводородных остатков в порядке алфавита и суффикса -кетон.
Различают две группы этих соединений: альдегиды, содержащие альдегидную группу в бензольном ядре и альдегиды, у которых альдегидная группа содержится в боковой иепи.
Простейшие представители:
Способы получения
1.Реакция окисления спиртов. Первичные спирты окисляются до альдегидов, а вторичные – до кетонов.
2.Реакция гидратации алкинов (реакция Кучерова). В условиях реакции Кучерова из ацетилена образуется уксусный альдегид, все гомологи ацетилена дают кетоны.
2
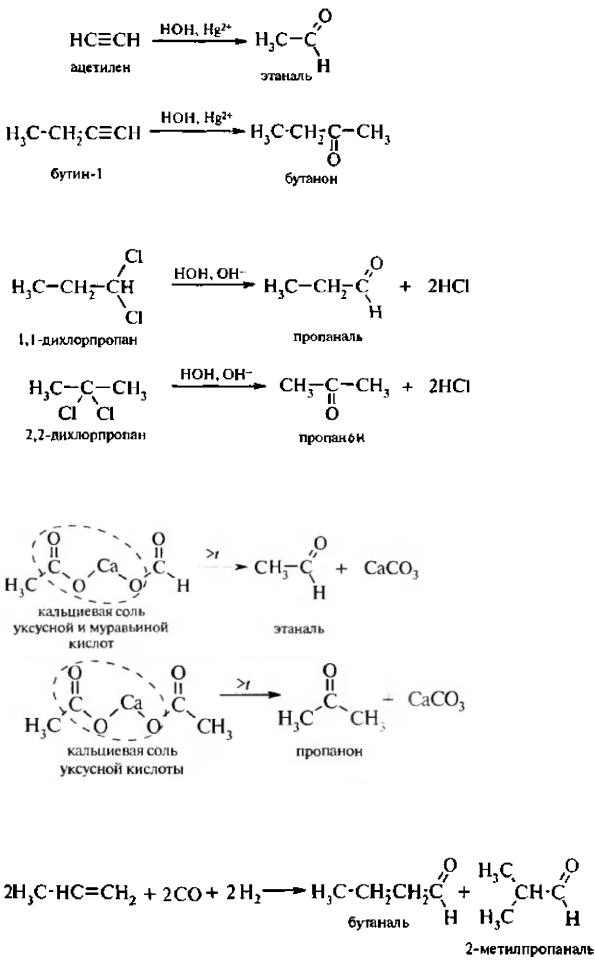
3. Реакция гидролиза дигалогеналканов. При гидролизе номинальных дигалогеналканов с атомами галогена у первичного атома углерода образуются альдегиды, а у вторичного – кетоны;
4. Реакция термического разложения солей карбоновых кислот. Из смешанной соли муравьиной и другой карбоновой кислоты при термическом разложении (пиролизе) получают альдегиды, а в остальных случаях образуются кетоны:
5.Реакция прямого карбонилирования (оксосинтез). В промышленности альдегиды получают взаимодействием алкенов с оксидом углерода (II) и водородом при повышенной температуре и давлении в присутствии катализатора.
6.Окисление ароматических углеводородов.
3

При окислении толуола и других соединений, содержащих метильную группу, связанную с бензольным ядром, довольно легко образуются ароматические альдегиды. При использовании в качестве окислителя оксида хрома (VI) реакцию проводят в среде уксусного ангидрида:
Образовавщееся диацетатное производное толуола не способно к окислению, а при его гидролизе легко образуется бензальдегид.
7. Способ Гаттермана – Коха (реакция карбонилирования).
Прямое введение в молекулу альдегидной группы позволяет получать замешенные ароматические альдегиды:
8. Реакция Фридедя – Крафтса (реакция ацилирования).
На ароматический углеводород действуют хлорангидридом кислоты в присутствии хлорида алюминия (III), это обычная реакция аии-лирования в ароматическом ряду.
Физические свойства
Насыщенные альдегиды и кетоны являются бесцветными жидкостями со своеобразным запахом (формальдегид – газ с острым запахом). Карбонильные соединения имеют более низкие температуры кипения, чем соответствующие спирты, т к. не способны образовывать водородные связи.
Кетоны являются хорошими растворителями. Высшие альдегиды обладают цветочным запахом и широко применяются в парфюмерии.
Альдегиды раздражают слизистые оболочки глаз и верхних дыхательных путей, пагубно влияют на нервную систему. С увеличением числа атомов углерода в молекуле раздражающее действие ослабевает. Ненасыщенные альдегиды обладают более сильным раздражающим действием, чем насыщенные.
4

40) ХИМИЧЕСКИЕ СВОЙСТВО КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ
Химические свойства альдегидов и кетонов определяются наличием в их молекуле карбонильной группы, которая является сильно полярной группой и имеет значительную поляризуемость.
Карбонильная группа образована из двух атомов с сильно различающимися электроотрицательностями. Атом углерода карбонильной группы находится в состоянии sp2- гибридизации и связан с тремя окружающими его атомами о-связями, расположенными в одной плоскости под углом 120°. Негибридизованная p-орбиталь атома углерода перекрывается с p- орбитальюатома кислорода, образуя π-связь.
Атом кислорода, как более электроотрицательный элемент, притягивает к себе о- и п- электроны. В результате этого двойная связь карбонильной группы сильно поляризована, на атоме кислорода возникает частичный отрицательный заряд, а на атоме углерода – частичный положительный:
Благодаря такой поляризации альдегиды и кетоны способны вступать в реакцию с нуклеофильными реагентами, которые атакуют атом углерода карбонильной группы. Альдегиды, как правило, более реакционноспособны, чем кетоны. Поскольку алкильные радикалы за счет +I- эффекта уменьшают положительный заряд на атоме углерода карбонильной группы, наличие в молекуле кетона двух алкильных групп приводит к большему понижению положительного заряда, чем в молекуле альдегида.
Все реакции альдегидов и кетонов условно можно разделить на следуюшие группы:
•реакции нуклеофильного присоединения (AN);
•реакции присоединения-отщепления;
•реакция конденсации;
•реакция с участием α-углеродного атома;
•реакции полимеризации;
•реакции окисления и восстановления.
Реакции нуклеофильного присоединения
1. Присоединение синильной кислоты. Синильная (циановолоролная) кислота присоединяется к
карбонильным соединениям, образуя циан-гидрины или а-гидроксинитрилы:
5
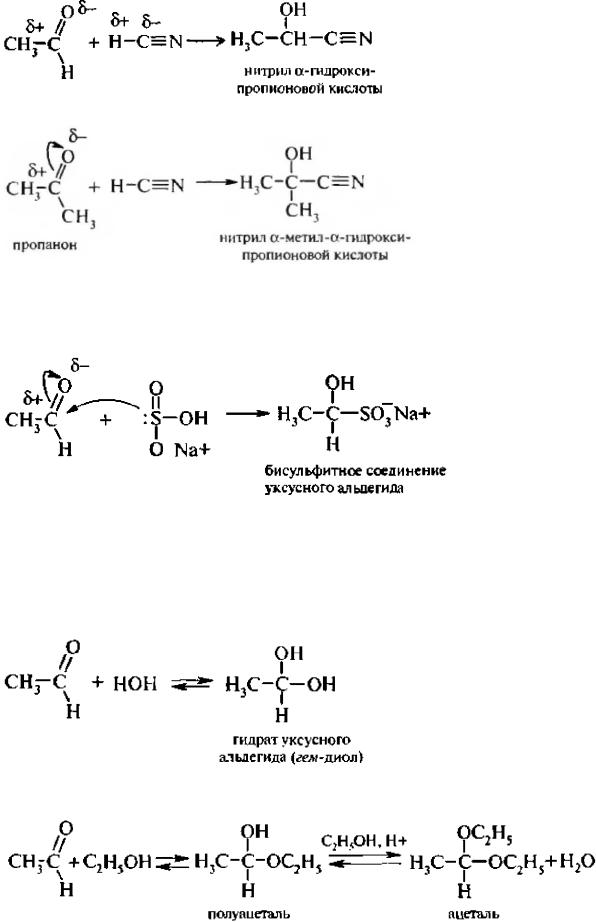
Кетоны также образуют α-гидроксинитрилы:
Образующиеся нитрилы можно легко гидролизовать до соответственных α-гидроксикислот, что используется в синтезе этих кислот.
2. Присоединение гидросульфита натрия. Альдегиды и кетоны (содержащие группировку Н3С– СО–R) реагируют с гидросульфитом (бисульфитом) натрия, образуя бисульфитные соединения.
Бисульфитные соединения – твердые вещества, трудно растворимые в воде, легко образуются, поэтому применяются для качественного обнаружения альдегидов, а также для выделения альдегидов из реакционной среды.
3. Присоединение воды. Растворение альдегидов в воде сопровождается образованием гидратов. Реакция представляет собой обратимый процесс. Продукты реакции гидратации обычно неустойчивы и выделить их практически невозможно из-за разложения на исходные компоненты:
4. Присоединение спиртов. В спиртовом растворе альдегиды образуют полуацетали, а в присутствии следов минеральных кислот – ацетали:
Кетоны из-за низкой реакционной способности и пространственных препятствий со спиртами не взаимодействуют.
Реакции присоединения-отщепления
6

Альдегиды и кетоны взаимодействуют с азотистыми основаниями с образованием неустойчивых продуктов нуклеофильного присоединения, которые стабилизируются благодаря отщеплению молекулы волы. Эта группа реакций получила название реакций присоединенияотщепления.
1. Взаимодействие с аммиаком. Альдегиды, присоединяя молекулу аммиака, образуют альд и мины. В процессе реакции в начале образуется неустойчивый аминоспирт, от которого затем отщепляется шла.
Кетоны также взаимодействуют с аммиаком, но при этом образуются продукты более сложного строения.
2.Взаимодействие с аминами. Первичные амины, реагируя с альдегидами или кетонами, дают имины. Если реакция протекает c ароматическими аминами, то образующиеся имины называют также основаниями Шиффа.
3.Взаимодействие с гидроксиламином. Продукты конденсации альдегидов и кетонов с гидроксиламином называют альдоксимами и кетоксимами.
Реакцию образования оксимов используют для выделения и идентификации альдегидов и кетонов,
4. Взаимодействие с гидразином. Подобно взаимодействию с первичными аминами протекают реакции оксосоединений с гидразином, фенилгидразином, семикарбазидом, тиосемикарбазидом.
7

Образующиеся производные оксосоединений обычно представляют собой кристаллические вещества с четкими температурами плавления. Эти реакции используются для идентификации исходных ок-сосоединений.
Реакции конденсации
1. Альдолышя конденсация. Альдегиды и кетоны, содержащие атомы водорода у α-углеролного атома, в присутствии каталитических количеств основания способны вступать в реакцию самоконденсаиии, называемую альдольной конденсацией. При этом молекулы альдегидов соединяются друг с другом посредством связей С–С и образуют альдоль – β-гидроксиальдегид:
Рассмотрим более подробно механизм реакции в условиях основного катализа. В слабощелочной среде гидроксид-ион (катализатор) отщепляет протон от α-углеродного атома альдегида с образованием енолят-аниона:
На следующей стадии сильный нуклеофил – енолят-анион атакует электронодефииитный атом углерода карбонильной группы второй молекулы альдегида с образованием альдоля:
8

При нагревании β-оксиальдегиды легко теряют воду, превращаясь в α, β-ненасыщенные альдегиды.
Легкость, с которой происходит отшепление воды, объясняется подвижностью α-водородного атома и образованием сопряженной системы двойных связей. Реакция образования ненасыщенного альдегида из альдоля известна в органической химии под названием кретоновая конденсация,
2. Сложноэфириая конденсация (реакция Тищенко). При нагревании адьдегидов в присутствии этилата алюминия образуются сложные эфиры карбоновых кислот:
В этой реакции одна молекула альдегида восстанавливается до спирта, а вторая – окисляется до кислоты. Такая реакция самоокисления-самовосстановления, получила название диспропорционирования или дисмутации.
Реакции с участием α-углеродного атома
Электроноакцепторное влияние карбонильной группы приводит к повышению подвижности атомов водорода, находящихся при α-yглеродном атоме (СН-кислоты):
К числу реакций, протекающих с участием α-углеродного атома, относится реакция галогенирования и рассмотренная ранее альдольная конденсация.
Реакция галогенирования. Альдегиды и кетоны легко вступают в реакции с галогенами с образованием α-галогенпроизводных:
9

α-Гадогенопроизводные альдегидов и кетонов проявляют слезоточивое действие и называются лакриматорами (отлат. lacrima – слеза).
При галогенировании соединений типа (СН3–СО–) в щелочной среде образуются тригалогенкарбонильные соединения, которые затем расщепляются с образованием карбоксильного аниона и три галогеналкана (СННаl3). Например, в случае йодирования в щелочной среде происходит выделение желтых кристаллов йодоформа:
Реакция образования йодоформа (йодоформная проба) используется в аналитической практике.
Реакции восстановления и окисления
1. Реакции восстановления. Реакцию восстановления альдегидов и кетонов широко используют для получения спиртов. Карбонильные соединения восстанавливаются как при каталитическом гидрировании, так при действии таких восстановителей, как алюмогидрид лития LiAIH4. Альдегиды восстанавливаются до первичных спиртов:
Кетоны восстанавливаются до вторичных спиртов:
2. Реакции окисления. Атьдегнды и кетоны по-разному относятся к действию окислителей. Альдегиды очень легко окисляются, даже при действии слабых окислителей (ионы Ag+, Cu2+). 2.1. Реакция «серебряного зеркала». При действии аммиачного раствора нитрата серебра (реактив
Толлеса) на альдегид происходит окислительно-восстановительная реакция. Альдегид окисляется в соответствующую кислоту, а катион серебра восстанавливается в металлическое серебро, которое дает блестящий налет на стенках пробирки.
Эта реакция является качественной для обнаружения альдегидной группы.
10
