
- •Литература
- •Материаловедение. Особенности атомно-кристаллического строения металлов.
- •Металлы, особенности атомно-кристаллического строения
- •Понятие об изотропии и анизотропии
- •Аллотропия или полиморфные превращения.
- •Магнитные превращения
- •Строение реальных металлов. Дефекты кристаллического строения
- •Лекция 3 Кристаллизации металлов. Методы исследования металлов.
- •Механизм и закономерности кристаллизации металлов.
- •Условия получения мелкозернистой структуры
- •Строение металлического слитка
- •Введение в теорию сплавов. Строение, кристаллизация и свойства сплавов. Диаграммы состояния.
- •Понятие о сплавах и методах их получения
- •Особенности строения, кристаллизации и свойств сплавов: механических смесей, твердых растворов, химических соединений
- •Классификация сплавов твердых растворов.
- •Кристаллизация сплавов.
- •Диаграмма состояния.
- •Методы термического анализа
- •Классификация диаграмм фазового равновесия
- •Лекция 5 Диаграммы состояния двухкомпонентных сплавов.
- •Диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии (сплавы твердые растворы с неограниченной растворимостью)
- •Диаграмма состояния сплавов с отсутствием растворимости компонентов в твердом состоянии (механические смеси)
- •Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии
- •Диаграмма состояния сплавов, компоненты которых образуют химические соединения.
- •Диаграмма состояния сплавов, испытывающих фазовые превращения в твердом состоянии (переменная растворимость)
- •Связь между свойствами сплавов и типом диаграммы состояния
Кристаллизация сплавов.
Кристаллизация сплавов подчиняется тем же закономерностям, что и кристаллизация чистых металлов. Необходимым условием является стремление системы в состояние с минимумом свободной энергии.
Основным отличием является большая роль диффузионных процессов, между жидкостью и кристаллизующейся фазой. Эти процессы необходимы для перераспределения разнородных атомов, равномерно распределенных в жидкой фазе.
В сплавах в твердых состояниях, имеют место процессы перекристаллизации, обусловленные аллотропическими превращениями компонентов сплава, распадом твердых растворов, выделением из твердых растворов вторичных фаз, когда растворимость компонентов в твердом состоянии меняется с изменением температуры.
Эти превращения называют фазовыми превращениями в твердом состоянии.
При перекристаллизации в твердом состоянии образуются центры кристаллизации и происходит их рост.
Обычно центры кристаллизации возникают по границам зерен старой фазы, где решетка имеет наиболее дефектное строение, и где имеются примеси, которые могут стать центрами новых кристаллов. У старой и новой фазы, в течение некоторого времени, имеются общие плоскости. Такая связь решеток называется когерентной связью. В случае различия строения старой и новой фаз превращение протекает с образованием промежуточных фаз.
Нарушение когерентности и обособления кристаллов наступает, когда они приобретут определенные размеры.
Процессы кристаллизации сплавов изучаются по диаграммам состояния.
Диаграмма состояния.
Диаграмма состоянияпредставляет собой графическое изображение состояния любого сплава изучаемой системы в зависимости от концентрации и температуры (рис. 4.5)
.

Рис. 4.5. Диаграмма состояния
Диаграммы состояния показывают устойчивые состояния, т.е. состояния, которые при данных условиях обладают минимумом свободной энергии, и поэтому ее также называют диаграммой равновесия, так как она показывает, какие при данных условиях существуют равновесные фазы.
Построение диаграмм состояния наиболее часто осуществляется при помощи термического анализа.
В результате получают серию кривых охлаждения, на которых при температурах фазовых превращений наблюдаются точки перегиба и температурные остановки.
Температуры, соответствующие фазовым превращениям, называют критическими точками.Некоторые критические точки имеют названия, например, точки отвечающие началу кристаллизации называют точкамиликвидус,а концу кристаллизации – точкамисолидус.
По кривым охлаждения строят диаграмму состава в координатах: по оси абсцисс –концентрация компонентов, по оси ординат – температура.
Шкала концентраций показывает содержание компонента В. Основными линиями являются линии ликвидус (1) и солидус (2), а также линии соответствующие фазовым превращениям в твердом состоянии (3, 4).
По диаграмме состояния можно определить температуры фазовых превращений, изменение фазового состава, приблизительно, свойства сплава, виды обработки, которые можно применять для сплава.
Методы термического анализа
Термический анализпредставляет собой совокупность методов определения температур фазовых превращений и других термических характеристик индивидуальных соединений или систем взаимодействующих веществ.
Основа термического анализа - определение зависимости температуры кристаллизации (или плавления) изучаемой системы от ее состава. Объектами термического анализа являются как чистые вещества, так и системы различных веществ - металлов, солей, органических соединений и т.д.
История становления термического анализа связывается с появлением первых термоизмерительных приборов. Особое место здесь занимает открытый Зеебеком в 1821 г. эффект, позволивший создать термопару и применить ее для измерения высоких температур. Эффект Зеебека состоит в том, что в электрической цепи, составленной из разных проводников, возникает термоэдс, если места контактов (спаев) поддерживаются при разных температурах. Величина термоэдс зависит от абсолютных значений температур спаев, разности этих температур и от природы материалов, составляющих термоэлемент. Коэффициент термоэдс определяется физическими характеристиками проводников, составляющих термоэлемент: концентрацией, энергетическим спектром, механизмами рассеяния носителей заряда, а также интервалом температур. Термоэдс обусловлена тремя причинами:
1) температурной зависимостью уровня Ферми, что приводит к появлению контактной составляющей термоэдс;
2) диффузией носителей заряда от горячего конца к холодному, определяющей объемную часть термоэдс;
3) процессом увлечения электронов фононами, который дает еще одну составляющую - фононную.
Строгий вывод термоэдс из кинетического уравнения достаточно сложен. Вообще, причина всех термоэлектрических явлений - нарушение теплового равновесия в потоке (то есть отличие средней энергии электронов в потоке от ее значения на уровне Ферми).
Наиболее важной технической реализацией эффекта Зеебека в металлах является термопара - термочувствительный элемент в устройствах для измерения температуры. Термопара состоит из двух последовательно соединенных пайкой или сваркой разнородных металлических проводников. В сочетании с электроизмерительными приборами термопара образует термоэлектрический термометр, шкала которого градуируется непосредственно в К или °С.
На рис. 4.6 показаны схемы включения термопары в измерительную цепь:
|
|
|
Рис. 4.6. Cхемы
включения термопары в измерительную
цепь
б) измерительный прибор подключен к концам термоэлектродов М1 и М2; ТА и ТВ - температуры соответственно "горячего" и "холодного" контактов термопары.
При измерении температуры один из контактов термостатируется (обычно при 273 К - с помощью тающего льда).
Диапазон температур, измеряемых при помощи термопар, очень велик: от гелиевых, до нескольких тысяч градусов. В таблице 1 приведены материалы термоэлектродов, из которых обычно делаются термопары, используемые для разных температурных областей.
-
Таблица 1
Диапазон температур, К
Материалы термоэлектродов
4-270
Золото - медь
70-800
Медь - константан
220-900
Хромель - копель
220-1400
Хромель - алюмель
250-1900
Платинородий - платина
300-2800
Вольфрам - рений
Впервые термопара была использована с этой целью в 1886 году Ле-Шателье. В 1889 году для измерения небольших разностей температур образца и окружающей среды Робертс-Остин использовал дифференциальную термопару. Этот способ лег в основу дифференциально-термического анализа (ДТА). Именно развитие методов ДТА стало толчком рождения новой дисциплины - физико-химического анализа. Рассмотрим простейший случай термического анализа, суть которого заключается в снятии кривых нагревания и охлаждения в координатах температура - время.
Рис.5.1.
Кривая охлаждения чистого вещества
(а)
и зависимость
времени показаний прямой (б) и
дифференциальной (в) термопар

Участок "ab" этой зависимости характеризует охлаждение жидкой фазы. Если бы кристаллизации не было , то дальнейшее охлаждение жидкости, характеризовалось бы пунктирным продолжением отрезка "ab". Однако в точке b начинается кристаллизация и в соответствии с правилом фаз Гиббса (Ф=2, К=1 и С=К-Ф+1=1-2+1=0) дальнейшая кристаллизация вещества во времени должна проходить при постоянной температуре (Ткр), хотя температура окружающего пространства продолжает убывать. Причина этого заключается в том, что выделяющаяся теплота кристаллизации компенсирует тепловой поток, направленный от более нагретого образца к более холодной окружающей среде. В точке c кристаллизация вещества заканчивается. Однако более высокая температура образца сохраняется. Единственным процессом, протекающим во времени, остается теплопередача от образца во внешнюю среду (участок cd).
Характер кривой, изображенный на рисунке , отчетливо проявляется при достаточно большой массе образца и соответствующем масштабе температурной шкалы. Эти условия в эксперименте трудно выполнимы. Поэтому чаще используют т.н. дифференциально-термический метод.
Другим методов физико-химического исследования является дифференциальный термический анализ (ДТА). Он позволяет изучать характер фазовых превращений и осуществлять построение диаграммы состояния (ДС).
При дифференциальном термическом анализе возможно обеспечить более высокую точность и отделить случайные колебания температур от вызванных протеканием истинных фазовых превращений, в отличие от термического анализа.
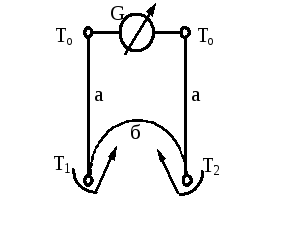
Рис.5.2.
Схема дифференциальной термопары: а -
электроды из одного материала; б-
электрод из другого материала; Т1
и Т2 -
горячие спаи
Можно отчетливо наблюдать (рис.5,1 б,в), что температура критической точки «с’» отчетливее выявляется по дифференциальной кривой, чем по кривой охлаждения, поэтому точность анализа в этом случае выше, чем при обычном термическом.


