
- •Структура и функции иммуноглобулинов
- •Иммуноглобулины: структурно – функциональные взаимоотношения
- •Иммуноглобулины являются бифункциональными протеинами
- •Иммуноглобулиновые домены
- •Суперсемейство генов Ig
- •СТРУКТУРА ДОМЕНОВ ИММУНОГЛОБУЛИНОВ
- •Гибкость
- •View structures
- •View structures
- •Гипервариабельные участки расположены на концевых петлях v - регионов
- •модель (Fab)2, расположение гипервариабельных участков
- •Антигены различаются размером и структурой
- •Антитела взаимодействуют с антигенами разными способами
- •Модель
- •Электронная фотография антител и компонентов системы комплемента, опсонизирующих вирус Epstein Barr (EBV)
- •Электронная фотография действия антител и компонентов системы комплемента на бактерии
- •Нековалентные взаимодействия между антителами и антигенами
- •функции (Fab – antigen binding) фрагментов в молекулах Ig
- •Структура и функции Fc фрагмента
- •Мономерный IgM
- •МУЛЬТИМЕРИЗАЦИЯ IgM
- •Изменения конформации молекулы IgM, вызванные антигеном
- •IgA - димеризация и секреция
- •секреторный IgA и трансцитоз
- •высокоаффинные IgE рецепторы (Fc RI)
- •C1q связывающее место расположено в C 2 домене
- •Fc рецепторы
- •Различия в аминокислотной последовательности молекул антител
Структура и функции иммуноглобулинов
Иммуноглобулины: структурно – функциональные взаимоотношения
•Рецепторы к антигенам на поверхности В клетки:
Позволяют В клеткам «чувствовать» их антигенное микроокружение
Связывают внеклеточное пространство с механизмами внутриклеточного сигналлинга
•СЕКРЕТИРУЕМЫЕ АНТИТЕЛА – функции:
нейтрализация
привлечение эффекторных клеток
фиксация комплемента
Иммуноглобулины являются бифункциональными протеинами
•Иммуноглобулины взаимодействуют лишь с небольшим числом специализированных молекул -
Fc рецепторами на поверхности клеток
компонентами системы комплемента
внутриклеточными сигнальными молекулами
•Распознают определенные антигенные детерминанты
Иммуноглобулиновые домены
•Сохранение структуры и возможность к изменениям в каждой молекуле иммуноглобулина обеспечивают глобулярные структуры - ДОМЕНЫ
•Легкая цепь молекулы Ig (212 остатков аминокислот) стереотипно сворачивается, формируя 2 домена – вариабельный и константный.
•Тяжелая цепь молекулы IgG, A и D (450 остатков аминокислот) стереотипно сворачивается, формируя 4 домена –1 вариабельный и 3 константных.
•Антигенсвязывающие центры (Fab)2 молекул образованы вариабельными доменами легких и тяжелых цепей - VL и VH.

Суперсемейство генов Ig
Гены, кодирующие Ig домены
Хотя первыми были открыты иммуноглобулины, позже было обнаружено целое суперсемейство молекул, кодируемых этими генами. Среди таких молекул -молекулы межклеточных взаимодействий и молекулы распознающих систем.
Суперсемейство генов Ig обнаружено во многих клетках организма.
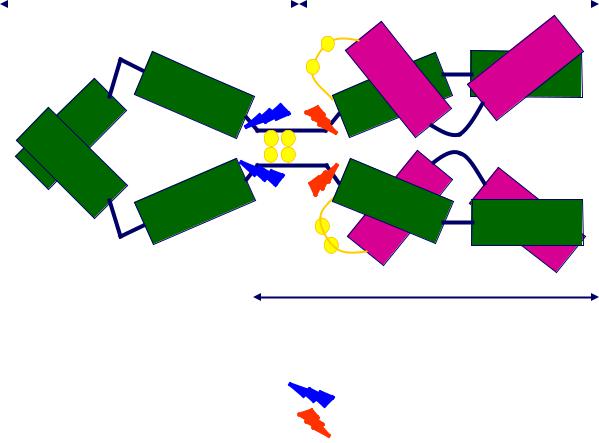
СТРУКТУРА ДОМЕНОВ ИММУНОГЛОБУЛИНОВ
Домены –компактно уложенные структуры, устойчивые к действию протеаз
Fc |
|
Fab |
|
|
|
|
3 |
C |
H |
|
Домены тяжелых цепей
или
C2 H
S
S |
L |
|
|
|
C |
S S |
|
S S |
|
|
C |
|
H1 |
|
S |
|
S |
F(ab)2
VL
VH
С домены легких цепей
или
Места отрыва пепсином |
- 1 x (Fab)2 и 1 x Fc |
Места отрыва папаином |
- 2 x Fab 1 x Fc |

CH3

CH2
CH3

CH1
CH2
CH3

VH1
CH1
CH2
CH3

VH1
CH1
VL
CH2
CH3

VH1
CH1
VL CL
CH2
CH3

VH1
CH1
VL CL
CH2
CH3

VH1
CH1
CL VL
CH2
CH3
