
Физика (Оптика)_ЛЕКЦИИ И ВОПРОСЫ / OF6_6_Взаимодействие излучения с веществом_mini
.pdf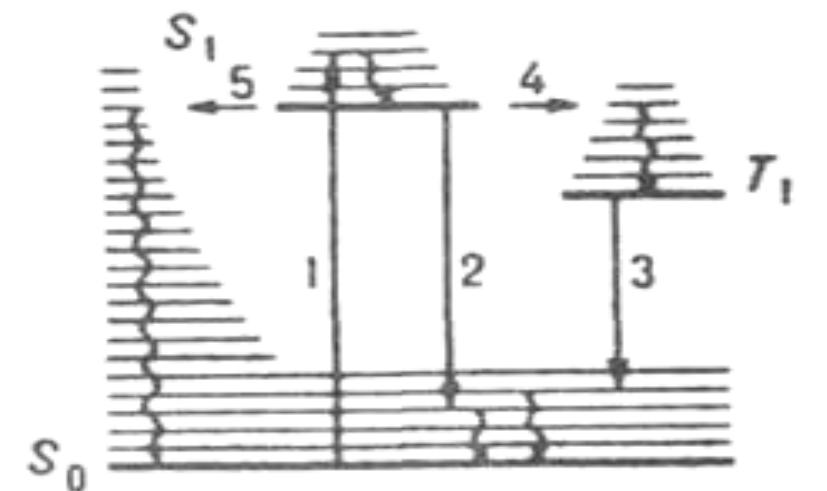
Схема квантовых переходов при молекулярной люминесценции. S0 – основной электронный уровень (с колебательными уровнями), S1 – возбужденный электронный уровень (синглетный) Т1 – возбуждённый электронный уровень (триплетный). 1 – поглощение; 2 – флуоресценция; 3 – фосфоресценция; 4 – интеркомбинационная конверсия; 5 – внутренняя конверсия. Волнистыми стрелками обозначены процессы колебательной релаксации энергии возбуждения
© А.В. Бармасов, 1998-2013 |
21 |
12+ |
|

Схематическое изображение физического механизма люминесценции: S0 – основное (невозбуждённое) состояние; S1, S2 и Т1 – возбуждённые состояния; в прямоугольниках показано направление спина возбуждённого электрона (слева) по отношению к спину оставшегося электрона; ВК – внутренняя конверсия (переходы электрона без обращения спина); К – интеркомбинационная конверсия (переходы электрона с обращением спина)
© А.В. Бармасов, 1998-2013 |
22 |
12+ |
|
Физический механизм люминесценции
При поглощении энергии молекула переходит в возбуждённое состояние S1 или S2 (обозначено синими вертикальными стрелками). Часть поглощённой энергии преобразуется в тепло (обозначено волнистыми стрелками), при этом молекула переходит на нижний колебательный уровень состояния S1 или переходит в состояние Т1.
Возвращение молекулы из состояния S1 или Т1 на
исходный энергетический уровень может сопровождаться излучением света – флуоресценцией
(обозначена тёмно-зелёными стрелками) или фосфоресценцией (обозначена светло-зелёными
стрелками).
© А.В. Бармасов, 1998-2013 |
23 |
12+ |
|
Флуоресценция
(Fluorescence)
Средняя длительность – 10 –8 с.
Явление флуоресценции молекулы записывают в виде процесса:
1М(↑↓) + hνM → 1M*(↑)(↓) → 1M(↑↓) +hνf
© А.В. Бармасов, 1998-2013 |
24 |
12+ |
|

Зелёным цветом обозначен спектр поглощения хлорофилла, а красным – спектр флуоресценции хлорофилла. Максимумы поглощения хлорофилла находятся в красной и сине-фиолетовой области спектра, а флуоресценция происходит лишь в красной. Это связано с электронными переходами. Её спектральная линия как бы зеркально перевёрнута и сдвинута в длинноволновую сторону
© А.В. Бармасов, 1998-2013 |
25 |
12+ |
|
Правило Стокса
Зеркальная симметрия привела к важному заключению – правилу Стокса:
hν21 < hν12, где:
hν12 – квант, поглощённый молекулой, а hν21 – квант, испускаемый молекулой.
Чем больше стоксов сдвиг, тем большая доля энергии поглощённого кванта перешла в энергию колебательного возбуждения ядер атомов в молекуле.
Если hν21 > hν12, то такую флуоресценцию называют
антистоксовой.
© А.В. Бармасов, 1998-2013 |
26 |
12+ |
|

Английский математик, механик и физик-теоретик ирландского происхождения
Сэр Джордж Габриель Стокс (Sir George Gabriel Stokes)
(13.08.1819–1.02.1903)
© А.В. Бармасов, 1998-2013 |
27 |
12+ |
|
Фосфоресценция
(Phosphorescence)
Сложные органические молекулы наряду с излучением флуоресценции обладают длительным свечением – фосфоресценцией с полосой излучения, смещённой в более длинноволновую область оптического спектра.
Средняя длительность – 10 –5 – 10 –1 с, а иногда и несколько секунд.
© А.В. Бармасов, 1998-2013 |
28 |
12+ |
|
Фосфоресценция
(Phosphorescence)
Первая интерпретация фосфоресценции была дана Яблонским в 1933 г. Он объяснил её наличием метастабильного состояния.
В 1943 г. природу метастабильного состояния объяснил академик А.Н. Теренин.
© А.В. Бармасов, 1998-2013 |
29 |
12+ |
|

Русский физикохимик Александр Николаевич Терéнин
(1896-1967)
© А.В. Бармасов, 1998-2013 |
30 |
12+ |
|
