
- •Альдегиды и кетоны
- •Методы получения
- •Реакционная способность
- •I. Реакции присоединения по карбонильной группе
- •II. Реакции присоединения-отщепления (реакции с азотистыми нуклеофилами).
- •III. Реакции с участием атомов водорода при -углеродном атоме
- •2. Реакции альдольной и кротоновой конденсации
- •IV. Реакции окисления
- •Карбоновые кислоты
- •Методы получения
- •Реакционная способность
- •I. Он-кислотность карбоновых кислот
- •II. Реакции замещения он-группы
- •Сложные эфиры
- •Соли карбоновых кислот
- •Амиды карбоновых кислот
- •1. Гидролиз
- •2. Кислотно-основные свойства
- •Нитрилы карбоновых кислот
- •Жиры, масла
- •Общая формула жиров (масел)
- •Физические свойства
- •Реакционная способность
- •Дикарбоновые кислоты
- •Угольная кислота и ее производные
- •Синтез некоторых производных угольной кислоты и их свойства
- •1. Основные свойства мочевины
- •2. Реакции мочевины по амидному фрагменту
- •3. Поведение при нагревании
Альдегиды и кетоны

Номенклатура
Альдегиды суффикс аль

Кетоны суффикс он

Методы получения
1. Гидратация алкинов (реакция Кучерова) (см. тему “Алкины”)
2. Окисление и дегидрирование первичных и вторичных спиртов (см. тему “Спирты”)
3. Пиролиз (декарбоксилирование) солей карбоновых кислот

Реакционная способность

Атомы углерода и кислорода в карбонильной группе находятся в sp2-гибридизации, группа имеет плоское строение. Связь СО поляризована, электронная плотность смещена к атому кислорода.

Дефицит электронной плотности на атоме углерода карбонила (+') в кетонах меньше, чем в альдегидах (+) из-за донорных эффектов двух алкильных групп. Следствием этого является снижение реакционной способности карбонильной группы в кетонах.
I. Реакции присоединения по карбонильной группе
1. Восстановление (гидрирование) – синтез первичных и вторичных спиртов.
При восстановлении или гидрировании альдегидов получают первичные спирты, из кетонов образуются вторичные спирты.
а) гидрирование

б) восстановление боргидридом натрия (NaBH4) и алюмогидридом лития (LiAlH4)

2. Присоединение HCN – образование циангидринов или нитрилов 2-оксикислот.
Реакция носит название циангидринного синтеза и используется при получении 2-окси- и 2-аминокислот (см. материалы 2-го семестра).

Механизм AdNu –нуклеофильное присоединение по карбонильной группе
Nu – СN (нитрил-анион)


В качестве реагента также можно использовать КСN в присутствии воды.

2. Присоединение NaHSO3 (гидросульфита натрия) – образование бисульфитного производного (качественная реакция)

Механизм AdNu, Nu –атом серы за счет НПЭ:
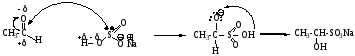
Пространственно затрудненные (разветвленные) кетоны, например диизопропилкетон, не образуют бисульфитные производные. Реакция может служить качественной, бисульфитные производные легко кристаллизуются. Эту реакцию также используют для выделения альдегидов (кетонов) из смеси с другими соединениями.
4. Присоединение реактивов Гриньяра – синтез спиртов всех типов.
а) из формальдегида получают первичные спирты

б) из других альдегидов получают вторичные спирты

в) из кетонов получают третичные спирты

Присоединение слабых нуклеофилов
Для присоединения слабых нуклеофилов необходим кислый катализ.
1. Присоединение H2O , НХ Х=Cl, Br
Реакции с этими реагентами обратимы, продукты присоединения (аддукты) нестабильны.

Исключением являются аддукты воды и альдегидов (кетонов), имеющих акцепторные группы.

2.Присоединение спиртов – образование полуацеталей (полукеталей), ацеталей (кеталей).
Присоединение одной молекулы спирта к альдегиду приводит к синтезу полуацеталей, к кетону – полукеталей. При дальнейшем взаимодействии со второй молекулой спирта из полуцеталя образуется ацеталь, из полукеталя – кеталь. Полуацетали и полукетали содержат при одном атоме углерода гидроксильную и алкоксигруппы, у ацеталей и кеталей – при одном атоме углерода две алкоксигруппы.

Механизм образования полуацеталя и ацеталя приведен ниже:


