
- •В.И. Вигдорович, с.В. Романцова, н.В. Шель, и.В. Зарапина
- •Оглавление
- •Предисловие
- •Часть I. Основы органической химии
- •Структура органических соединений
- •Теория строения органических соединений а.М. Бутлерова
- •Изомерия органических соединений
- •Индуктивный и мезомерный эффекты
- •Понятие о мезомерном эффекте
- •Типы реакций органических соединений. Понятие о механизме реакции
- •Типы реакций в органической химии
- •Направление и селективность химической реакции
- •Предельные (насыщенные) углеводороды
- •Изомерия алканов.Для алканов характерен один из видов структурной изомерии – изомерия углеродной цепи (строения углеродного скелета). Приведем примеры таких изомеров:
- •Физические свойства алканов
- •Физические характеристики некоторых нормальных углеводородов
- •Влияние разветвления молекул алканов на их физические характеристики
- •Химические свойства алканов
- •Некоторые отдельные представители
- •Экологическая характеристика алканов
- •Задачи по теме
- •Циклоалканы
- •Физические свойства циклоалканов
- •Получение циклоалканов
- •Химические свойства малых циклов
- •Применение циклоалканов
- •Экологическая оценка
- •Непредельные углеводороды Алкены (олефины)
- •Физические свойства олефинов
- •Получение олефиновых углеводородов
- •Химические свойства олефинов
- •Отдельные представители олефинов
- •Экологические характеристики
- •Задачи по теме
- •Алкадиены (диеновые углеводороды)
- •Методы получение диенов
- •Химические свойства диенов
- •Каучуки
- •Экологическая характеристика
- •Задачи по теме
- •Алкины (ацетиленовые углеводороды)
- •Методы получения алкинов
- •Физические свойства алкинов
- •Химические свойства алкинов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные спирты
- •Предельные одноатомные спирты
- •Получение одноатомных спиртов
- •Физические свойства первичных спиртов
- •Химические свойства одноатомных спиртов
- •Отдельные представители
- •Предельные многоатомные спирты
- •Получение двухатомных спиртов
- •Получение трехатомных спиртов
- •Физические свойства многоатомных спиртов
- •Химические свойства многоатомных спиртов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные оксосоединения
- •Альдегиды
- •Получение альдегидов
- •Физические свойства альдегидов
- •Химические свойства альдегидов
- •Отдельные представители
- •Экологическая характеристика
- •Получение кетонов
- •Химические свойства кетонов
- •Отдельные представители
- •Задачи по теме
- •Карбоновые кислоты
- •Электронное строение карбоксильной группы
- •Предельные карбоновые кислоты
- •Физические свойства кислот
- •Получение карбоновых кислот
- •Химические свойства карбоновых кислот
- •Свойства отдельных представителей гомологического ряда
- •Задачи по теме
- •Азотсодержащие органические соединения
- •Нитросоединения
- •Нитрилы и изоцианиды
- •Алифатические амины
- •Физические свойства аминов
- •Получение аминов
- •Химические свойства аминов
- •Отдельные представители
- •Экологическая характеристика
- •Задачи по теме
- •Аминокислоты
- •Физические свойства α-аминокислот
- •Способы получения -аминокислот
- •Способы получения -аминокислот
- •Химические свойства аминокислот
- •Отдельные представители
- •Простые и сложные эфиры Простые эфиры
- •Способы получения простых эфиров
- •Физические свойства простых эфиров
- •Химические свойства простых эфиров
- •Отдельные представители
- •Сложные эфиры карбоновых кислот Получение сложных эфиров карбоновых кислот
- •Химические свойства эфиров карбоновых кислот
- •Физические свойства жиров
- •Химические свойства жиров
- •Сложные липиды
- •Ароматические углеводороды, арены Бензол и его производные
- •Методы получения бензола и его гомологов
- •Получение гомологов бензола
- •Физические свойства аренов
- •Химические свойства
- •Экологиченские характеристики
- •Ароматические оксосоединения Фенолы
- •Некоторые физические и термодинамические характеристики ряда фенолов
- •Получение фенола
- •Некоторые химические свойства фенола
- •Задачи по теме
- •Гетероциклические соединения
- •Пятичленные гетероциклы с одним гетероатомом
- •Химические свойства пиридина
- •Диоксины
- •Физико-химические свойства ксенобиотиков типа диоксинов
- •Источники ксенобиотиков
- •Пестициды
- •Фуллерены. Синтез и свойства соединений на их основе
- •Методы получения гидридов фуллеренов
- •Кислотность фуллеренов
- •Применение фуллеренов
- •Высокомолекулярные соединения
- •Свойства высокомолекулярных соединений
- •Основные химические реакции высокомолекулярных соединений
- •Часть II основы химической термодинамики
- •Понятия и термины химической термодинамики
- •Внутренняя энергия
- •Первое началотермодинамики
- •Следствия из первого начала термодинамики
- •Теплоемкость при постоянном объеме, сv
- •Теплоемкость при постоянном давлении
- •Равновесные процессы. Максимальная работа
- •Термохимия
- •Закон Гесса
- •Следствия из закона Гесса
- •И окончательно
- •Связь h и u химических реакций
- •Зависимость тепловых эффектов от температуры. Закон Кирхгофа
- •Совершенно очевидно, что разности Сi можно выразить через уравнение
- •Средняя теплоемкость
- •Работа тепловой машины. Теорема и цикл Карно
- •Второе начало термодинамики
- •Энтропия как критерий самопроизвольного течения процесса
- •Следовательно, если такой процесс протекает в изолированной системе, то
- •Расчет энтропии
- •Расчет изменения энтропии идеального газа
- •Задачи для самостоятельного решения
- •Принцип локального равновесия
- •Важно найти функции, определяющие зависимость deSиdiSот экспериментально измеряемых величин.
- •Статистическая интерпретация энтропии
- •Химический потенциал и химическое сродство
- •Химический потенциал
- •Химическое сродство
- •Уравнение Клапейрона-Клаузиуса
- •Термодинамические потенциалы
- •Свободная энергия Гиббса
- •Для чистого вещества
- •Условия самопроизвольного протекания процесса
- •Уравнение Гиббса-Гельмгольца
- •Тепловая теорема Нернста. Третий закон термодинамики
- •Некоторые аспекты, связанные с достижением химического равновесия
- •Изотерма химической реакции
- •Изобара химической реакции
- •Задачи для самостоятельного решения
- •Задача 7.Для реакции
- •Задача 8.Для реакции
- •Задача 10.Для реакции
- •Задача 11. Для реакции
- •Литература Основная литература
- •Дополнительная литература
Изотерма химической реакции
Ранее мы показали, что существует равенство:
![]() . (65)
. (65)
И, кроме того, также ранее показана справедливость уравнения
dG = –SdT
+ Vdp +
![]() .
.
Примем в частном случае, что dni = i, a dnj = j. В этом варианте при p = const и V = const
G = ini.
А так как действительно уравнение, которое также использовано ранее
= ![]() (Т)
+RTlnpi,
(Т)
+RTlnpi,
то имеем (Т = const):
G =
i![]() +
RTlnp
+
RTlnp![]() .
.
В свою очередь с учетом равенства
![]()
получаем для частного случая химической реакции (50) зависимость
G =
–RTlnKp(T)
+ RTln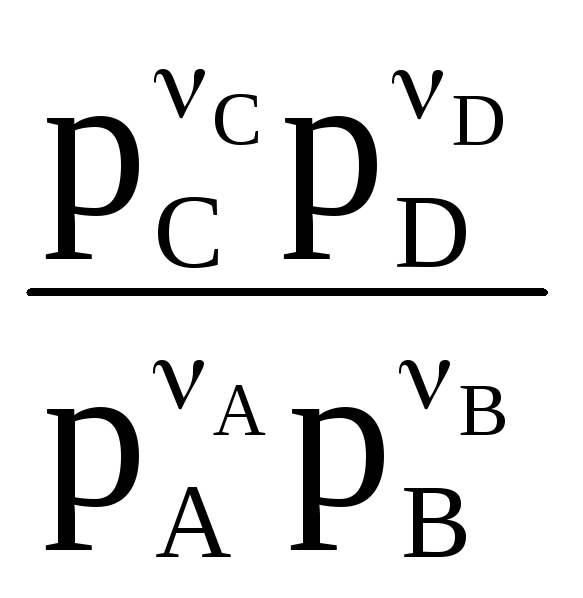 , (66)
, (66)
именуемую уравнением Вант-Гоффа, полученным им в 1886 г и названным изотермой химической реакции. Зависимость (66) легко может быть распространена на самый общий случай химического взаимодействия:
aA + bB + … ⇆ cC + dD + …
Изобара химической реакции
Влияние температуры на константу химического равновесия описывается уравнением:
lnKp
=![]() .
.
Продифференцируем это уравнение по температуре при постоянном давлении и полученный результат сочетаем с уравнением Гиббса-Гельмгольца. Тогда окончательно получим зависимость
![]()
или отойдя от частных производных имеем
dlnKp
=![]() .
.
Это уравнение получило название изобары химической реакции.
Проанализируем его.
1. Пусть H = const. Это может наблюдаться только в узком температурном интервале.
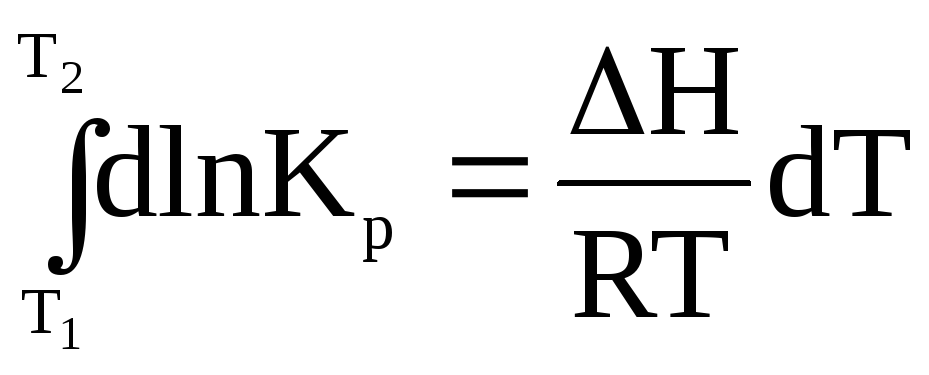
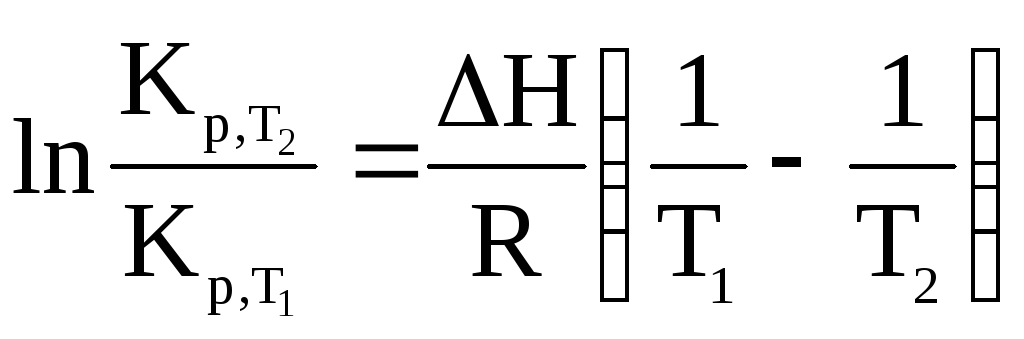 .
.
2. H = f(T) и для всех участников реакции действительно уравнение Ср = a + bT + cT2. В этом случае целесообразно найти тепловой эффект реакции при 298 К, а затем провести интегрирование с учетом зависимости Ср от температуры
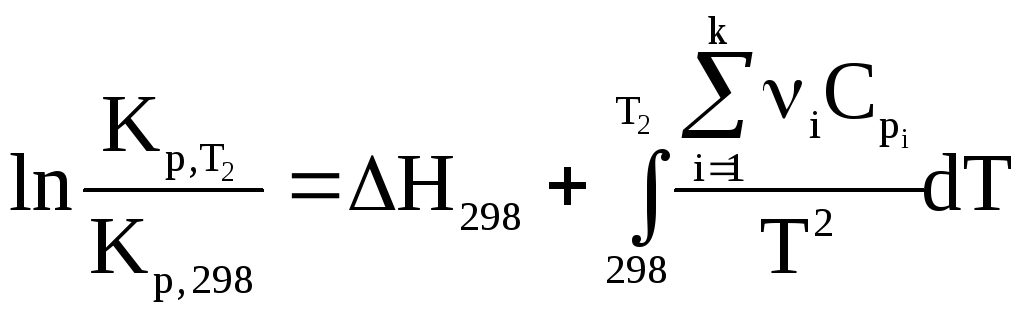 .
.
Рассмотрим несколько примеров решения задач.
Задача 1. Найти константу равновесия реакции
Fe2O3(т) + СО(г) 2FeO(т) + СО2(г)
при 298 К и р = 1,0135 105 Па, если
![]() (Fe2O3)
= –741 кДж/моль;
(Fe2O3)
= –741 кДж/моль;
![]() (СО)
= –137,2 кДж/моль;
(СО)
= –137,2 кДж/моль;
![]() (FeO)
= –254,2 кДж/моль;
(FeO)
= –254,2 кДж/моль;
![]() (СО2)
= –394,4 кДж/моль.
(СО2)
= –394,4 кДж/моль.
Gp = 2G(FeO(т)) + G(СО2(г)) – G(Fe2O3(т)) – G(СО(г));
Gp = –394,4 – 2 254,2 + 741 + 132,2;
Gp = –29,6 кДж/моль = –29600 Дж/моль.
G = –RTlnKp
![]() ;
;
Кр = 1,55 106.
Высокое значение величины Кр указывает, что реакция практически идет до конца.
Задача 2. Степень диссоциации фосгена по реакции
COCl2 ⇆ CO + Cl2
при 600 С и 1,38 105 н/м2 равна 0,9. Определить в каком направлении будет протекать процесс при следующих заданных значениях парциальных давлений компонентов:
|
Варианты |
|
|
|
|
1 |
1,013 105 |
1,013 105 |
1,013 105 |
|
2 |
1,048 105 |
2,026 105 |
3,039 105 |
|
3 |
1,048 105 |
3,039 105 |
3,039 105 |
Определяем константу равновесия реакции
COCl2 ⇆ CO + Cl2
n(1 – ) n n
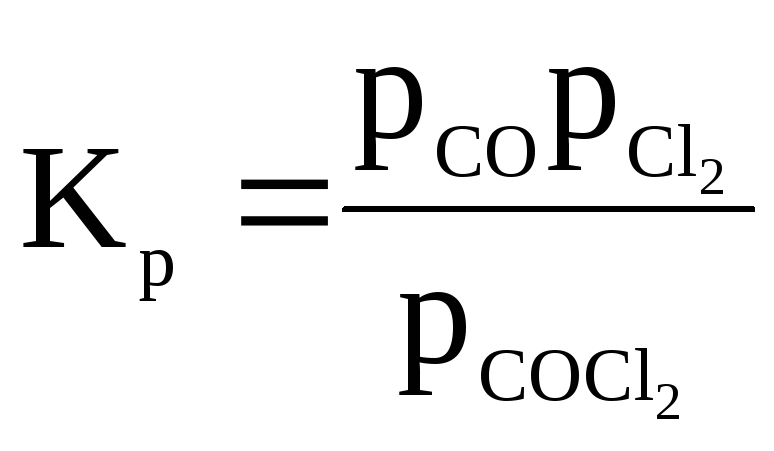 ;
; ![]() =
=![]() =
=![]() ;
;![]() =
=![]() .
.
После подстановки и простых преобразований получаем
![]() н/м2.
н/м2.
Направление процесса определяем по изменению изобарного потенциала G, которое вычисляем по уравнению изотермы химической реакции.
Для первого случая:
![]() кДж.
кДж.
Следовательно, в первом случае протекание процесса в прямом направлении возможен.
Для второго случая:
![]() .
.
Следовательно, во втором случае система находится в равновесии.
Для третьего случая:
![]() кДж.
кДж.
Следовательно, в третьем случае процесс в прямом направлении неосуществим, но возможен в обратном направлении.
Задача 3. Давление диссоциации NiO при 600 С равно 4 10–17 мм.рт.ст. Определить изменение изобарного потенциала для реакции
2Ni(т) + О2(г) ⇆ 2NiO(т)
при этой температуре, если кислород взят под давлением 1,013 105 н/м2.
Определяем константу равновесия данной реакции
![]() ,
,
![]() равно 4
10–17
мм.рт.ст., или
равно 4
10–17
мм.рт.ст., или
![]() н/м2;
отсюда
н/м2;
отсюда
![]() (н/м2)–1.
(н/м2)–1.
Определяем изменение изобарного потенциала:
![]() кДж.
кДж.
Задача 4. Возможен ли термодинамический процесс получения анилина из хлорбензола и аммиака по уравнению
С6H5Cl(ж) + NH3(г) ⇆ С6H5NH2(ж) + HCl(г),
если известны стандартные изменения изобарного потенциала образования веществ, входящих в данную реакцию:
G0(С6H5Cl) = 198,4 кДж/моль;
G0(NH3) = –16,63 кДж/моль;
G0(С6H5NH2) = 153,1 кДж/моль;
G0(HCl) = –95,28 кДж/моль.
Вычисляем стандартное изменение изобарного потенциала реакции
G![]() =(nG0)прод–(nG0)исх=153,1
–95,28+16,63–198,4= –123,95 кДж.
=(nG0)прод–(nG0)исх=153,1
–95,28+16,63–198,4= –123,95 кДж.
Следовательно, процесс возможен.
