- •В.И. Вигдорович, с.В. Романцова, н.В. Шель, и.В. Зарапина
- •Оглавление
- •Предисловие
- •Часть I. Основы органической химии
- •Структура органических соединений
- •Теория строения органических соединений а.М. Бутлерова
- •Изомерия органических соединений
- •Индуктивный и мезомерный эффекты
- •Понятие о мезомерном эффекте
- •Типы реакций органических соединений. Понятие о механизме реакции
- •Типы реакций в органической химии
- •Направление и селективность химической реакции
- •Предельные (насыщенные) углеводороды
- •Изомерия алканов.Для алканов характерен один из видов структурной изомерии – изомерия углеродной цепи (строения углеродного скелета). Приведем примеры таких изомеров:
- •Физические свойства алканов
- •Физические характеристики некоторых нормальных углеводородов
- •Влияние разветвления молекул алканов на их физические характеристики
- •Химические свойства алканов
- •Некоторые отдельные представители
- •Экологическая характеристика алканов
- •Задачи по теме
- •Циклоалканы
- •Физические свойства циклоалканов
- •Получение циклоалканов
- •Химические свойства малых циклов
- •Применение циклоалканов
- •Экологическая оценка
- •Непредельные углеводороды Алкены (олефины)
- •Физические свойства олефинов
- •Получение олефиновых углеводородов
- •Химические свойства олефинов
- •Отдельные представители олефинов
- •Экологические характеристики
- •Задачи по теме
- •Алкадиены (диеновые углеводороды)
- •Методы получение диенов
- •Химические свойства диенов
- •Каучуки
- •Экологическая характеристика
- •Задачи по теме
- •Алкины (ацетиленовые углеводороды)
- •Методы получения алкинов
- •Физические свойства алкинов
- •Химические свойства алкинов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные спирты
- •Предельные одноатомные спирты
- •Получение одноатомных спиртов
- •Физические свойства первичных спиртов
- •Химические свойства одноатомных спиртов
- •Отдельные представители
- •Предельные многоатомные спирты
- •Получение двухатомных спиртов
- •Получение трехатомных спиртов
- •Физические свойства многоатомных спиртов
- •Химические свойства многоатомных спиртов
- •Экологическая характеристика
- •Задачи по теме
- •Предельные оксосоединения
- •Альдегиды
- •Получение альдегидов
- •Физические свойства альдегидов
- •Химические свойства альдегидов
- •Отдельные представители
- •Экологическая характеристика
- •Получение кетонов
- •Химические свойства кетонов
- •Отдельные представители
- •Задачи по теме
- •Карбоновые кислоты
- •Электронное строение карбоксильной группы
- •Предельные карбоновые кислоты
- •Физические свойства кислот
- •Получение карбоновых кислот
- •Химические свойства карбоновых кислот
- •Свойства отдельных представителей гомологического ряда
- •Задачи по теме
- •Азотсодержащие органические соединения
- •Нитросоединения
- •Нитрилы и изоцианиды
- •Алифатические амины
- •Физические свойства аминов
- •Получение аминов
- •Химические свойства аминов
- •Отдельные представители
- •Экологическая характеристика
- •Задачи по теме
- •Аминокислоты
- •Физические свойства α-аминокислот
- •Способы получения -аминокислот
- •Способы получения -аминокислот
- •Химические свойства аминокислот
- •Отдельные представители
- •Простые и сложные эфиры Простые эфиры
- •Способы получения простых эфиров
- •Физические свойства простых эфиров
- •Химические свойства простых эфиров
- •Отдельные представители
- •Сложные эфиры карбоновых кислот Получение сложных эфиров карбоновых кислот
- •Химические свойства эфиров карбоновых кислот
- •Физические свойства жиров
- •Химические свойства жиров
- •Сложные липиды
- •Ароматические углеводороды, арены Бензол и его производные
- •Методы получения бензола и его гомологов
- •Получение гомологов бензола
- •Физические свойства аренов
- •Химические свойства
- •Экологиченские характеристики
- •Ароматические оксосоединения Фенолы
- •Некоторые физические и термодинамические характеристики ряда фенолов
- •Получение фенола
- •Некоторые химические свойства фенола
- •Задачи по теме
- •Гетероциклические соединения
- •Пятичленные гетероциклы с одним гетероатомом
- •Химические свойства пиридина
- •Диоксины
- •Физико-химические свойства ксенобиотиков типа диоксинов
- •Источники ксенобиотиков
- •Пестициды
- •Фуллерены. Синтез и свойства соединений на их основе
- •Методы получения гидридов фуллеренов
- •Кислотность фуллеренов
- •Применение фуллеренов
- •Высокомолекулярные соединения
- •Свойства высокомолекулярных соединений
- •Основные химические реакции высокомолекулярных соединений
- •Часть II основы химической термодинамики
- •Понятия и термины химической термодинамики
- •Внутренняя энергия
- •Первое началотермодинамики
- •Следствия из первого начала термодинамики
- •Теплоемкость при постоянном объеме, сv
- •Теплоемкость при постоянном давлении
- •Равновесные процессы. Максимальная работа
- •Термохимия
- •Закон Гесса
- •Следствия из закона Гесса
- •И окончательно
- •Связь h и u химических реакций
- •Зависимость тепловых эффектов от температуры. Закон Кирхгофа
- •Совершенно очевидно, что разности Сi можно выразить через уравнение
- •Средняя теплоемкость
- •Работа тепловой машины. Теорема и цикл Карно
- •Второе начало термодинамики
- •Энтропия как критерий самопроизвольного течения процесса
- •Следовательно, если такой процесс протекает в изолированной системе, то
- •Расчет энтропии
- •Расчет изменения энтропии идеального газа
- •Задачи для самостоятельного решения
- •Принцип локального равновесия
- •Важно найти функции, определяющие зависимость deSиdiSот экспериментально измеряемых величин.
- •Статистическая интерпретация энтропии
- •Химический потенциал и химическое сродство
- •Химический потенциал
- •Химическое сродство
- •Уравнение Клапейрона-Клаузиуса
- •Термодинамические потенциалы
- •Свободная энергия Гиббса
- •Для чистого вещества
- •Условия самопроизвольного протекания процесса
- •Уравнение Гиббса-Гельмгольца
- •Тепловая теорема Нернста. Третий закон термодинамики
- •Некоторые аспекты, связанные с достижением химического равновесия
- •Изотерма химической реакции
- •Изобара химической реакции
- •Задачи для самостоятельного решения
- •Задача 7.Для реакции
- •Задача 8.Для реакции
- •Задача 10.Для реакции
- •Задача 11. Для реакции
- •Литература Основная литература
- •Дополнительная литература
Экологическая оценка
Экологическая характеристика соединений этого класса изучена слабо. Отметим лишь, что минимальная концентрация, ведущая к боковому положению белых мышей с последующим летальным исходом составляет: для циклопропана – 110 мг/л; для метилциклопропана – 95-120 мг/л; для этилциклопропана – 35 мг/л. Таким образом, она сопоставима со значениями для н-предельных углеводородов.
Непредельные углеводороды Алкены (олефины)
Представители этого класса химических соединений, называемых также этиленовыми углеводородами, содержат в молекуле одну двойную связь, в связи с чем,формула их гомологического ряда имеет вид СnH2n, то есть тождественна таковой для циклоалканов. Так как соединениеcn= 1 СН2(метилен) не существует в силу чрезвычайно высокой химической активности, это привело к двум обстоятельствам:
вызвало появление представлений о существовании двойной связи в органических соединениях;
к существованию этилена, С2Н4, как первого члена соответствующего гомологического ряда.
Ранее отмечалось, что в органических соединениях атом углерода находится в возбужденном состоянии и возможен процесс sp3-гибридизации. Однако, если появляется двойная связь, гибридизации подвергаются лишь две из трех р-орбиталей. Хорошо известно, что такой тип называетсяsp2-гибридизацией, что приводит к образованию атомом углерода трех-связей в органических соединениях с углами между ними 120, находящимися в одной плоскости. Оставшиеся негибридизованными р-орбитали двух взаимодействующих атомов, точнее находящиеся на них валентные электроны образуют-связь. Как читателям уже известно, эта связь располагается под углом в 90к линии, соединяющей центры взаимодействующих атомов (рис. 11). Уголравен 120,90.
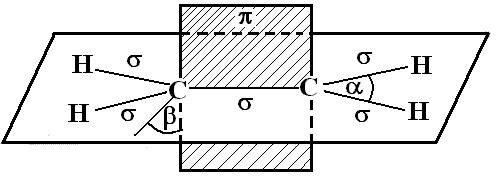
Рис. 11. Схематическое расположение связей в молекуле этилена.
-связь не является сферически симметричной и не позволяет образующим ее атомам вращаться относительно линии, соединяющей их центры. Вместе с тем, образующие ее электроны более доступны для внешних воздействий, а энергия этой связи (256,1 кДж/моль) ниже энергии -связи, образуемой атомами углерода (331,8 кДж/моль). Следовательно, олефины более реакционноспособны, чем алканы, а их химические свойства, в числе прочих, несомненно связаны с разрывом-связи. Другой характеристикой-связи является ее высокая поляризуемость, ведущая к способности приобретать дополнительный заряд под воздействием внешнего электрического поля. В силу этого алкены способны к разрыву С–С-связи не только по радикальному, но и по ионному механизму.
Таким образом, можно сформулировать основные отличия двойной связи от одинарной:
– расстояние между атомами углерода при двойной связи меньше, чем при одинарной (0,134 нм); угол между гибридными атомными 120;
– электроотрицательность sp2 -гибридизованного атома С = 2,69, это выше, чем у sp3 -гибридизованного атома С;
– затрудненное вращение вокруг линии, соединяющей атомы С;
– двойная связь более прочна, т.к. увеличивается электронная плотность на связывающих молекулярных орбиталях между атомами углерода (термическая стойкость этилена выше, чем этана);
– высокая реакционная способность -связи, что объясняется большей подвижностью электронов вне плоскости молекулы;
– повышенная электронная плотность по сравнению с одинарной связью, причем на периферии молекулы. Это приводит к тому, что к двойной связи притягиваются положительно заряженные ионы или полярные молекулы своим положительным полюсом.
Номенклатура олефинов. Этиленовые углеводороды называют по тривиальной номенклатуре, добавляя, как указывалось ранее, к названию радикала соответствующего углеводорода окончание «ен» (этилен, пропилен).
При использовании систематической номенклатуры (алгоритм):
1. Выбирается главная цепь, которая обязательно должна включать двойную связь, что обозначается тем же суффиксом «ен».
2. В названии допустимо указывать положение двойной связи как перед (1-бутен), так и после суффикса (бутен-1). Однако в последние годы чаще используется первый вариант; считается, что так удобнее склонять названия.
3. Нумерация цепи начинается с того конца, к которому ближе двойная связь.

Изомерия олефиновых углеводородов. Для соединений этого класса возможно 2 типа структурной изомерии и пространственная геометрическая изомерия.
1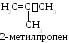 .
Изомерия строения углеродного скелета.
.
Изомерия строения углеродного скелета.
Н2С=СНСН2СН3 1-бутен
2. Изомерия по положению двойной связи.
Н2С=СНСН2СН3 1-бутен Н2ССН=СНСН3 2-бутен
3. Геометрическая изомерия.