
- •1.Классификация органических соединений. Важнейшие функциональные группы. Примеры.
- •2. Понятие о взаимном влиянии атомов в молекуле, электронные эффекты (положительные и отрицательные индуктивный и мезомерный эффекты).
- •3. Классификация органических реакций (по механизму и по конечному результату). Гомолитический и гетеролитический способы разрыва связей. Электрофильные и нуклеофильные реакции. Примеры.
- •5.Особенности многоатомных спиртов. Биологическая роль этиленгликоля и глицерина.
- •6.Химические свойства фенолов: кислотно-основные, окислительно-восстановительные.
- •7. Карбонильные соединения: альдегиды, кетоны. Строение, классификация. Примеры.
- •8.Тип гибридизации атомных орбиталей карбонильного атома углерода. Распределение электронной плотности в молекулах. Реакционные центры альдегидов и кетонов: электрофильный, основный, сн-кислотный.
- •10.Взаимодействие альдегидов а) со спиртами (образование ацеталей и полуацеталей); б) с водой; в) с аммиаком, аминами (образование иминов-оснований Шиффа); г) с циановодородной кислотой.
- •11. Окислительно-восстановительные свойства альдегидов и кетонов: реакции альдольной и кротоновой конденсации, окисление альдегидов, кетонов, биологическое окисление.
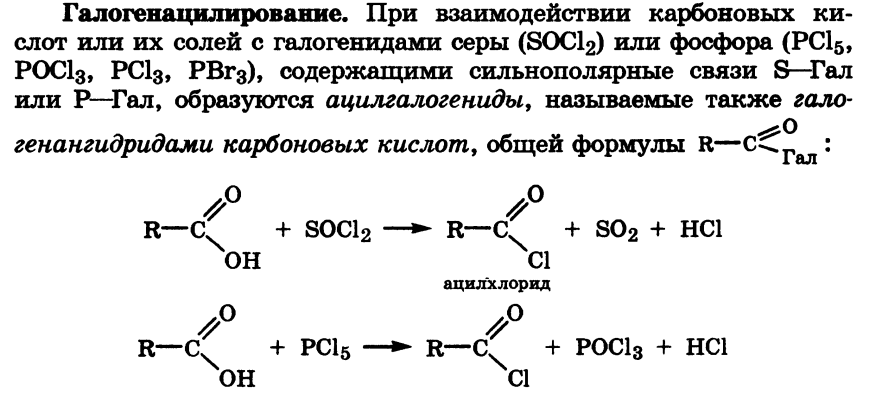
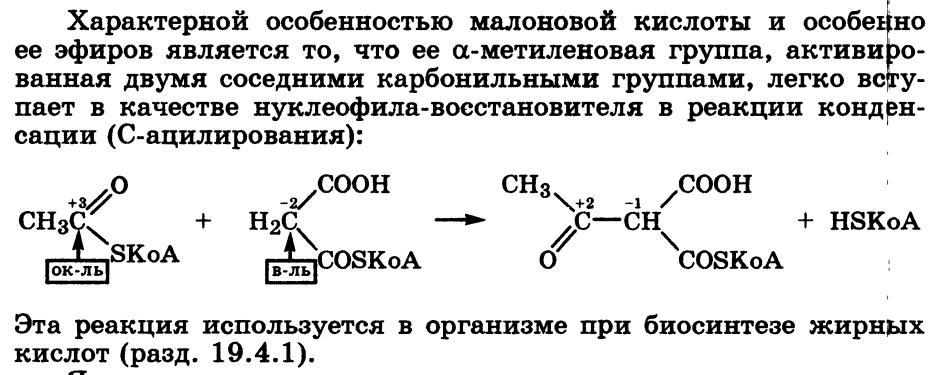
- •14.Образование сложных эфиров, тиоэфиров, амидов, ангидридов, галогенгидридов карбоновых кислот. Ацетилкофермент а in vivo как переносчик ацильных групп на нуклеофильные субстраты.
- •16.Гетерофункциональные органические соединения (кетокислоты, гидроксикислоты, аминокислоты, аминофенолы, аминоспирты. Привести примеры.
- •17. Α-Аминокислоты. Строение, классификация α-Аминокислот по природе радикала: алифатические, ароматические, гетероциклические. Заменимые и незаменимые α-Аминокислоты. Привести примеры.
- •18. Свойства α-Аминокислот. Кислотно-основные свойства. Понятие об изоэлектрической точке (рI).
- •21. Липиды как сложная по составу группа органических веществ. Классификация липидов: химическая и функциональная. Биологическая роль липидов.
- •22. Высшие жирные кислоты (вжк): строение, конфигурация двойных связей, биологическая роль.
- •23. Омыляемые простые липиды: а) воски (спермацет, пчелиный воск); б) жиры, масла. Триаглицерины: общая структура, твердые, жидкие. Примеры. Свойства липидов: гидролиз, реакция
- •24. Омыляемые сложные липиды. Фосфолипиды, классификация. Фосфатидные кислоты. Фосфатидилэтаноламин, фосфатидилхолин, фосфатидилсерины, фосфатидилинозиты, плазмагены.
14.Образование сложных эфиров, тиоэфиров, амидов, ангидридов, галогенгидридов карбоновых кислот. Ацетилкофермент а in vivo как переносчик ацильных групп на нуклеофильные субстраты.

Образование амидов. При действии на карбоновые кислоты аммиака (газообразного или в растворе) непосредственно замещения группы ОН не происходит, а образуется аммониевая соль. Лишь при значительном нагревании сухие аммониевые соли теряют воду и превращаются в амиды
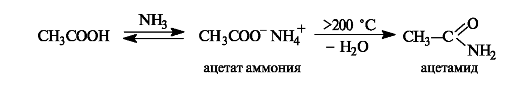
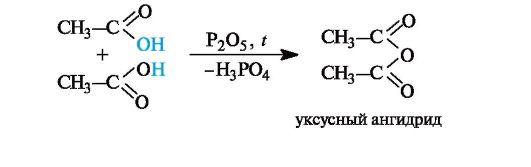
Образование ангидридов кислот. Нагревание карбоновых кислот с оксидом фосфора(V) приводит к образованию ангидридов кислот
Образование тиоэфиров. конденсация карбоновых кислот в присутствии водоотнимающих реагентов[2] (например, N,N'-дициклогексилкарбодиимида[3] (DCC, ДЦК):
RSH + R’CO2H → RSC(O)R' + H2O
При
всей сложности строения молекулы
ацетилкофермента А с позиций химического
подхода можно определить, что этот
кофермент функционирует как тиоэфир.
В качестве тиола, участвующего в его образовании, выступает кофермент А (сокращенно обозначаемый CoASH), молекула которого построена из остатков трех компонентов - 2-аминоэтантиола, пантотеновой кислоты и аденозиндифосфата (дополнительно фосфорилированного по положению 3 в рибозном фрагменте). Аденозиндифосфат (АДФ) рассмотрен в дальнейшем как представитель другой важной группы коферментов - нуклеозидполифосфатов (см. 14.3.1). Пантотеновая кислота образует, с одной стороны, амидную связь с 2-аминоэтанти- олом, а с другой - сложноэфирную связь с остатком АДФ.
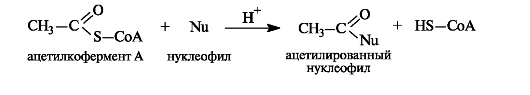
Ацетилкофермент А in vivo является переносчиком ацетильных групп на нуклеофильные субстраты.
15. Двухосновные карбоновые кислоты: щавелевая, малоновая, янтарная, глутаровая, фумаровая. Оксалаты. Декарбоксилирование щавелевой и малоновой кислот. Превращение янтарной кислоты в фумаровую. Биологическое значение.

|
Название кислоты |
Формула |
Название аниона или основы сложного эфира |
|
Щавелевая (этандиовая) Малоновая (пропандиовая) Янтарная (бутандиовая) Глутаровая (пентандиовая) |
НООС-СООН НООССН2СООН НООС(СН2)2СООН НООС(СН2)3СООН |
Оксалат Малонат Сукцинат Глутарат |
Щавелевая кислота - простейшая двухосновная кислота. Некоторые ее соли, например оксалат кальция, трудно растворимы и часто образуют камни в почках и мочевом пузыре (оксалатные камни).
Янтарная кислота в заметном количестве была обнаружена в янтаре, откуда получила название сама кислота и ее производные сукцинаты (от лат. succinium - янтарь).
Малеиновая и фумаровая кислоты - представители ненасыщенных дикарбоновых кислот с одной двойной связью. Фумаровая кислота участвует в обменных процессах, протекающих в организме.
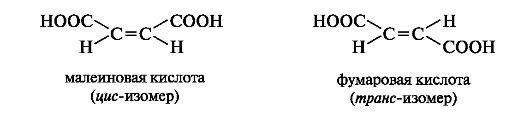
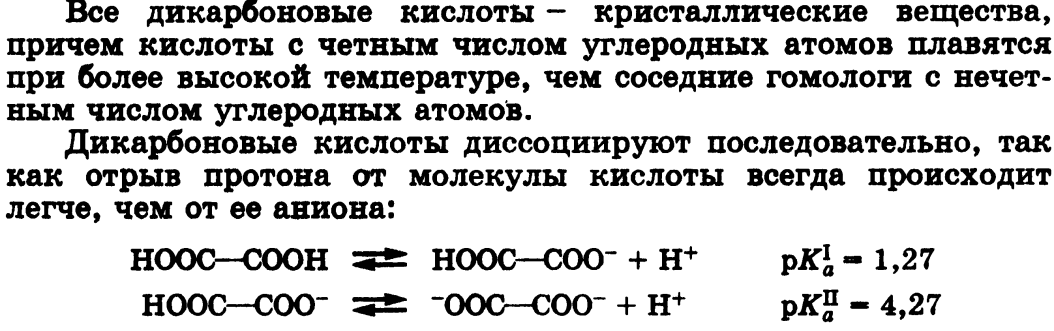
Кислотные свойства. С накоплением кислотных групп увеличиваются кислотные свойства соединений. Кислотность дикарбоновых кислот больше, чем монокарбоновых. Так, щавелевая кислота (pKa 1,23) значительно сильнее уксусной (pKa 4,76), что связано с -/- эффектом группы СООН, и благодаря этому более полной делокализации отрицательного заряда в сопряженном основании.

Влияние заместителя наиболее отчетливо проявляется при его близком расположении к кислотному центру.
Декарбоксилирование. При нагревании с серной кислотой щавелевая кислота декарбоксилируется, а образовавшаяся муравьиная кислота разлагается далее.
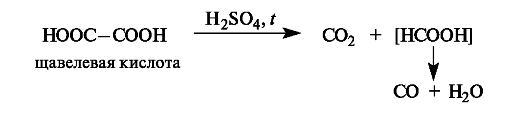
Малоновая кислота легко декарбоксилируется при нагревании выше 100 ?С
![]()
Малеиновая и фумаровая кислоты проявляют сходные химические свойства: вступают в реакции, свойственные соединениям с двойной связью (обесцвечивание бромной воды, водного раствора перманганата калия) и соединениям с карбоксильными группами (образуют два ряда производных - кислые и средние соли, эфиры и т. п.). Однако только одна из кислот, а именно малеиновая, в относительно мягких условиях претерпевает внутримолекулярную циклизацию с образованием циклического ангидрида. В фумаровой кислоте вследствие удаленности карбоксильных групп друг от друга в пространстве образование циклического ангидрида невозможно.
Окисление янтарной кислоты in vivo. Дегидрирование (окисление) янтарной кислоты в фумаровую, катализируемое в организме ферментом, осуществляется с участием кофермента ФАД . Реакция протекает стереоспецифично с образованием фумаровой кислоты (в ионной форме - фумарат).
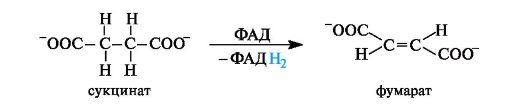
Сукцинатдегидрогеназа ( КФ 1.3.99.2) катализирует превращение янтарной кислоты в фумаровую. Кофактором фермента является ФАД. Фермент прочно связан с внутренней мембраной митохондрий.
Малоновая кислота в малых концентрациях ( 0 01 М) является высокоспецифичным ингибитором одной из стадий постулированной схемы реакций, а именно стадии превращения янтарной кислоты в фумаровую. Введение малоновой кислоты в дышащую дыхательную систему приводит к уничтожению отмеченного каталитического эффекта и накоплению янтарной кислоты
