
лабораторная работа / 10 Электрохимическая коррозия металлов
..doc
Лабораторная работа №10. Электрохимическая коррозия металлов.
Цель работы: Изучение причин, вызывающих коррозию, и выработка умения оценивать коррозийную устойчивость различных металлов и сплавов.
Ход работы:
Опыт №1. Реакция открытия иона двухвалентного железа.
К разбавленному раствору
![]() прилил несколько капель ферроцианида
калия и раствор посинел.
прилил несколько капель ферроцианида
калия и раствор посинел.
![]() (синий осадок)
(синий осадок)
Опыт №2. Образование гальванического элемента при контакте металлов.
Нейтральная среда.
А) В две пробирки налил нейтральный
раствор соли (![]() )
и прибавил несколько капель раствора
)
и прибавил несколько капель раствора
![]() .
В одну пробирку опустил укреплённый на
железной скрепке кусочек цинка, а в
другую пробирку – тоже укреплённый на
скрепке кусочек меди.
.
В одну пробирку опустил укреплённый на
железной скрепке кусочек цинка, а в
другую пробирку – тоже укреплённый на
скрепке кусочек меди.
|
|
Анод:
|
|
|
Анод:
|
Во втором случае около анода будут
появляться ионы
![]() ,
а значит, будет идти реакция из первого
опыта, и это место будет окрашиваться
в синий цвет.
,
а значит, будет идти реакция из первого
опыта, и это место будет окрашиваться
в синий цвет.
Б) В стакан налил нейтральный раствор
соли (![]() )
и прибавил несколько капель фенолфталеина.
Поместил в стакан алюминиевую и медную
проволочки.
)
и прибавил несколько капель фенолфталеина.
Поместил в стакан алюминиевую и медную
проволочки.
|
|
Анод:
У катода образуются
ионы
|
В) Стальную пластину с тщательно очищенной
поверхностью соединил с угольной
палочкой медной проволокой и погрузил
в коррозийный раствор, содержащий хлорид
натрия,
![]() ,
фенолфталеин, желатин. Наблюдал появление
окрашивания у обоих электродов.
,
фенолфталеин, желатин. Наблюдал появление
окрашивания у обоих электродов.
?????????????????
Кислая среда.
Г) До половины стакана налил 0.01 Н
![]() и погрузил раздельно проволочки алюминия
и меди. Выделение водорода на меди не
происходит. Затем соединил обе проволоки
и наблюдал выделение водорода на меди
и на алюминии.
и погрузил раздельно проволочки алюминия
и меди. Выделение водорода на меди не
происходит. Затем соединил обе проволоки
и наблюдал выделение водорода на меди
и на алюминии.
До соединения:
![]()
![]() реакция идёт и водород выделяется на
алюминии.
реакция идёт и водород выделяется на
алюминии.
![]()
![]() реакция не идёт и водород не выделяется
на меди.
реакция не идёт и водород не выделяется
на меди.
После соединения:
|
|
Анод:
У катода, т.е. у меди образуется водород. |
Д) В пробирку с раствором сульфата меди опустил кусочек цинка. Через 5 минут слил раствор и промыл омеднённый цинк водой.
![]()
В две пробирки налил разбавленной соляной кислоты. В первую опустил кусочек омеднённого цинка, во вторую – кусочек чистого цинка.
Во второй пробирке шла реакция:
![]() .
.
Во второй пробирке (кроме этой реакции)
работал гальванический элемент
(аналогично пункту А, только в кислой
среде на катоде
![]() ),
а значит и водороду выделялось больше.
),
а значит и водороду выделялось больше.
Опыт №3. Образование гальванического элемента при неодинаковой холодной механической обработке.
Сделал напильником на железном гвозде царапину, поместил его керамическую лодочку, залил раствором из пункта В.
Окраска появляется в месте, где мы сделали надпил (синяя окраска), ?????????????????
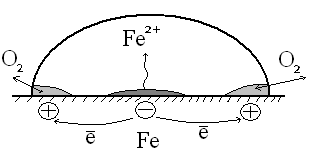
Опыт №4. Образование гальванического элемента при неодинаковой аэрации.
На зачищенную железную пластинку нанёс каплю диаметром 1 см нейтрального раствора соли, к которому предварительно были прибавлены красная кровяная соль и фенолфталеин.
По краям капли столб жидкости ниже и
кислороду проще проникать к поверхности
металла
![]() появление защитной плёнки оксида железа
появление защитной плёнки оксида железа![]() здесь коррозия идёт хуже, чем в центре.
По краям идут реакции
здесь коррозия идёт хуже, чем в центре.
По краям идут реакции
![]()
![]() малиновая окраска фенолфталеина. Анод
– в центре, а катод – по бокам
малиновая окраска фенолфталеина. Анод
– в центре, а катод – по бокам
![]() выделение
в центре
выделение
в центре
![]()
![]() посинение
раствора в центре по реакции из первого
опыта.
посинение
раствора в центре по реакции из первого
опыта.
Выводы=Контрольные вопросы:
-
В воде обычно содержится растворённый кислород, способный к восстановлению:
 ,
кроме того в воде присутствуют ионы
водорода, также способные к восстановлению:
,
кроме того в воде присутствуют ионы
водорода, также способные к восстановлению:
 .
Растворённый кислород и ионы водорода
– важнейшие окислители, вызывающие
электрохимическую коррозию металлов.
.
Растворённый кислород и ионы водорода
– важнейшие окислители, вызывающие
электрохимическую коррозию металлов.
-
-
-
-
-
-
Применение химически стойких сплавов,




