
лабораторная работа / 6 Реакции в растворах электролитов
..docЛабораторная работа №6. Реакции в растворах электролитов.
Цель работы: Выяснить при каких условиях реакции ионного обмена идут до конца.
Ход работы:
Опыт №1. Слабые и сильные электролиты.
В первую пробирку я налил 2 капли раствора NaOH (2Н). Во вторую и третью – 5 капель раствора H2SO4 (2Н). Потом в первую я добавил 8 капель H2O и 2 капли фенолфталеина. Раствор приобрёл розовый цвет – щелочная среда. Затем я добавлял в первую пробирку кристаллы NH4Cl до исчезновения окраски.
![]()
![]() (слабый
электролит:
(слабый
электролит:
![]() )
)
Раствор
терял розовую окраску т.к. в результате
реакции образовывался слабый электролит
![]() ,
т.е. уменьшалось количество гидроксид-ионов
,
т.е. уменьшалось количество гидроксид-ионов
![]() в растворе, следовательно, среда
переходила в нейтральную.
в растворе, следовательно, среда
переходила в нейтральную.
Во вторую и третью я налил 2 капли лакмуса и наблюдал покраснение содержимого – кислая среда. Затем во вторую пробирку я добавил кристаллы CH3COONa (раствор чуть-чуть потемнел).
![]()
![]() (слабый электролит:
(слабый электролит:
![]() )
)
Раствор
темнел т.к. в результате реакции
образовывался слабый электролит
![]() ,
т.е. уменьшалось количество катионов
водорода
,
т.е. уменьшалось количество катионов
водорода
![]() в растворе, следовательно, среда
переходила в нейтральную.
в растворе, следовательно, среда
переходила в нейтральную.
А в третью я добавил кристаллы NaCl (цвет не изменился).
![]()
Цвет раствора не изменился, т.к. количество катионов водорода в растворе не изменилось (все вещества в этой реакции являются сильными электролитами). Среда осталась кислой.
Опыт №2. Условие образования осадка.
В две пробирки я внёс по 5 капель раствора BaCl2. В первую пробирку я добавил 5 капель Na2CO3, после чего наблюдал выпадение белого осадка.
![]()
![]() (нерастворимое
в воде вещество – осадок)
(нерастворимое
в воде вещество – осадок)
Условие
образования осадка: произведение
концентраций ионов малорастворимого
сильного электролита должно быть больше
произведения концентраций ионов этого
электролита в его насыщенном растворе
или
![]() (
(![]() ).
).
Во вторую я пропустил из аппарата Киппа углекислый газ, но осадка не наблюдал.
![]() реакция
не идёт, т.к.
реакция
не идёт, т.к.
![]() не вытеснит
не вытеснит
![]() из соли.
из соли.
Опыт №3. Переосаждение малорастворимых веществ.
В
пробирку внёс 2 капли
![]() и прибавил 3 капли раствора
и прибавил 3 капли раствора
![]() .
Наблюдал образование белого осадка.
.
Наблюдал образование белого осадка.
![]()
![]() (нерастворимое
в воде вещество – осадок)
(нерастворимое
в воде вещество – осадок)
К
осадку добавил 3 капли
![]() и получил жёлтый осадок, который быстро
перешёл в белый.
и получил жёлтый осадок, который быстро
перешёл в белый.
![]()
Равновесие
подобных систем смещается в сторону
образования того из веществ, которое
труднее растворимо. Так растворимость
![]() (
(![]() )
гораздо больше, чем
)
гораздо больше, чем
![]() (
(![]() ),
следовательно, равновесие смещено
вправо, т.е. в сторону образования
),
следовательно, равновесие смещено
вправо, т.е. в сторону образования
![]()
![]() получили жёлтый осадок.
получили жёлтый осадок.
Опыт №4. Условие растворения осадкаов.
Внёс
в первую пробирку один микрошпатель
![]() ,
а во вторую -
,
а во вторую -
![]() , затем добавил в обе по 7 капель воды.
После этого я добавил в первую и во
вторую пробирки по 2 капли
, затем добавил в обе по 7 капель воды.
После этого я добавил в первую и во
вторую пробирки по 2 капли
![]() ,
наблюдал образование чёрного осадка в
обеих пробирках. К полученному осадку
я добавил 5 капель соляной кислоты HCl
(2Н) (в каждую из пробирок) и наблюдал
растворение осадка в первой пробирке
и не растворение осадка во второй.
,
наблюдал образование чёрного осадка в
обеих пробирках. К полученному осадку
я добавил 5 капель соляной кислоты HCl
(2Н) (в каждую из пробирок) и наблюдал
растворение осадка в первой пробирке
и не растворение осадка во второй.
(![]() - слабый электролит:
- слабый электролит:
![]() и
и
![]() )
)
|
Первая пробирка: |
Вторая пробирка: |
|
|
|
Равновесие подобных систем (<*> и
<**>) смещается в сторону того из
веществ, при образовании которого
соответствующий ион связывается полнее
(наименьшая
концентрация). В системе <*> равновесие
смещено вправо![]() осадок
растворяется, а в <**> - влево
осадок
растворяется, а в <**> - влево![]() осадок
не растворяется. Обусловлено это тем,
что в сероводороде ионы
осадок
не растворяется. Обусловлено это тем,
что в сероводороде ионы
![]() связаны полнее, чем в
связаны полнее, чем в
![]() ,
а
,
а
![]() (
(![]() )
растворим гораздо меньше, чем
)
растворим гораздо меньше, чем
![]() (
(![]() ),
и ионы
),
и ионы
![]() связаны в
связаны в
![]() ещё полнее, чем в
ещё полнее, чем в
![]() .
.
Опыт №5. Образование комплексного катиона.
К 3 каплям сульфата меди добавлял по каплям раствор аммиака до образования осадка, затем добавлял при встряхивании избыток аммиака до полного растворения осадка и получения раствора интенсивного синего цвета.
![]()
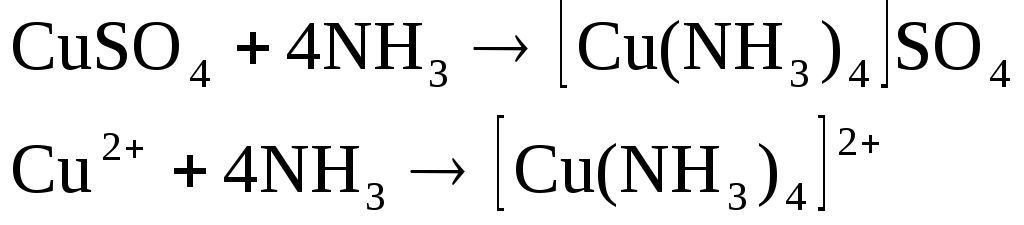
Наличие в растворе данных комплексных ионов объясняет интенсивно синюю окраску.
Наличие
в растворе простых ионов
![]() можно проверить, разлив раствор по двум
пробиркам, а затем в одну добавить щёлочь
(3 капли
можно проверить, разлив раствор по двум
пробиркам, а затем в одну добавить щёлочь
(3 капли
![]() ),
в другую – 3 капли
),
в другую – 3 капли
![]() .
.
Прибавление
щёлочи к полученному раствору не вызвало
образования осадка гидроксида меди
![]()
![]() в данном растворе так мало ионов
в данном растворе так мало ионов
![]() ,
что даже при большом количестве ионов
,
что даже при большом количестве ионов
![]() не достигается произведение растворимости
не достигается произведение растворимости
![]() .
.
Прибавление
к полученному раствору
![]() сразу вызвало образование осадка
сульфата бария
сразу вызвало образование осадка
сульфата бария
![]()
![]() в данном растворе довольно много ионов
в данном растворе довольно много ионов
![]() .
.
![]()
![]()
Опыт №6. Образование комплексного аниона.
К 3
каплям
![]() добавил 2 капли
добавил 2 капли
![]() ,
наблюдал выпадение осадка. При
перемешивании добавил избыток раствора
,
наблюдал выпадение осадка. При
перемешивании добавил избыток раствора
![]() до полного растворения осадка.
до полного растворения осадка.

![]() равновесие
смещено в сторону наименьшей концентрации
простых ионов
равновесие
смещено в сторону наименьшей концентрации
простых ионов
![]() и
и
![]() ,
т.е. в сторону растворения осадка и
образования комплексной соли.
,
т.е. в сторону растворения осадка и
образования комплексной соли.
Опыт №7. Разрушение комплекса.
К полученному в опыте №6 комплексному соединению добавил 3 капли сульфида натрия. Наблюдал выпадение осадка.

Равновесие
смещено в направлении разрушения
комплексного иона
![]() за счёт образования малорастворимого
сульфида ртути
за счёт образования малорастворимого
сульфида ртути
![]() (
(![]() ).
).
Основные результаты: Я на опыте проверил, когда ионные реакции протекают до конца, и провёл опыт с образованием и разрушением комплексного соединения.
Выводы: Реакции ионного обмена протекают до конца только в трёх случаях: если в результате образуется осадок, если выделяется газ, если образуется слабый электролит (малодиссоциирующее вещество). При отсутствии ионов, которые, связываясь между собой, образуют осадок, газ или слабый электролит, реакция является обратимой.
