
лабораторная работа / Гальв.покрыт. мет
.doc
ГУАП
кафедра№62
Рейтинг за работу
Преподаватель: Кораблёва А.А.
ОТЧЁТ
О ЛАБОЛАТОРНОЙ РАБОТЕ
ПО КУРСУ: ОБЩАЯ ХИМИЯ
”ГАЛЬВАНИЧЕСКИЕ ПОКРЫТИЯ МЕТАЛЛОВ”
ОФ 62 2007 07 ЛР
Работу выполнил
студент группы 2221 Юдакин Д.Е.
Санкт-Петербург
2002
1.Цель работы:
ознакомление c процессами на электродах при практическом использовании электролиза.
2.Приборы и реактивы:
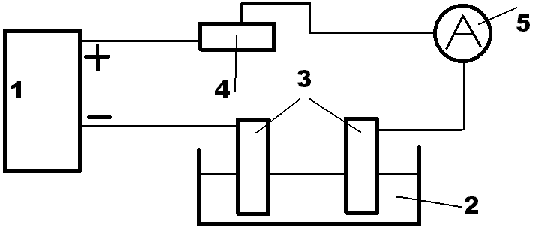
Схема установки для электрохимического никелирования.
1- блок питания;
2- электролитическая ванна;
3- электроды;
4- регулятор сопротивления;
5- измеритель.
Электролитическая ванна в качестве компонентов содержит соли никеля NiSO4
и NiCl2. Для поддержания на заданном уровне кислотности электролита добавляют H3PO4, CH3 COOH и др. Добавка окислителей Н2О2, NaNO3 способствует окислению образующегося на катоде водорода и предотвращает выделение его в виде пузырьков на катоде. В качестве анода используется никель.
3.Ход работы:
1.Измерить площадь поверхности медного электрода (рабочую поверхность руками не трогать: электроды обезжирены в щелочном растворе, протравлены в кислоте, обработаны спиртом).
2.Вычислить необходимую силу тока по формуле =iк·S, где I- сила тока (1А/дм2); S- поверхность (удвоенная площадь) электрода, дм2.
3.Рассчитать массу подлежащего осаждению металла по формуле m=a·S·ρ, где a- толщина покрытия, дм; (задаётся преподавателем); S- поверхность электрода, дм2; ρ- плотность никеля (8900г/дм3).
4.Расчитать время процесса никелирования, исходя из закона Фарадея m=k·I·t, где m- масса осаждаемого металла; k- электрохимический эквивалент, г/А·ч, для никеля 1,095 г/А·ч; I- рассчитанная сила тока; t- рассчитанное время, ч.
5.Определить на аналитических весах массу медного электрода m1, г.
6.Закрепить электрод в катодной (-) клетке крышки электролизёра.
7.Включить источник постоянного тока, при помощи регулятора установить рассчитанную силу тока (500 делений прибора соответствует силе тока 1А), отметить время начала электролиза и продолжить процесс в течение рассчитанного времени.
8.По окончании процесса никелирования с помощью регулятора выключить зарядный ток, а затем выключить источник постоянного тока.
9.Вынуть электрод из ванны, промыть проточной водой, высушить сначала фильтрованной бумагой, затем в течение 3-5 минут в сушильном шкафу.
10.Определить массу электрода m2,г.
11.Записать результаты опыта в таблицу.
4.Обработка результатов:
1.Определить массу осаждаемого никеля mопыт= m2- m1.
2.Сравнить массу никеля, полученную опытным путём, с массой никеля найденной по расчёту, и вычислить относительную ошибку: ε=|mтеор-mопыт|·100%/ mтеор
3.Написать реакции, происходящие на электродах.
4.На основании экспериментальных данных определить химический эквивалент никеля (ЭNi). mтеор
Экспериментальные данные электрохимического никелирования
|
Поверх- ность образца S, дм2
|
Сила Тока I, А |
Рассчи- танная масса никеля mтеор, г
|
Время нике- лиро вания t, мин |
Масса медного элект- рода m1, г |
Масса элект- рода после опыта m2, г |
Опытная масса пикеля mопыт, г |
Ошибка, %
|
|
0.39 |
0.39 |
0.069 |
9.8 |
16.5404 |
16.6589 |
0.0685 |
0.72 |
Реакции происходящие на электродах:
Анод: 2Н2О-4е → О2 + 4Н+
Ni0-2е → Ni2+
Катод: Ni2++2е → Ni0
2Н++2е → Н2↑
Химический эквивалент никеля:
ЭNi=58.7г
5.Вывод:
При сравнении массы никеля, полученной опытным путём, с массой никеля, найденной по расчёту, относительная ошибка (ε) составляет 0.72%. Это
говорит о том, что время никелирования и сила тока при котором протекал эксперимент, были рассчитаны верно.
