
лабораторная работа / 8 Окислительно-восстановительные реакции
..docЛабораторная работа №8. Окислительно-восстановительные реакции.
Цель работы: Изучение основных закономерностей окислительно-восстановительных процессов.
Ход работы:
-
Важнейшие окислители.
Окислительные свойства галогенов.
Опыт №1. Взаимодействие хлора с сульфидом натрия.
К 6 каплям хлорной воды добавил 4 капли раствора сульфида натрия. Добавил в пробирку 2 капли разбавленной соляной кислоты. Наблюдал помутнение раствора.

|
1 |
|
|
2 |
|
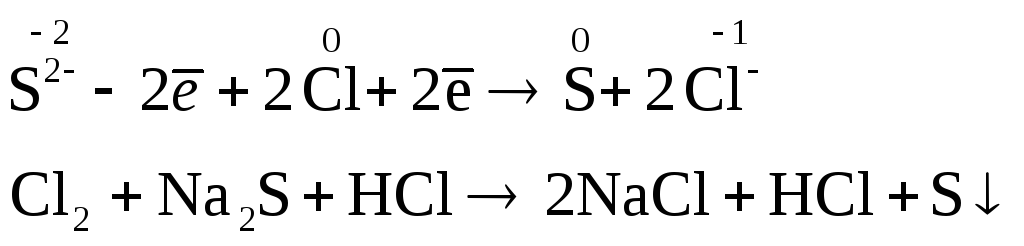
Потемнение раствора происходит вследствие появления осадка свободной серы.
Аналогично:

Окислительные свойства соединений, содержащих элементы в высших степенях окисления.
Опыт №2. Взаимодействие перманганата калия с сульфитом натрия в кислой, нейтральной и щелочной средах.
В три
пробирки внёс по 3 капли раствора
перманганата калия. В первую пробирку
добавил 2 капли 2Н раствора серной
кислоты, во вторую – 2 капли воды, в
третью – 2 капли раствора щёлочи (![]() ).
Затем во все три пробирки добавил по
одному микрошпателю кристаллического
сульфита натрия.
).
Затем во все три пробирки добавил по
одному микрошпателю кристаллического
сульфита натрия.
Наблюдал:
А) В первой пробирке – обесцвечивание раствора перманганата калия.

|
2 |
|
|
|
5 |
|
|
![]()
![]()
![]()
![]()
![]() реакция идёт.
реакция идёт.
Раствор перманганата калия обесцвечивался вследствие его восстановления до соли двухвалентного марганца.
Б) Во второй пробирке – выделение бурого осадка.
![]()
![]()
|
2 |
|
|
|
3 |
|
|
![]()
![]()
![]()
![]()
![]() реакция идёт.
реакция идёт.
Во второй пробирке происходило выделение бурого осадка диоксида магния.
В) В третьей пробирке – изменение окраски раствора в зелёный цвет.
![]()
![]()
|
2 |
|
|
|
1 |
|
|
![]()
![]()
![]()
![]()
![]() реакция идёт.
реакция идёт.
Цвет изменялся вследствие образования манганата натрия.
Восстановление перманганата калия существенно зависит от реакции среды:
В кислой среде он восстанавливается до солей двухвалентного марганца.
В нейтральной среде – до диоксида марганца.
В щелочной среде – до солей марганцевой кислоты.
В
нейтральной среде наиболее сильно
проявляются окислительные свойства
перманганата, т.к.
![]() данной реакции – самое большое.
данной реакции – самое большое.
Опыт №3. Взаимодействие дихромата калия с сульфитом натрия.
К 8
каплям хромовой смеси (![]() )
добавил 3 капли сульфита натрия.
)
добавил 3 капли сульфита натрия.
Наблюдал изменение окраски оранжевого раствора дихромата калия в зелёный цвет.
![]()
![]()
|
1 |
|
|
|
3 |
|
|
![]()
![]()
![]()
![]()
![]() реакция идёт.
реакция идёт.
Окраска изменялась вследствие восстановления дихромата калия до солей трёхвалентного хрома.
-
Важнейшие восстановители.
Восстановительные свойства металлов.
Опыт №4. Взаимодействие цинка с раствором сульфата меди.
В пробирку с 12 каплями сульфата меди опустил кусочек цинка. Наблюдал выделение меди.
![]()
|
1 |
|
|
|
1 |
|
|
![]() В.
В.
Восстановительные свойства соединений, содержащих элементы в низших степенях окисления.
Опыт №5. Взаимодействие аммиака с бромом.
В пробирку с 4 каплями бромной воды добавил 3 капли раствора аммиака. Наблюдал изменение окраски раствора с жёлтой на бесцветную.
![]()
|
3 |
|
|
|
1 |
|
|
![]()
Опыт №6. Взаимодействие сульфида натрия с азотной кислотой.
Внёс в пробирку 4 капли азотной кислоты (2Н) и 3 капли сульфида натрия. Наблюдал помутнение раствора.
![]()
|
1 |
|
|
|
1 |
|
|
![]()
Помутнение раствора произошло вследствие появления свободной серы.
-
Окислительно-восстановительная двойственность соединений, содержащих элементы в промежуточных степенях окисления.
Опыт №7. Восстановительные
свойства
![]() и иона
и иона
![]() .
.
В пробирку с 6 каплями бромной воды добавлял по каплям раствор сульфита натрия до полного обесцвечивания брома.
![]()
|
1 |
|
|
|
1 |
|
|
![]()
Опыт №8. Окислительные
свойства
![]() и
и
![]() .
.
К 6 каплям раствора сернистой кислоты прилил 6 капель раствора сульфида натрия. Наблюдал появление белой мути.
![]()
|
2 |
|
|
|
1 |
|
|
![]()
![]()
![]()
-
Направленность окислительно-восстановительных реакций.
Опыт №9. Взаимодействие трихлорида железа с йодидом калия.
К 5
каплям трихлорида железа добавлял по
каплям раствор йодида калия. Наблюдал
выделение свободного йода. Для
доказательства наличия в растворе ионов
![]() добавил в пробирку несколько капель
раствора
добавил в пробирку несколько капель
раствора
![]() ,
наблюдал появление синего осадка.
,
наблюдал появление синего осадка.
![]()
|
2 |
|
|
|
1 |
|
|
![]()
![]()
проверка
наличия в растворе ионов
![]() :
:
![]() (синий осадок)
(синий осадок)
Опыт №10. Взаимодействие дихлорида олова с бромом.
К 4 каплям бромной воды добавлял по каплям раствор дихлорида олова до полного обесцвечивания бромной воды.
![]()
|
1 |
|
|
|
1 |
|
|
![]()
![]()
Основные результаты: на опыте были изучены закономерностей окислительно-восстановительных процессов.
Выводы=Контрольные вопросы:
-
Окислители:

Восстановители:
![]()
-
Только окислителями могут быть вещества, в состав которых входит элемент с максимальной степенью окисления (также только окислителями могут быть галогены).
-
Только восстановителями могут быть вещества, в состав которых входит элемент с минимальной степенью окисления (для металлов она – 0).
-
Количественной характеристикой направленности химической реакции является ЭДС этой реакции. Если ЭДС положительная, то реакция протекает самопроизвольно в прямом направлении, если – отрицательная, то в обратном.
