
лабораторная работа / 3 Изучение скорости гомогенной химической реакции
.docЛабораторная работа №3. Изучение скорости гомогенной химической реакции.
Цель работы: Экспериментальное определение скорости гомогенной химической реакции и изучении влияния на неё концентрации реагирующих веществ и температуры.
Теория:
Скорость химической реакции – это отношение изменения концентрации, или доли реагента, или продукта химической реакции к интервалу времени, в течении которого произошло это изменение.
Скорость химической реакции определяется (измеряется) изменением концентрации реагирующих веществ в единицу времени.
![]() ,
где
,
где
![]() и
и
![]() - начальная (время
- начальная (время
![]() )
и конечная (время
)
и конечная (время
![]() )
концентрации реагирующего вещества.
)
концентрации реагирующего вещества.
Закон действующих масс: Скорость
элементарной химической реакции при
данной температуре прямо пропорциональна
произведению концентраций реагирующих
веществ в степенях с показателями,
равными стехиометрическим коэффициентам
в уравнении реакции. Для реакции
![]()
![]() ,
где
,
где
![]() и
и
![]() -
концентрации веществ А и В, k
– константа скорости реакции.
-
концентрации веществ А и В, k
– константа скорости реакции.
При повышении температуры на 100С скорость большинства химических реакций возрастает в 2-4 раза (правило Вант-Гоффа).
![]() ,
где
,
где
![]() и
и
![]() - скорости реакций, при начальной (t1)
и конечной (t2)
температуре. -
коэффициент скорости реакции, показывающий,
во сколько раз увеличится скорость
реакции при повышении температуры
реагирующих веществ на 100С.
- скорости реакций, при начальной (t1)
и конечной (t2)
температуре. -
коэффициент скорости реакции, показывающий,
во сколько раз увеличится скорость
реакции при повышении температуры
реагирующих веществ на 100С.
Ход работы:
В этой лабораторной работе скорость химической реакции изучается на примере взаимодействия между растворами Na2S2O3 (тиосульфата натрия) и H2SO4 (серной кислоты).
Na2S2O3 + H2SO4 Na2SO4 + SO2 + S + H2O
Скорость этой реакции можно определить по количеству серы, выделившейся в определённом объёме раствора за единицу времени:
![]() ,
где
,
где
![]() -
некая начальная концентрация серы
(примем её равной 0).
-
некая начальная концентрация серы
(примем её равной 0).
Величину
![]() мы
фиксируем в момент визуального наблюдения
помутнения раствора. Во всех опытах
будет примерно одинаковая концентрация
серы в этот момент. Поэтому скорость
реакции с точностью до постоянного
сомножителя определяется как величина,
обратная времени, прошедшего после
сливания растворов соли и кислоты до
помутнения.
мы
фиксируем в момент визуального наблюдения
помутнения раствора. Во всех опытах
будет примерно одинаковая концентрация
серы в этот момент. Поэтому скорость
реакции с точностью до постоянного
сомножителя определяется как величина,
обратная времени, прошедшего после
сливания растворов соли и кислоты до
помутнения.
![]() ,
с-1
,
с-1
Опыт №1. Определение константы скорости химической реакции.
При некой постоянной комнатной температуре проводим определение скорости реакции для трёх различных концентраций раствора Na2S2O3 (тиосульфата натрия), концентрация серной кислоты постоянна.
В первую пробирку наливаем 4 капли Na2S2O3 и 8 капель H2O, во вторую – 8 капель Na2S2O3 и 4 капли H2O и в третью – 12 капель Na2S2O3.
Добавляем в первую пробирку 1 каплю H2SO4, через 38 секунд наблюдал помутнение содержимого пробирки. Аналогично для второй и третьей - 22,89 и 19 секунд.
Если начальную концентрацию соли в первом случае обозначить через 1 у.е., то начальная концентрация соли во второй пробирке – 2 у.е., а в третьей – 3 у.е.
З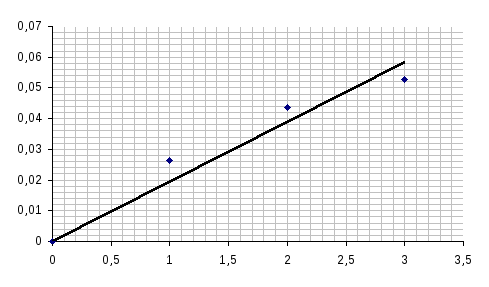
![]() ависимость
ависимость
![]() ,
t0=const
,
t0=const
![]()
![]() (Получено с помощью Excel)
(Получено с помощью Excel)
![]()
Опыт2. Влияние температуры на скорость химической реакции.
Наливаем в две пробирки по 4 капли Na2S2O3 и 8 капель H2O (берём маленькую концентрацию, потому что с увеличением температуры скорость химической реакции растёт и можно просто не успеть измерить время её протекания).
Нагреваем пробирки и термометр в стакане с водой (метод водяной бани).
Нагрев пробирки до температуры 340С добавляем 1 каплю серной кислоты в первую пробирку и измеряем время до помутнения (1=33.59 c). Затем нагреваем пробирки до 440С и повторяем измерение (2=15.24 c).
Зависимость
![]() ,
С=const
,
С=const

![]()
![]()
![]() (Получено
с помощью Excel)
(Получено
с помощью Excel)
![]()
Возьмём два близких к прямым участка:150-250 и 350-450, сосчитаем на них .
Так как участки близки к прямым, то можно
считать, что на них зависимость
![]() -
линейна, т.е.
-
линейна, т.е.

При
![]() имеем:
имеем:
![]()
Итак:
1)
![]()
2)
![]()
![]()
Основные результаты: Мною на опыте была определена скорость гомогенной химической реакции и изучено влияния на неё концентрации реагирующих веществ и температуры.
Выводы: Я убедился, что скорость химической реакции существенно зависит от таких параметров, как концентрация и температура.
