
- •5. Оксид трехвалентного элемента содержит 31,58 % кислорода. Вычислите молярную массу эквивалента, молярную и атомную массу этого элемента. Решение
- •27. Какие орбитали атома заполняются электронами раньше: 4d и 5s; 6s или 5p? Почему? Напишите электронную формулу атома элемента с порядковым номером 43. Решение
- •71. Нарисуйте энергетическую схему образования молекулы и молекулярного ионапо методу молекулярных орбиталей. Как метод мо объясняет устойчивость ионаи невозможность существования молекулы? Решение
- •113. Вычислите ,,реакции, протекающей по уравнению
- •Решение
- •134. Равновесие гомогенной системы
- •193. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) и; б)и; в)и.
- •Список литературы
5. Оксид трехвалентного элемента содержит 31,58 % кислорода. Вычислите молярную массу эквивалента, молярную и атомную массу этого элемента. Решение
![]()
![]()
Отсюда
![]()
Следовательно,
![]()
Значит искомое
вещество X
– это оксид хрома
![]() .
.
Молярная масса
эквивалента (![]() )
– это масса одного моль эквивалента.
Она равна произведению молярной массы
вещества на фактор эквивалентности:
)
– это масса одного моль эквивалента.
Она равна произведению молярной массы
вещества на фактор эквивалентности:
![]() ,
,
где
![]() ,
,
![]()
![]() г/моль.
г/моль.
Молярная масса эквивалента оксида равна сумме молярных масс эквивалентов образующих его составных частей:
![]()
![]() г/моль.
г/моль.
Ответ: оксид
хрома
![]() ,
25 г/моль, 52 г/моль и 52.
,
25 г/моль, 52 г/моль и 52.
27. Какие орбитали атома заполняются электронами раньше: 4d и 5s; 6s или 5p? Почему? Напишите электронную формулу атома элемента с порядковым номером 43. Решение
В соответствии
с принципом наименьшей энергии (правило
Клечковского) энергетическому подуровню
4d соответствует сумма
![]() ,
а 5s соответствует сумма 5 + 0 =5. Следовательно,
сначала заполнится подуровень 5s, а затем
4d. Аналогично, энергетическому подуровню
6s
соответствует сумма
,
а 5s соответствует сумма 5 + 0 =5. Следовательно,
сначала заполнится подуровень 5s, а затем
4d. Аналогично, энергетическому подуровню
6s
соответствует сумма
![]() ,
а 5p
соответствует сумма 5 + 1=6. Однако, для
6s-орбитали главное квантовое число n
равно 6, а для 5р-орбитали – 5. Следовательно,
5р-орбиталь заполняется раньше 6s-орбитали.
,
а 5p
соответствует сумма 5 + 1=6. Однако, для
6s-орбитали главное квантовое число n
равно 6, а для 5р-орбитали – 5. Следовательно,
5р-орбиталь заполняется раньше 6s-орбитали.
Элемент с порядковым номером 43 – Tc (Технеций).
Электронная формула атома Tc:
![]()
49. У какого элемента четвертого периода – хрома или селена – сильнее выражены металлические свойства? Какой из этих элементов образует газообразное соединение с водородом? Ответ мотивируйте строением атомов хрома и селена.
Решение
С позиций теории
строения атома легко объясняется
возрастание металлических свойств
элементов в каждой группе с ростом
заряда ядра атома. Сравнивая, распределение
электронов по уровням в атомах
![]()
![]() 1
1![]() и
и
![]()
![]() 2.
Внешние электроны в атоме селена
находятся дальше от ядра и поэтому
слабее удерживаются. По этой причине
атомы селена могут отдавать электроны
или, иными словами, проявлять сильнее
металлические свойства, чем хром.
2.
Внешние электроны в атоме селена
находятся дальше от ядра и поэтому
слабее удерживаются. По этой причине
атомы селена могут отдавать электроны
или, иными словами, проявлять сильнее
металлические свойства, чем хром.
С водородом хром непосредственно не взаимодействует.
Водород непосредственно
реагирует с селеном при температурах
ниже 250°; с максимальным выходом реакция
протекает при 575°. Выше этой температуры
реакция становится обратимой. Образующийся
селенистый водород
![]() представляет собой бесцветный газ,
легко воспламеняющийся, но относительно
устойчивый в сухом кислороде. Селенистый
водород обладает неприятным запахом и
чрезвычайно ядовит.
представляет собой бесцветный газ,
легко воспламеняющийся, но относительно
устойчивый в сухом кислороде. Селенистый
водород обладает неприятным запахом и
чрезвычайно ядовит.
71. Нарисуйте энергетическую схему образования молекулы и молекулярного ионапо методу молекулярных орбиталей. Как метод мо объясняет устойчивость ионаи невозможность существования молекулы? Решение
Построим энергетическую схему для этих частиц по методу МО (рис.1) и определим порядок связи (ПС)
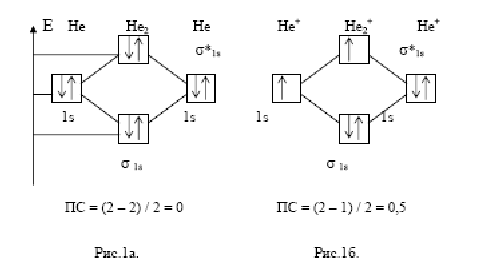
Рис.1 Энергетическая схема
образования молекулы
![]() и молекулярного иона
и молекулярного иона![]() по методу молекулярных орбиталей
по методу молекулярных орбиталей
Из рис. 1а видно,
что в молекуле
![]() число электронов
на связывающих и разрыхляющих орбиталях
одинаково (по
2), следовательно,
порядок связи здесь равен: ПС = (2–2) / 2 =
0. Энергия
молекулы не
понижается по сравнению с энергией
атомов. Таким образом, эта
молекула
существовать в нормальном состоянии
не может.
число электронов
на связывающих и разрыхляющих орбиталях
одинаково (по
2), следовательно,
порядок связи здесь равен: ПС = (2–2) / 2 =
0. Энергия
молекулы не
понижается по сравнению с энергией
атомов. Таким образом, эта
молекула
существовать в нормальном состоянии
не может.
В молекулярном же
ионе
![]() ПС = 0,5 (рис. 1б). Существование такого
иона возможно,
так как число связывающих электронов
больше числа
разрыхляющих,
и общая энергия молекулярной системы
понижается.
ПС = 0,5 (рис. 1б). Существование такого
иона возможно,
так как число связывающих электронов
больше числа
разрыхляющих,
и общая энергия молекулярной системы
понижается.
92. При сгорании газообразного аммиака образуются пары воды и оксид азота. Сколько теплоты выделится при этой реакции, если было получено 44,8 л NO в пересчете на нормальные условия? Ответ: 452,37 кДж.
Решение
![]()
Известно, что
теплота образования
![]() кДж,
кДж,![]() кДж,
кДж,![]() =
90,37 кДж
=
90,37 кДж
![]()
![]() кДж.
кДж.
Так как теплота
образования равна теплоте разложения
с обратным знаком, то
![]() =
904,74 кДж - найдено количество теплоты
при образовании 4 моль продукта (4NO).
=
904,74 кДж - найдено количество теплоты
при образовании 4 моль продукта (4NO).
1 моль продукта равен 22,4 литра, а из условия получено 44,8 литра (2 моль), поэтому нужно полученный результат разделить на 2:
![]() (44,8
литра NO) = 904,74 / 2 = 452,37 кДж.
(44,8
литра NO) = 904,74 / 2 = 452,37 кДж.
Ответ: 452,37 кДж.
