
контрольная работа / Контрольная работа 2
.docxКонтрольная работа 2
Задание 234. Реакции выражаются схемами:
K2Cr2O7 + HCl → Cl2 +CrCl3 + KCl + H2O
Au + HNO3 + HCl → AuCl3 + NO + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем; какое вещество окисляется, какое – восстанавливается.
Решение
-
K2Cr2O7 + HCl → Cl2 +CrCl3 + KCl + H2O
|
2Cr+6
+6 |
6 |
6 |
1 |
восстанавливается |
|
2
|
2 |
3 |
окисляется
|
K2Cr2O7 + 14HCl = 3Cl2 +2CrCl3 + 2KCl + 7H2O
K2Cr2O7 окислитель; HCl восстановитель
-
Au + HNO3 + HCl → AuCl3 + NO + H2O
|
N+5
+3 |
3 |
3 |
1 |
восстанавливается |
|
|
3 |
1 |
окисляется
|
Au + HNO3 + 3HCl = AuCl3 + NO + 2H2O
HNO3 окислитель; Au восстановитель
Задание 243. При какой концентрации ионов Zn2+ (в моль/ л) потенциал цинкового электрода будет на 0,015 В меньше его стандартного электродного потенциала?
Решение
Зависимость электродного потенциала от концентраций веществ,
участвующих в электродных процессах, и от температуры выражается
уравнением Нернста:

Здесь
 —
стандартный электродный потенциал; R
—
газовая
—
стандартный электродный потенциал; R
—
газовая
постоянная; Т — абсолютная температура; F — постоянная
Фарадея (96500 Кл/моль); z — число электронов, участвующих в
электродном процессе; [Ох] и [Red] — произведения концентраций
(активностей) веществ, принимающих участие в соответствующей
- полуреакции в окисленной (Ох) и восстановленной (Red) формах.
Т.к.
в нашем случае гальванический элемент
состоит из цинкового электрода электродный
процесс Zn
2+
+2
 ⇄
Zn0
подставим
значения R,F,T
и данное уравнение примет вид:
⇄
Zn0
подставим
значения R,F,T
и данное уравнение примет вид:

 =
- 0.76 B
(из таблицы)
=
- 0.76 B
(из таблицы)
 ,015В
= - 0,775 В
,015В
= - 0,775 В
Согласно данной формуле:
 =
=
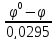 ;
;
 =
=
 = -
= - = - 0,5085
= - 0,5085
Следовательно,

 =
0,297 моль/л или
=
0,297 моль/л или
 0,30
моль/л
0,30
моль/л
Задание 268. Электролиз раствора сульфата цинка проводили в течение 5 часов, в результате чего выделилось 6 л кислорода (н.у.). составьте уравнения электродных процессов и вычислите силу тока.
Решение
ZnSO4
→ +
+

Катод:
 →
→

Анод:
2Н2О
- →
О2↑+
4Н+
→
О2↑+
4Н+
уравнение электролиза:
ZnSO4 + 2Н2О = 2Zn + О2↑ + 2Н2SO4
 =
- 0.76 B
=
- 0.76 B
Незначительно отрицательнее потенциала водородного электрода в нейтральной водной среде (—0,41 В). Поэтому на катоде будет происходить электрохимическое восстановление цинка. Окисление воды на аноде, будет сопровождаться выделением кислорода.
|
Дано: V(O2) =6л t=5ч = 18000с
|
Используя обобщенный закон Фарадея, описывающий процесс электролиза: V(O2)
= I
=
|
|
I =? |
Задание 294. Какой металл целесообразней выбрать для протекторной защиты от коррозии свинцовой оболочки кабеля: цинк, магний или хром? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии. Какой состав продуктов коррозии.
Решение
Протекторная защита – один из способов защиты металлического изделия от коррозии. К изделию, подвергающемуся электрохимической коррозии, подключают деталь-протектор из более активного металла, чем металл изделия: протектор будет разрушаться, а изделие останется неизменным. Протекторная защита металлов от коррозии достигается созданием макрогальванической пары с менее благородным металлом (обычно применяются алюминий, магний, цинк и их сплавы). Он играет роль анода и растворяется со скоростью, достаточной для создания в системе электрического тока необходимой силы (протекторная защита). Сравним потенциалы данных металлов, чем больше разница потенциалов (со свинцом), тем лучше защита. Стандартные потенциалы указанных металлов:
Свинцовая
оболочка кабеля
 = - 0.13 B
= - 0.13 B
 =
- 0.76B;
=
- 0.76B;
 = - 2.34B;
= - 2.34B;
 = -0.71B
= -0.71B
Для
защиты свинца от коррозии можно выбрать
любой из предложенных металлов, но при
этом не следует забывать, что чем металл
активнее, тем быстрее защита будет
израсходована. Поэтому выбирать из трех
следует тот металл, который по активности
стоит ближе к свинцу. Активность в данном
случае измеряется окислительно-восстановительным
потенциалом.
Следовательно, в данном
случае самый лучший вариант - цинк.
Анодная
полуреакция:
Zn0
- 2 = Zn2+
Катодная
полуреакция:
O2
+ 2H2O
+ 4
= Zn2+
Катодная
полуреакция:
O2
+ 2H2O
+ 4 = 4OH-
2Zn0
+ O2
+ 2H2O
= 2Zn(OH)2.
В
качестве продукта коррозии в данном
случае выступает гидроксид цинка Zn(OH)2
= 4OH-
2Zn0
+ O2
+ 2H2O
= 2Zn(OH)2.
В
качестве продукта коррозии в данном
случае выступает гидроксид цинка Zn(OH)2

 = 2Cr+3
= 2Cr+3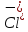 - 2
- 2
 =
=

 = N+2
= N+2 -
3
-
3
 =
=

 /моль
/моль

 =
=
 =
=
