
контрольная работа / reshenie_zadach_po_i_l_shimanovich
.docxПо сборнику И.Л. Шимановича
Задача (82)
Газообразный
этиловый спирт
 можно
получить при взаимодействии этилена
можно
получить при взаимодействии этилена
 (2)
и водяных паров. Напишите термохимическое
уравнение этой реакции, предварительно
вычислив ее тепловой эффект.
(2)
и водяных паров. Напишите термохимическое
уравнение этой реакции, предварительно
вычислив ее тепловой эффект.
Ответ: -45,76 кДж
Термохимическое уравнение реакции:
C2H4(г) + H2O(г) => C2H5OH(г) + Q
Тепловой эффект реакции, согласно закону Гесса, вычисляется по формуле:
Q = ∑Qобр.прод. – ∑Qисход.прод
Qобр. C2H4(г) = 52,28 кДж; Qобр. H2O(г)= -241,83 кДж; Qобр. C2H5OH(г) = -235,31 кДж
Отсюда термохимический эффект реакции равен :Q= -235,31 – (52,28-241,83) = -45,76 кДж
Ответ: -45,76 кДж
Задача (142)
Чему равна молярная концентрация эквивалента 30%-ого раствора NaOH плотностью 1,328 г/куб. см? К 1 л этого раствора прибавили 5 л воды. Вычислите массовую (процентную) долю полученного раствора.
Ответ: 9,96; 6,3 %
Дано: 30% раствор NaOH плотностью 1,328 г/ куб.см.
К 1 л раствора добавили 5 л воды.
Найти: молярную концентрацию эквивалента С (NaOH). Массовую долю вещества после разбавления.
Решение.
-
Молярная концентрация эквивалента вычисляется по формуле
С = n/V
Масса 1 литра раствора, согласно его плотности 1,328 г/куб.см, равна 1328 г.
Масса щелочи в растворе равна 1328 х 0,3 = 398,4 г. поскольку молярная масса М(NaOH) = 40 г/моль, то в растворе содержится n = m/M = 398,4 / 40 = 9,96 моль
Соответственно молярная концентрация эквивалента равна С= 9,96 / 1 = 9,96 моль/л.
-
При добавлении 5 л воды общая масса раствора составит 6328 г, тогда массовая доля щелочи в полученном растворе составит:
Ω = (mвещ-ва / (m вещ-ва + m раствора)) х 100% = 398,4/ 6328 х 100% = 6,29% ̴ 6,3%
Ответ: молярная концентрация эквивалента равна 9,96 моль/л; массовая доля вещества в растворе составит 6,3%
Задача (162)
Вычислите
массовую долю (%) водного раствора сахара
 ,
зная что температура кристаллизации
раствора – 0,93
,
зная что температура кристаллизации
раствора – 0,93
 .
Криоскопическая константа воды 1,86.
.
Криоскопическая константа воды 1,86.
Ответ: 14,6%
Дано: водный раствор сахара С12Н22О11. Температура кристаллизации раствора t = 0,930С, криоскопическая константа воды К=1,86.
Найти: массовую долю вещества.
Решение. Согласно формуле для расчета молекулярной массы вещества через криоскопическую константу:
М = К х1000 х g2/ g1 х t, где g1 – масса растворенного вещества; g2 – масса растворителя.
Если условно принять, что масса раствора равна 100, то тогда g2 = 100 – g1, таким образом:
М = К х1000 х (100 – g1)/ g1 х t
Mсахара = 342 г/моль
342 = 1,86 х 1000 х (100 – g1)/ 0,93 х g1
0,171 х g1 = 100 – g1
g1 = 100 / 1,171= 85,4.
Масса сахара в расчете на 100 г раствора составила m= 100 - 85,4 = 14,6 г, соответственно массовая доля составит 14,6 %.
Ответ: 14,6 %.
Задача (182)
Составьте
молекулярные и ионно-молекулярные
уравнения реакций взаимодействия в
растворах между: а)
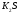 и HСl
и HСl
б)
 и
и

в)
 и
и

а) K2S + 2 HCl → H2S ↑ + 2 KCl
2 H+ + S2- → H2S ↑
б) FeSO4 + (NH4)2S → FeS ↓+ (NH4)2SO4
Fe2+ + S2- → FeS ↓
в) Cr (OH)3 +3KOH → K3 [Cr (OH)6]
Cr (OH)3 +3OH - → [Cr (OH)6]3-
Задача (232)
Реакции выражаются схемами:

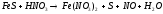
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое – восстановителем, какое вещество окисляется, какое восстанавливается.
а) NaCr+3O2 + Br20 + NaOH → Na2 Cr+6O4 + Na Br -1 + H2O


Cr+3 – 3e → Cr+6 2 - окисление
восстановитель 6
Br20 + 2e → 2Br -1 3 - восстановление
окислитель
2 NaCrO2 + 3Br2 + 8NaOH → 2Na2CrO4 + 6NaBr + 4H2O
б) FeS-2 + HN+5O3 → Fe (NO3)2 + S0 + N+2O + H2O
S-2
– 2e → S0
3 - окисление

восстановитель 6
N+5 + 3e → N+2 2 - восстановление
окислитель
3 FeS + 8 HNO3 → 3 Fe (NO3)2 + 3 S + 2 NO + 4 H2O
Задача (242)
Увеличиться,
уменьшится или останется без изменения
масса цинковой пластины при взаимодействии
её с растворами а)
 ;
б)
;
б)
 ;
в)
;
в)
 ?
Почему? Составьте электронные и
молекулярные уравнения соответствующих
реакций.
?
Почему? Составьте электронные и
молекулярные уравнения соответствующих
реакций.
Масса цинковой пластины:
А) при взаимодействии с раствором CuSO4 уменьшится:
CuSO4 + Zn → ZnSO4 + Cu
Zn
0– 2e → Zn+2
1 - окисление

восстановитель 2
Cu+2 + 2e → Cu0 1 - восстановление
окислитель
Во время реакции цинк (М = 65,39) будет уходить в раствор, а на пластине будет осаждаться более легкая медь (М=63,54), таким образом, общая масса цинковой пластины уменьшится.
Б) при взаимодействии с раствором MgSO4 масса пластины не изменится, так как цинк не может вытеснить магний из соли (магний более активный, чем цинк в окислительно-восстановительных реакциях).
В) при взаимодействии с Pb(NO3)2 масса цинковой пластины увеличится:
Pb(NO3)2 + Zn → Zn(NO3)2 + Pb
Zn 0– 2e
→ Zn+2
1 - окисление

восстановитель 2
Pb+2 + 2e → Pb0 1 - восстановление
окислитель
Во время реакции цинк (М = 65,39) будет уходить в раствор, а на пластине будет осаждаться более тяжелый свиней (М=207,2), таким образом, общая масса цинковой пластины увеличится.
Задача (282)
Медь не вытесняет водород из разбавленных кислот. Почему? Однако, если к медной пластинке опущенной в кислоту, прикоснуться цинковой то на меди начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнения протекающей химической реакции.
При прикосновении цинковой пластинкой образуется гальваническая пара - медь (катод), цинк (анод).
Электродные процессы:
Анод: Zn = Zn2+ + 2e| 1
Катод: 2H+ + 2e = H2 | 1
Уравнение электролиза: Zn + 2H+ = Zn2+ + H2↑
Задача (202)
К
раствору
 добавить следующие вещества: а) HCl;
б)
добавить следующие вещества: а) HCl;
б) ;
г) КОН; в)
;
г) КОН; в)
 .
.
В каких случаях гидролиз хлорида железа усиливается. Составте ионно-молекулярное уравнение гидролиза соответствующих солей.
Гидролиз хлорида железа в обычных условиях протекает по катиону слабого основания – железа (III):
Fe3+ + H2O ↔ (FeOH) 2+ + H+
(FeOH) 2+ + H2O ↔ (Fe(OH) 2)+ + H+
(Fe(OH) 2)+ + H2O ↔ Fe(OH)3 ↓+ H+
Гидролиз усилится в случае добавления KOH, Na2CO3, так как:
-
При добавлении щелочи в раствор соли, образованной слабым основанием и сильной кислотой, происходит нейтрализация ионов водорода, то есть равновесие реакции гидролиза смещается вправо:
Fe3+ + 3H2O ↔ Fe(OH)3 ↓+ 3H+
3H+ + 3OH- (из щелочи) = 3H2O
-
При смешивании хлорида железа (III) и карбоната натрия в растворе будет протекать реакция c элиминацией продуктов из сферы протекания реакции:
2FeCl3 + 3Na2CO3 + 3H2O = 2Fe(OH)3↓ + 6NaCl + 3CO2↑
2Fe3+ + 3CO32- + 3H2O = 2Fe(OH)3↓ + 3CO2↑
