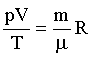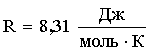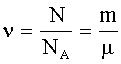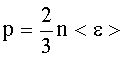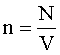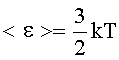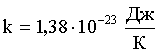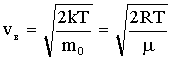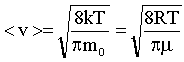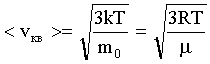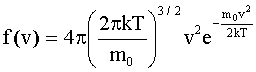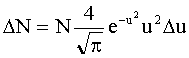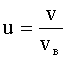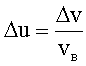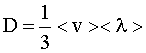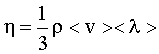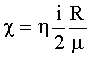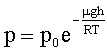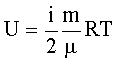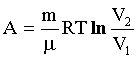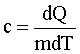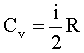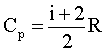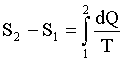- •Контрольные работы
- •И методическое руководство очно-заочной и заочной формы обучения
- •Содержание:
- •1.1. Физические основы механики
- •1.1.1. Пояснение к рабочей программе
- •1.1.2. Основные формулы
- •1.1.3. Примеры решения задач по механике
- •1.2. Электричество и магнетизм
- •1.2.1. Пояснение к рабочей программе
- •1.2.2. Основные формулы
- •1.2.3. Примеры решения задач по электричеству и магнетизму
- •1.3. Колебания. Волны
- •1.3.1. Пояснение к рабочей программе
- •1.3.2. Основные формулы
- •1.3.3. Примеры решения задач по колебаниям и волнам
- •1.4. Оптика
- •1.4.1. Пояснение к рабочей программе
- •1.4.2. Основные формулы
- •1.4.3. Примеры решения задач по оптике
- •1.5. Статистическая физика и термодинамика.
- •1.5.1. Пояснение к рабочей программе
- •1.5.2. Основные формулы
- •1.5.3. Примеры решения задач по статистической физике и термодинамике
- •1.6. Квантовая физика
- •1.6.1. Пояснение к рабочей программе
- •1.6.2. Основные формулы
- •1.6.3. Примеры решения задач по квантовой физике
1.5. Статистическая физика и термодинамика.
1.5.1. Пояснение к рабочей программе
При изучении основ статистической физики и термодинамики следует уяснить следующее. Существует два способа описания процессов, происходящих в макроскопических телах (т.е. телах, состоящих из очень большого числа частиц - атомов или молекул), - статистический и термодинамический.
Статистическая (молекулярная) физика пользуется вероятностными методами и истолковывает свойства тел, непосредственно наблюдаемых на опыте (такие, как давление и температура), как суммарный, усредненный результат действия отдельных молекул. Молекулярно-кинетическая теория позволяет раскрыть глубинный смысл экспериментальных закономерностей, например, таких как уравнение Менделеева-Клапейрона. При решении задач на эту тему основное внимание уделено таким вопросам программы, как уравнение Менделеева-Клапейрона, закон Дальтона для смеси газов (в контрольной работе это задачи 501-510), уравнение молекулярно- кинетической теории (в контрольной работе это задачи 511-520).
Следует обратить внимание на статистические законы. Распределение молекул идеального газа по скоростям описывает распределение Максвелла, а по потенциальным энергиям - распределение Больцмана. Зависимость давления от высоты для изотермической атмосферы описывается барометрической формулой. Этим вопросам посвящены задачи 521-530 контрольной работы.
При изучении явлений переноса, к которым относятся теплопроводность, диффузия и внутреннее трение, следует уяснить, что эти явления сходны между собой. В основе этого сходства лежит одинаковый молекулярный механизм перемешивания молекул в процессе их хаотического движения и столкновений друг с другом. Изучение явлений переноса посвящены задачи 531-540.
Важно усвоить, что термодинамика, в отличие от молекулярной физики, не изучает конкретные взаимодействия, происходящие с отдельными атомами или молекулами, а рассматривает взаимопревращения и связь различных видов энергии, теплоты и работы.
При изучении основ термодинамики нужно четко усвоить такие понятия как термодинамическая система, термодинамический процесс, внутренняя энергия, энтропия и т.д. Задачи контрольной работы охватывают такие важные соотношения и понятия как первое начало термодинамики, внутренняя энергия, работа при различных изопроцессах (задачи 541-550).
Задачи 551-560 посвящены изучению второго начала термодинамики, которые формулируются как закон возрастания энтропии. Этот закон определяет направление протекания термодинамических процессов.
1.5.2. Основные формулы
|
Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона) : где р - давление газа; V - его объем; Т - термодинамическая температура (по шкале Кельвина); R - газовая постоянная m - масса вещества; μ - молярная масса. |
|
|
Количество вещества: где N - число молекул; NA - число Авогадро (число молекул в 1 моле вещества). |
|
|
Закон
Дальтона для смеси газов:
где
р - давление смеси газов;
|
|
|
Основное уравнение молекулярно-кинетической теории газов: где n - концентрация молекул: |
|
|
Средняя кинетическая энергия поступательного движения молекулы: где k - постоянная Больцмана: Т - термодинамическая температура. |
|
|
Зависимость давления газа от концентрации и температуры: |
|
|
Скорость молекул наиболее вероятная: где - масса одной молекулы ; средняя арифметическая: средняя квадратичная: |
|
|
Распределение молекул газа по скоростям (распределение Максвелла): где е = 2,71... - основание натуральных логарифмов. |
|
|
Приближенная формула вычисления числа молекул, скорости которых лежат в интервале v÷v+Δv, где Δv<<v: где N - полное число молекул. |
|
|
Средняя длина свободного пробега молекулы: где d - эффективный диаметр молекулы. |
|
|
Среднее число столкновений молекулы в единицу времени: где <v> - средняя арифметическая скорость молекулы. |
|
|
Коэффициент диффузии: |
|
|
Коэффициент вязкости (внутреннего трения): где ρ - плотность. |
|
|
Коэффициент теплопроводности: |
|
|
Барометрическая формула: где р - давление газа на высоте h; p0 - давление газа на высоте h = 0. |
|
|
Внутренняя энергия идеального газа: где i - число степеней свободы (i = 3 - для одноатомного газа, i = 5 - для двухатомного газа, i = 6 - для трехатомного газа). |
|
|
Работа расширения газа при процессе: изобарном (изобарическом) (p = const): изотермическом (T=const): |
|
|
Первое начало термодинамики: где Q - количество теплоты, подводимое к системе; ΔU - изменение внутренней энергии; А - работа, совершаемая системой против внешних сил. |
|
|
Удельная теплоемкость: |
|
|
Молярная теплоемкость: молярная теплоемкость изохорная молярная теплоемкость изобарная |
|
|
Изменение энтропии при переходе из состояния 1 в состояние 2: где dQ - элементарное тепло, Т - термодинамическая температура. |
|