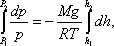- •Вопрос1 Кинематическое описание движения материальной точки
- •Вопрос2 Криволинейное движение
- •Вопрос3 Кинематика вращательного движения
- •Вопрос 4 Законы динамики Ньютона
- •Вопрос 5 Закон сохранения импульса
- •Вопрос 6 Работа, мощность.
- •Вопрос 7 Энергия
- •Вопрос 8 Момент инерции твердого тела
- •Вопрос 9 Работа и кинетическая энергия вращения
- •Вопрос 10 Основной закон динамики вращения
- •Вопрос 11 Закон сохранения момента импульса
- •Вопрос 12 Механические колебания
- •Вопрос 13 Идеальный газ
- •Вопрос 14 Распределение молекул идеального газа по скоростям хаотического теплового движения.
- •Вопрос 15 Распределение молекул в потенциальном поле сил
- •Вопрос 16 Первое начало термодинамики
- •Вопрос 17 Теплоемкость
- •Вопрос 18 Применение первого закона термодинамики к изопроцессам
- •Вопрос 19 Адиабатический процесс
- •2.3.6. Адиабатический процесс. Политропный процесс
- •Вопрос 20 Второе начало термодинамики
- •2.3.8. Энтропия, её статистическое толкование и связь с термодинамической вероятностью
- •2.3.9. Второе начало термодинамики
- •Вопрос 21 Цикл Карно для идеальной тепловой машины Тепловые двигатели и холодильные машины. Цикл Карно и его к. П. Д. Для идеального газа
- •Вопрос 22 Свойства физических зарядов
- •Вопрос 23 Напряженность электрического поля в вакууме
- •Вопрос 24 Теорема Остроградского-Гаусса для электрического поля в вакууме
- •2. Поле двух бесконечных параллельных равномерно заряженных плоскостей
- •Вопрос 25 Потенциал
- •Вопрос 26 Связь напряженности электрического поля с потенциалом
- •Вопрос 27 Проводники в электрическом поле
- •Вопрос 28 Диэлектрики в электрическом поле
- •Вопрос 29 Энергия электростатического поля
- •Вопрос 30 Постоянный электрический ток
- •Вопрос 31 Закон Ома для однородного участка цепи
- •Вопрос 32 Закон Ома для замкнутой цепи
- •Вопрос 33 Работа и мощность электрического тока
- •Вопрос 34 Магнитное поле в вакууме
- •Вопрос 35 Движение заряженных частиц в магнитном поле
- •Вопрос 36 Взаимодействие магнитного поля с током
- •Вопрос 38 Поток вектора магнитной индукции сквозь произвольную поверхность
- •Вопрос 39 Работа по перемещению проводника и контура с током в магнитном поле.
- •Вопрос 40 Электромагнитная индукция
- •Вопрос 41 Явление самоиндукции
- •Вопрос 42 Энергия магнитного поля тока
- •Вопрос 43 Закон полного тока
- •Вопрос 44 Магнитные свойства вещества
- •Вопрос 45 Магнетики в магнитном поле
- •Вопрос 46 Ферромагнетизм
- •Природа ферромагнетизма
- •Вопрос 50 Интерференция света от двух источников
- •Вопрос 51 Интерференция света в тонких пленках
- •Вопрос 52 Дифракция света
- •Вопрос 53 Дифракция при параллельных лучах Фраунгорфера
- •Вопрос 54 Поляризация света
- •Вопрос 55 Способы получения поляризованного света
- •Вопрос 56 Тепловое излучение
- •Вопрос 57 Законы теплового излучения
- •Вопрос 58 Внешний фотоэффект
- •Вопрос 59 Эффект Комптона
- •Вопрос 60 Корпускулярно – волновой дуализм
- •Вопрос 61 Волновые свойства микрочастиц
- •. (6.38)
- •Вопрос 62 Соотношение неопределенностей
- •Вопрос 63 Волновая функция.
- •Вопрос 64 Боровская теория водородоподобного атома
- •Вопрос 66 Молекула
- •Вопрос 67 Современные представления об электропроводности тел
- •Вопрос 68 Атомное ядро
Вопрос 15 Распределение молекул в потенциальном поле сил
При выводе основного уравнения молекулярно-кинетической теории газов и максвелловского распределения молекул по скоростям предполагалось, что на молекулы газа внешние силы не действуют, поэтому молекулы равномерно распределены по объему. Однако молекулы любого газа находятся в потенциальном поле тяготения Земли. Тяготение, с одной стороны, и тепловое движение молекул – с другой, приводят к некоторому стационарному состоянию газа, при котором давление газа с высотой убывает.
Выведем закон изменения давления с высотой, предполагая, что поле тяготения однородно, температура постоянна и масса всех молекул одинакова. Если атмосферное давление на высоте h равно р (рисунок 2.8), то на высоте h+dh оно равно p+dp (при dh>0 dp<0, так как давление с высотой убывает). Разность давлений р и p+dp равна весу газа, заключенного в объеме цилиндра высотой dh с основанием площадью 1м2:
|
p–(p+dp)=gdh,, |
(2.43) |
где – плотность газа на высоте h (dh настолько мало, что при изменении высоты в этом пределе плотность газа можно считать постоянной). Следовательно,
|
dp=-gdh |
(2.44) |
Воспользовавшись уравнением состояния идеального газа рV=(m/М)RТ (т – масса газа, M – молярная масса газа), находим, что
|
P = m/V = pM/(RT)., |
(2.45) |
Подставив это выражение в (2.44), получим
![]()
или
|
|
(2.46) |
С изменением высоты от h1 до h2 давление изменяется от p1 до p2 (рисунок 2.8), т. е.
|
|
(2.47) |
|
|
(2.48) |
или
|
|
(2.49) |

Рисунок 2.8
Выражение (2.49) называется барометрической формулой. Она позволяет найти атмосферное давление в зависимости от высоты или, измерив давление, найти высоту. Так как высоты обозначаются относительно уровня моря, где давление считается нормальным, то выражение (2.49) может быть записано в виде
|
|
(2.50) |
где р – давление на высоте h.
Прибор для определения высоты над земной поверхностью называется высотомером (или альтиметром). Его работа основана на использовании формулы (2.50). Из этой формулы следует, что давление с высотой убывает тем быстрее, чем тяжелее газ.
Барометрическую формулу (2.50) можно преобразовать, если воспользоваться выражением (2.19) p=nkT:
|
|
(2.51) |
где n – концентрация молекул на высоте h, n0 – то же, на высоте h=0. Так как М=m0NA (NA – постоянная Авогадро, т0 – масса одной молекулы), a R=kNA, то
|
|
(2.52) |
где m0gh= – потенциальная энергия молекулы в поле тяготения, т. е.
|
|
(2.53) |
Выражение (2.53) называется распределением Больцмана для внешнего потенциального поля. Из него следует, что при постоянной температуре плотность газа больше там, где меньше потенциальная энергия его молекул.
Если частицы имеют одинаковую массу и находятся в состоянии хаотического теплового движения, то распределение Больцмана (2.53) справедливо в любом внешнем потенциальном поле, а не только в поле сил тяжести.
Вопрос 16 Первое начало термодинамики
Рассмотрим термодинамическую систему, для которой механическая энергия не изменяется, а изменяется только ее внутренняя энергия. Внутренняя энергия системы может изменяться в результате совершения над системой работы или сообщения ей теплоты. Например, вдвигая поршень в цилиндр, в котором находится газ, мы сжимаем этот газ, в результате чего его температура повышается, т. е. тем самым увеличивается внутренняя энергия газа. С другой стороны, температуру газа и его внутреннюю энергию можно увеличить за счет сообщения ему некоторого количества теплоты – энергии, переданной системе внешними телами путем теплообмена.
Таким образом, существует две формы передачи энергии от одних тел к другим: работа и теплота. Энергия механического движения может превращаться в энергию теплового движения, и наоборот. При этих превращениях соблюдается закон сохранения и превращения энергии; применительно к термодинамическим процессам этим законом и является первое начало термодинамики, установленное в результате обобщения многовековых опытных данных.
Допустим, что некоторая система (газ, заключенный в цилиндр под поршнем), обладая внутренней энергией U1, получила некоторое количество теплоты Q и, перейдя в новое состояние, характеризующееся внутренней энергией U2, совершила работу А над внешней средой, т. е. против внешних сил. Количество теплоты считается положительным, когда оно подводится к системе, а работа – положительной, когда система совершает ее против внешних сил. Опыт показывает, что в соответствии с законом сохранения энергии при любом способе перехода системы из первого состояния во второе изменение внутренней энергии U=U2–U1 будет одинаковым и равным разности между количеством теплоты Q, полученным системой, и работой A, совершенной системой против внешних сил:
|
U = Q – A |
(2.77) |
или
|
Q = U + A. |
(2.78) |
Уравнение (2.78) выражает первое начало термодинамики: теплота, сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение ею работы против внешних сил. Выражение (2.78) в дифференциальной форме будет иметь вид
|
Q=dU+ A , |
(2.79) |
где dU – бесконечно малое изменение внутренней энергии системы, А – элементарная работа, Q – бесконечно малое количество теплоты. В этом выражении dU является полным дифференциалом, а A иQ таковыми не являются. В дальнейшем будем использовать запись первого начала термодинамики в форме (2.79).
Из формулы (2.78) следует, что в СИ количество теплоты выражается в тех же единицах, что работа и энергия, т. е. в джоулях (Дж).
Если система периодически возвращается в первоначальное состояние, то изменение ее внутренней энергии dU=0. Тогда, согласно первому началу термодинамики, A=Q, т. е. вечный двигатель первого рода – периодически действующий двигатель, который совершал бы большую работу, чем сообщенная ему извне энергия, – невозможен (одна из формулировок первого начала термодинамики).
Рассмотрим газ, находящийся под поршнем в цилиндрическом сосуде (рисунок 2.19).
Рисунок 2.19
Если газ, расширяясь, передвигает поршень на бесконечно малое расстояние dl, то производит над ним работу A=Fdl=pSdl=pdV. где S – площадь поршня, Sdl=dV – изменение объема системы. Таким образом,
|
A = pdV. |
(2.80) |
Полную работу А, совершаемую газом при изменении его объема от V1 до V2, найдем интегрированием формулы (2.80):
|
|
(2.81) |
Результат интегрирования определяется характером зависимости между давлением и объемом газа. Найденное для работы выражение (2.81) справедливо при любых изменениях объема твердых, жидких и газообразных тел.
Произведенную при том или ином процессе работу можно изобразить графически с помощью кривой в координатах р, V. Пусть изменение давления газа при его расширении изображается кривой на рисунке 2.20.
При увеличении объема на dV совершаемая газом работа равна pdV ,т.e. определяется площадью полоски с основанием dV, заштрихованной на рисунке. Поэтому полная работа, совершаемая газом при расширении от объема V1 до объема V2 определяется площадью, ограниченной осью абсцисс, кривой p=f(V) и прямыми V1 и V2.
Рисунок 2.20
Графически можно изображать только равновесные процессы – процессы, состоящие из последовательности равновесных состояний. Они протекают так, что изменение термодинамических параметров за конечный промежуток времени бесконечно мало. Все реальные процессы неравновесны, но чем медленнее процесс протекает, тем он ближе к равновесному. В дальнейшем рассматриваемые процессы будем считать равновесными.