
- •11.Закон сохранения момента импульса
- •12.Механические колебания
- •13.Идеальный газ
- •14.Распределение молекул идеального газа по скоростям хаотического теплового движения.
- •15.Распределение молекул в потенциальном поле сил
- •16.Первое начало термодинамики
- •Первое начало термодинамики
- •Работа газа при изменении его объема
- •17.Теплоемкость
- •18.Применение первого начала термодинамики к изопроцессам
- •19.Адиабатический процесс
- •20. II начало термодинамики
17.Теплоемкость
Теплоемкость газа. Молярная и удельная теплоемкость (определения и единицы измерения). Теплоемкость при постоянном объеме, температуре и давлении. Формула Майера.
Теплоемкостью какого – либо тела называется величина, равная количеству теплоты, которое нужно сообщить телу, чтобы повысить его температуру на 1К.
|
C=dIQ/dT |
Где dIQ –количество теплоты, сообщение которого повышает температуру тела на dT.
Молярная теплоемкость Cv, при постоянном V равна изменению внутренней энергии 1 моль газа при нагревании его на 1ºС.
|
Cv=dUм/dT |
Удельная теплоемкость-это теплоемкость единицы массы вещества.
|
Cp=Cv+R |
Формула Майера
Теплоемкость при постоянном объеме, температуре и давлении
При V=const, C=Cv
При p=const, C=Cp
При T=const, C=∞
18.Применение первого начала термодинамики к изопроцессам
Изотермический, изохорический и изобарический процесс. Количество теплоты, работа и внутренняя энергия при этих процессах. Графики процессов.
Изохорный процесс (V=const). Диаграмма этого процесса (изохора) в координатах р, V изображается прямой, параллельной оси ординат, где процесс 1–2 есть изохорное нагревание, а 1–3 – изохорное охлаждение.
При
изохорном процессе газ не совершает
работы над внешними телами, т. е.
![]() .
Следовательно,
из первого начала термодинамики (
.
Следовательно,
из первого начала термодинамики (![]() )
для изохорного процесса следует, что
вся теплота, сообщаемая газу, идет на
увеличение его внутренней энергии:
)
для изохорного процесса следует, что
вся теплота, сообщаемая газу, идет на
увеличение его внутренней энергии:![]() .
т.е.
.
т.е.
![]() Тогда для произвольной массы газа
получим
Тогда для произвольной массы газа
получим![]()

Изобарный
процесс
(p=const).
Изобара в координатах р,
V
изображается прямой, параллельной оси
V.
При изобарном процессе работа газа при
увеличении объема от V1
до V2
равна
![]() и определяется площадью заштрихованного
прямоугольника
и определяется площадью заштрихованного
прямоугольника
Если
использовать уравнение Клапейрона–Менделеева
для выбранных
нами
двух состояний, то
![]() ,
,
![]() откуда работа изобарного расширения
откуда работа изобарного расширения
![]() .
В
изобарном процессе при сообщении газу
массой m
количества теплоты
.
В
изобарном процессе при сообщении газу
массой m
количества теплоты
![]() его внутренняя энергия возрастает на
величину
его внутренняя энергия возрастает на
величину![]() При этом газ совершит работу, определяемую
выражением
При этом газ совершит работу, определяемую
выражением![]() .
.
Изотермический
процесс
(T=const).
Изотермический процесс описывается
законом Бойля–Мариотта: pV
= const. Поэтому изотерма
в координатах р,
V
представляет собой гиперболу, расположенную
на диаграмме тем выше, чем выше температура,
при которой происходит процесс.
Исходя
из выражений
 и
и![]() найдем
работу изотермического расширения
газа:
найдем
работу изотермического расширения
газа:
 .
Taк
как при T=const
внутренняя энергия идеального газа не
изменяется:
.
Taк
как при T=const
внутренняя энергия идеального газа не
изменяется:
![]() .
то
из первого начала термодинамики
.
то
из первого начала термодинамики![]() следует, что для изотермического процесса
следует, что для изотермического процесса![]() .
т.
е. все количество теплоты, сообщаемое
газу, расходуется на совершение им
работы против внешних сил:
.
т.
е. все количество теплоты, сообщаемое
газу, расходуется на совершение им
работы против внешних сил:
![]() Следовательно,
для того чтобы при расширении газа
температура не понижалась, к газу в
течение изотермического процесса
необходимо подводить количество теплоты,
эквивалентное внешней работе расширения.
Следовательно,
для того чтобы при расширении газа
температура не понижалась, к газу в
течение изотермического процесса
необходимо подводить количество теплоты,
эквивалентное внешней работе расширения.
19.Адиабатический процесс
Определение. Уравнение Пуассона. Показатель адиабаты. Количество теплоты, работа и внутренняя энергия при этом процессе. Графическое представление процесса.
Адиабатическим
называется
процесс, при котором отсутствует
теплообмен (Q=0)
между
системой и окружающей средой. К
адиабатическим процессам можно отнести
все быстропротекающие процессы. Диаграмма
адиабатического процесса (адиабата)
в координатах р,
V
изображается гиперболой . 
Вычислим
работу, совершаемую газом в адиабатическом
процессе. Запишем уравнение
![]() в виде
в виде![]() .
Если
газ адиабатически расширяется от объема
V1
до V2,
то его температура уменьшается от T1
до T2
и работа расширения идеального газа
.
Если
газ адиабатически расширяется от объема
V1
до V2,
то его температура уменьшается от T1
до T2
и работа расширения идеального газа
 .
Применяя
те же приемы, что и при выводе формулы
TV
-1=const,
выражение
.
Применяя
те же приемы, что и при выводе формулы
TV
-1=const,
выражение
 для
работы при адиабатическом расширении
можно преобразовать к виду
для
работы при адиабатическом расширении
можно преобразовать к виду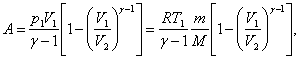 где
где![]() .
Работа, совершаемая газом при адиабатическом
расширении1–2
(определяется площадью, заштрихованной
на рисунке.
.
Работа, совершаемая газом при адиабатическом
расширении1–2
(определяется площадью, заштрихованной
на рисунке.
Уравнение Пуассона (вывод):
Из
первого начала термодинамики (Q
= dU+A)
для адиабатического процесса следует,
что
![]() ,
т. е. внешняя работа совершается за счет
изменения внутренней энергии системы.
Используя выраженияA
= pdV
и
,
т. е. внешняя работа совершается за счет
изменения внутренней энергии системы.
Используя выраженияA
= pdV
и
![]() ,
для произвольной массы газа перепишем
уравнение
,
для произвольной массы газа перепишем
уравнение
![]() в виде
в виде![]() .
Продифференцировав
уравнение состояния для идеального
газа pV=m/MRT,
получим
.
Продифференцировав
уравнение состояния для идеального
газа pV=m/MRT,
получим
![]() .
Исключим
из
.
Исключим
из
![]() и
и![]() температуруT:
температуруT:
![]() .
Разделив
переменные и учитывая, что СP/СV=
,
найдем
.
Разделив
переменные и учитывая, что СP/СV=
,
найдем
![]() .
Интегрируя
это уравнение в пределах от p1
до
p2
и соответственно от V1
до V2,
а затем потенцируя, придем к выражению
.
Интегрируя
это уравнение в пределах от p1
до
p2
и соответственно от V1
до V2,
а затем потенцируя, придем к выражению
![]() или
или
![]() .
Так
как состояния 1 и 2 выбраны произвольно,
то можно записать pV
= const.
Полученное выражение есть
уравнение адиабатического процесса,
называемое также уравнением
Пуассона.
.
Так
как состояния 1 и 2 выбраны произвольно,
то можно записать pV
= const.
Полученное выражение есть
уравнение адиабатического процесса,
называемое также уравнением
Пуассона.
|
Q=∆U+A
|
– 1-ый Закон термодинамики:
Теплота, сообщаемая системе идет на увеличение ее внутренней энергии на совершение системой А против внешних сил.
Работа
Найдем в общем виде внешнюю А, совершенную газом при изменении его объема. Рассмотрим газ, заключенный под поршнем. Газ расширяясь, передвигает поршень, на расстояние dl, при этом газ совершит работу:
|
A = pdV
|
Внутренняя энергия при этом процессе
Внутренняя энергия системы тел равна сумме внутренних энергий, образующих систему тел.
|
n U=∑ Ui i=1 |
