
- •Руководство
- •Оглавление
- •Глава 1. Растворы……………………..………………………………………………..…...7
- •Глава 2. Элементы химической термодинамики и био-
- •Глава 1. Растворы
- •1.1. Способы выражения концентрации растворов
- •Примеры решения задач Массовая доля компонента.
- •Молярная концентрация
- •Молярная концентрация эквивалента (нормальная концентрация)
- •Моляльная концентрация
- •Лабораторная работа Приготовление растворов заданной концентрации
- •Вопросы и задачи для самоподготовки.
- •1.2. Растворы сильных и слабых электролитов
- •Примеры решения задач
- •Вопросы и задачи для самоподготовки.
- •1.3. Автопротолиз воды. Ионное произведение воды. Водородный и гидроксильный показатели. Гидролиз солей
- •Примеры решения задач
- •Гидролиз солей
- •1.4. Буферные растворы
- •Приготовление буферных растворов и определение буферной ёмкости
- •Примеры решения задач
- •Вопросы и задачи для самоподготовки.
- •1.5. Гетерогенное равновесие
- •Лабораторная работа Ислледование гетерогенных равновесий на реакциях ионного обмена
- •Примеры решения задач
- •Вопросы и задачи для самоподготовки
- •1.6. Коллигативные свойства растворов неэлектролитов
- •Примеры решения задач
- •Вопросы и задачи для самоподготовки.
- •Глава 2. Элементы химической термодинамики и биоэнергетики. Термохимия
- •Примеры решения задач
- •Вопросы и задачи для самоподготовки.
- •Глава 3. Химическая кинетика и катализ. Равновесие
- •3.1. Химическая кинетика и катализ
- •Скорость химической реакции
- •Примеры решения задач
- •Вопросы и задачи для самоподготовки.
- •3.2. Химическое равновесие
- •Химическое равновесие
- •Примеры решения задач
- •Вопросы и задачи для самоподготовки
- •Глава 4. Основы электрохимии
- •4.1. Электрическая проводимость растворов электролитов. Кондуктометрия
- •Кондуктометрические измерения
- •4.2. Потенциометрическое измерение рН растворов
- •Потенциометрическое измерение рН растворов
- •Примеры решения задач
- •Вопросы и задачи для самоподготовки
- •Глава 5. Поверхностные явления
- •5.1. Адсорбция на твердой поверхности
- •Адсорбция на твердом теле
- •Исходя из термодинамических представлений, д.Гиббс вывел зависимость между адсорбцией и поверхностным натяжением, т.Е. Уравнение изотермы адсорбции на жидкой поверхности: ,
- •Адсорбция на жидкой поверхности
- •5.3. Хроматография
- •Гель-фильтрация голубого декстрана и витамина в2 (рибофламина) на сефадексе g-25
- •Примеры решения задач
- •Вопросы и задачи для самоподготовки
- •Глава 6. Лиофобные коллоидные системы
- •6.1. Получение и очищение коллоидных растворов
- •Получение золей
- •6.2. Электрические свойства коллоидных систем
- •Определение знака заряда коллоидных частиц
- •6.3. Коагуляция в коллоидных растворах
- •Определение зависимости коагулирующей способности электролитов
- •Примеры решения задач
- •Вопросы и задачи для самоподготовки
- •Глава 7. Высокомолекулярные соединения
- •7.1. Свойства растворов высокомолекулярных соединений
- •Свойства растворов высокомолекулярных соединений
- •7.2. Вязкость растворов высокомолекулярных соединений
- •Вискозиметрическое определение молекулярной массы полиэтиленгликоля
- •Примеры решения задач
- •7.3. Углеводы
- •Определение константы скорости гидролиза сахарозы
- •Вопросы и задачи для самоподготовки
- •Глава 8. Мицеллярные поверхностно-активные вещества (системы с самопроизвольным мицеллообразованием, полуколлоиды)
- •Определение критической концентрации мицеллообразования методом измерения поверхностного натяжения
- •Вопросы и задачи для самоподготовки
- •Глава 9. Микрогетерогенные системы
- •Свойства эмульсий и пен
- •Примеры решения задач
- •Вопросы и задачи для самоподготовки
- •Образец билета модуля № 1 «Элементы общей химии. Поверхностные явления. Коллоидные системы»
- •Образец билета модуля № 2 «Микрогетерогенные системы»
Примеры решения задач
Пример 1. Средняя молярная масса яичного альбумина равна 44000 г/моль. Рассчитайте осмотическое давление раствора, содержащего 10 г альбумина в 1,5 л при 25оС, учитывая, что белок находится в нейтральной форме.
|
Дано: М(альбумина) = 44000 г/моль m(альбумина) = 10 г V(pастворa) = 1,5 л T = 298 K Р |
Решение:
осмотическое давление растворов
полимеров вычисляем по формуле:
Учитывая, что белок находится в нейтральной 111 |
форме
(изодинамичном состоянии), осмотическое
давление рассчитываем по уравнению :
![]()
Ответ: 0,375 кПа
Пример 2. Характеристическая вязкость водного раствора поливинилового спирта при 50оС равна 1,11.10−3 м3/моль. Рассчитайте молекулярную массу полимера (K = 6,04.10−3 моль/м3, a = 0,67).
|
Дано: [h] =1,11.10−3 м3/моль T = 323 K K = 6,04.10−5 моль/м3 a М(спирта) − ? |
Решение: в соответствии с уравнением Марка-Куна-Хаувинка: [h] = КМa. Отсюда:
М = antlgM = 77 кг/моль или 77000 г/моль
Ответ: 77000 г/моль. |
Пример 3. К какому электроду будут передвигаться частицы белка (ИЭТ= 4,0) при электрофорезе в ацетатном буфере, приготовленном из 150 мл 0,1 М раствора ацетата натрия и 250 мл 0,2 М раствора уксусной кислоты (рК = 4,75)?
|
Дано: ИЭТ = 4,0 С(СН3СООН) = 0,2 моль/л V(p-pa кислоты) = 250 мл С(СН3СООNa) = 0,1 моль/л V(p-pa соли) = 150 мл рК(СН3СООН) = 4,75 З |
Решение: если ИЭТ > рН раствора, то полимер в растворе находится в виде макрокатиона (имеет положительный заряд) и перемещается к катоду. В случае, если ИЭТ < рН раствора, молекула образует полианион и при электрофорезе движется к аноду. При ИЭТ = рН она не движется. Поэтому, чтобы ответить на данный вопрос, сначала определяем рН буферного раствора: |

Как следует, рН = 4,23 > ИЭТ = 4. Значит, частицы белка заряжены отрица-тельно и при электрофорезе будут двигаться к аноду.
7.3. Углеводы
Углеводы - это природные органические вещества, имеющие общую формулу Cm(H2O)n (где m, n > 3), содержащие карбонильную группу и несколько гидроксильных групп. По способности к гидролизу углеводы подразделяются на моно-, ди-, олиго- (от греческого oliges – немного) и полисахариды. Ди-, олиго- и полисахариды при гидролизе расщепляются до моносахаридов.
112
|
Моносахаридами, или простыми углево-дами, называются углеводы, которые не подвергаются гидролизу. Моносахаридами являются рибоза, глюкоза, фруктоза, галак-тоза и другие. Они представляют собой сладкие на вкус, хорошо растворимые в воде белые кристаллические вещества. Моносахариды, содержащие альдегидную группу называются альдозами, содержащие кетоногруппу – кетозами, например: |
(альдоза) (кетоза) |
По числу атомов углерода в цепи моносахариды делятся на тетрозы (четыре атома углерода С4Н8О4), пентозы (пять атомов углерода С5Н10О5), гексозы (шесть атомов углерода С6Н12О6), гептозы (семь атомов углерода С7Н14О7) и т.д. В природе чаще всего встречаются пентозы и гексозы. Окончание –оза указывает на принадлежность соединения к классу углеводов, например:
рибоза ксилоза дезоксирибоза

глюкоза галактоза фруктоза
Изображенные структуры получили название проекционных формул Фишера.
Для моносахаридов характерно явление цикло-цепной таутомерии. Таутомерия – это способность вещества существовать в виде нескольких структурных форм (таутомеров). Молекулы моносахаридов в водных растворах могут существовать в виде открытых и в виде циклических форм. Циклическая форма образуется при переходе атома водорода от гидроксильной группы при 4-ом или 5-ом углероде к кислороду карбонильной группы, например:
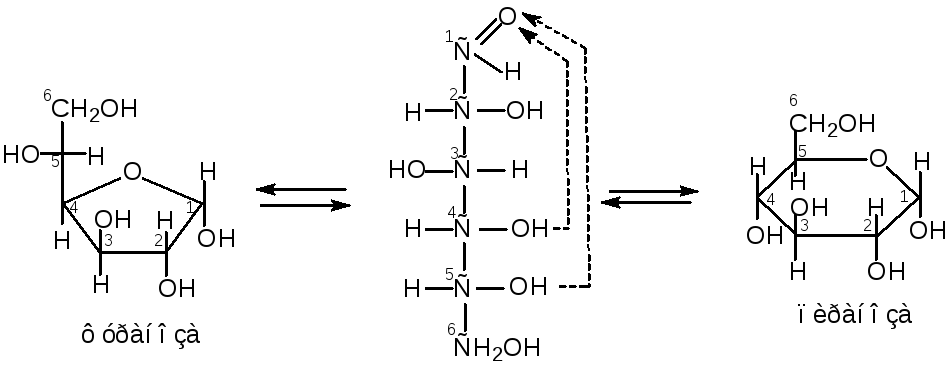
113
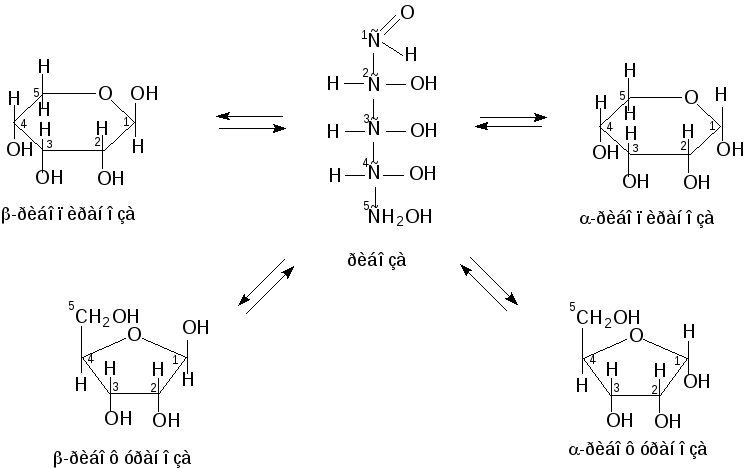
В результате образуются термодинамически более устойчивые пяти- или шестичленные таутомеры данного моносахарида. Пятичленные циклические таутомеры называются фуранозами, а шестичленные – пиранозами. Для изображения циклических форм моносахаридов используют формулы Хеуорса.

фуранозный цикл пиранозный цикл
В циклических формах моносахаридов нет карбонильной группы. Атом углерода С-1 в циклическом таутомере называют аномерным, а гидроксильную группу связанный с первым углеродным атомом – полуацетальной или гликозид-ной. В зависимости от расположения гликозидной гидроксильной группы в пространстве различают α- и β-аномеры. В α-аномерах гликозидный гидроксил расположен под плоскостью цикла, а в β-аномерах – над плоскостью цикла.
Ниже представлены цикло-цепная таутомерии некоторых моносахридов.
Цикло-цепная таутомерия глюкозы:

114
Цикло-цепная таутомерия фруктозы:

Цикло-цепная
таутомерия рибозы:
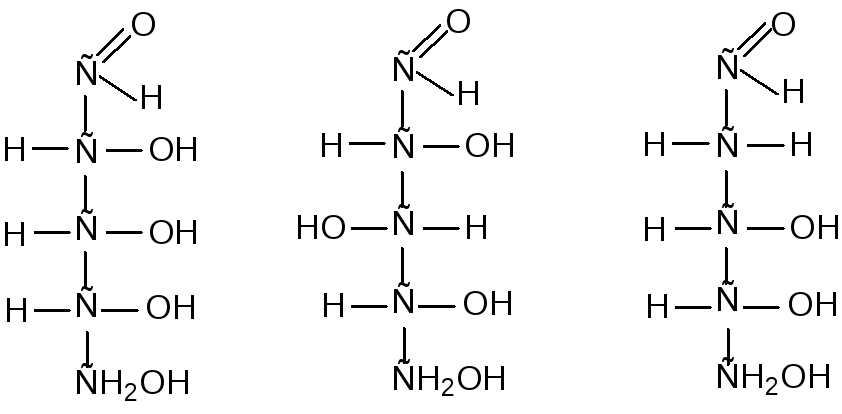
Молекула моносахарида содержит несколько асимметрических (хиральных) атомов углерода, поэтому для моносахаридов характерно явление оптической изомерии. Например, в открытой форме молекулы глюкозы имеется 4 асимметричных атома углерода. Исходя из правила N = 2n, число стереоизомеров для нее равно 16, т.е. 8 пар оптических изомеров (энантиомеров). Энантиомеры отличают друг от друга, относя их к D- или L-ряду. Принадлежность к D- или L-ряду для моносахаридов определяется по пространственному расположению атома H и ОН-группы у последнего асимметрического атома углерода, сравнивая его с глицериновым альдегидом:
115

моносахарид моносахарид
D-ряда L-ряда
Углеводы D- и L-ряда являются зеркальными отражениями друг друга. Большинство природных моносахаридов принадлежит к D-ряду.
Глюкоза в растениях образуется в процессе фотосинтеза из углекислого газа и воды: СО2 + 6Н2О hv® С6Н12О6 + 6О2 – 2920 кДж.
При гидролизе ди- и полисахаридов в кислой или щелочной среде (в зависимости от строения дисахарида) могут быть получены два одинаковых или два разных моносахарида. Например, в промышленности глюкозу получают гидролизом крахмала или целлюлозы: (С6Н10О5)n + nН2О H+® nС6Н12О6
Фруктозу получают гидролизом сахарозы: С12Н22О11 + Н2О ® С6Н12О6 + С6Н12О6
глюкоза фруктоза
Моносахариды
могут быть получены неполным окислением
многоатомных спиртов: НОСН2-(НСОН)4-СН2ОН
![]() НОС-(НСОН)4-СН2ОН
НОС-(НСОН)4-СН2ОН
Для моносахаридов характерны реакции как многоатомных спиртов, так и карбонильных соединений.
Реакции со спиртами
Данные реакции протекают в кислой среде (катализатор) по гликозидному гидроксилу:
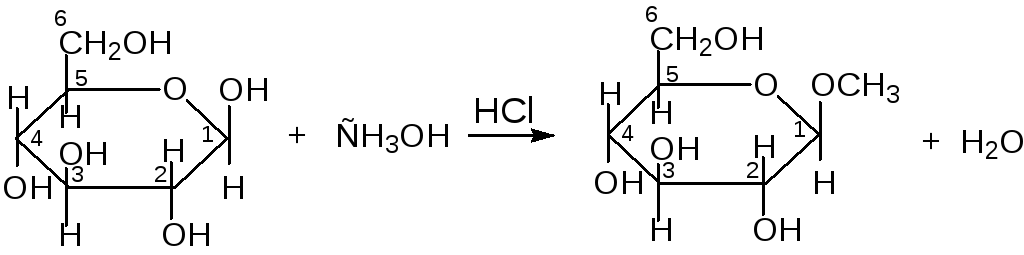
β-глюкопираноза β-метилглюкопиранозид
Реакции с алкилгалогенидами
Эти реакции протекают в щелочной среде по всем гидроксильным группам молекулы моносахарида:

α-фруктофураноза α-метил-1,3,4,6-тетраметил-
фруктофуранозид
116
Реакции с фосфорной кислотой
Реакция с фосфорной кислотой может протекать по гликозидному гидроксилу и по первичноспиртовым группам (-СН2ОН):

β-фруктофураноза 2-фосфат-β-фруктофуранозы

β-фруктофураноза 1,2,6-трифосфат-β-фруктофуранозы
Реакции с галогенангидридами карбоновых кислот
Такие реакции протекают по всем гидроксильным группам моносахаридов:

β-рибофураноза 1,2,3,5-тетраацетилрибофураноза
Реакции восстановления
Реакции восстановления протекают у моносахаридов в открытой форме, при этом альдегидная группа восстанавливается в спиртовую группу:
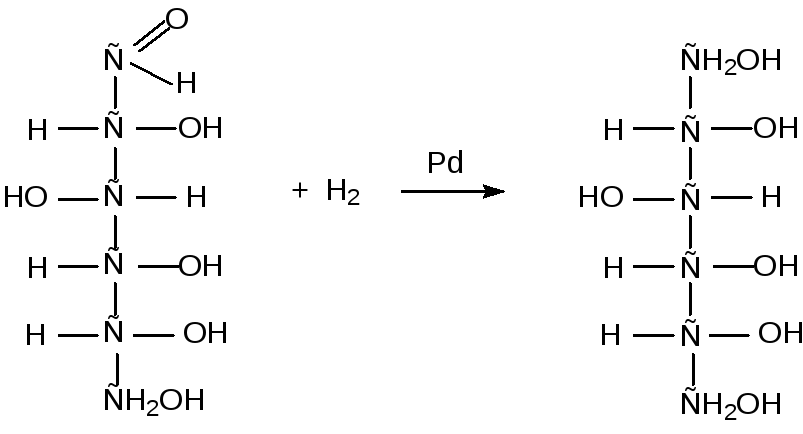
глюкоза сорбит
(альдегидо-спирт) (шестиатомный спирт)
117
Реакции с гидроксидом меди (II)
В состав молекул моносахаридов входят несколько гидроксильных групп, поэтому без нагревания они реагируют с гидроксидом меди (II) как многоатомные спирты, образуя комплексное соединение ярко-синего цвета:

глюкоза комплекс меди (II)
Реакции окисления (на примере глюкозы)
В зависимости от окислителя и условий реакции, окислению подвергаются как альдегидная группа моносахаридов, так и спиртовые гидроксильные группы.
а) окисление в щелочной среде
Окисление глюкозы в щелочной среде приводит к образованию солей глюконовой кислоты. Глюконовая кислота в щелочной среде неустойчива и подвергается деструкции углеродного скелета.
В качестве окислителей в реакцию вступают аммиачный раствор оксида серебра или гидроксид меди (II), реакции протекают при нагревании:

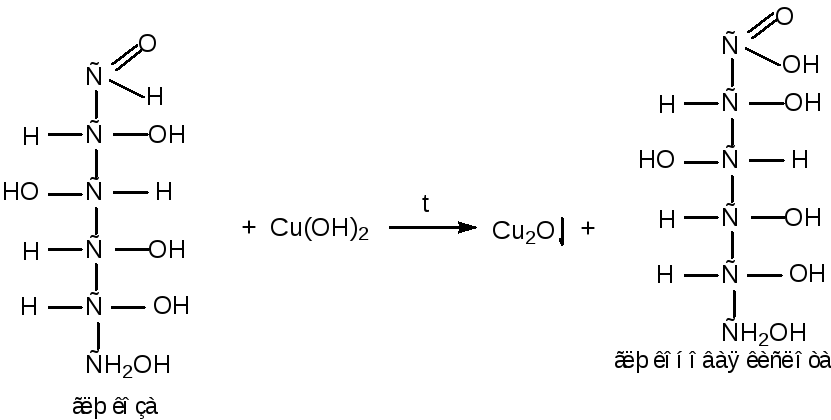
118
б) окисление в нейтральной среде
Мягкие окислители, такие как бромная вода, окисляют глюкозу до глюконовой кислоты (рибозу до рибоновой кислоты, а галактозу до галактоновой кислоты):
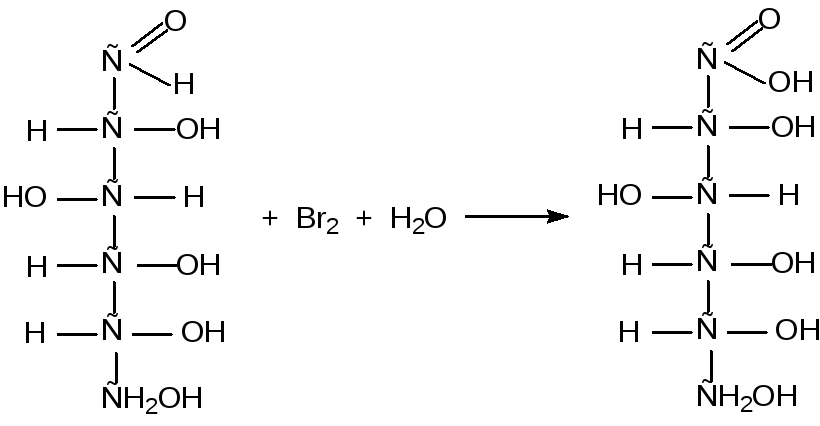
глюкоза глюконовая кислота
в) Окисление в кислой среде
Разбавленная азотная кислота окисляет моносахариды до двухосновных кислот. Глюкоза окисляется в глюкаровую (сахарную) кислоту, рибоза окисляется в рибаровую кислоту, галактоза окисляется в галактаровую кислоту:

глюкоза глюкаровая кислота
Реакции брожения глюкозы
Брожение – процесс разложения глюкозы под действием микроорганизмов или ферментов. Различают следующие виды брожения глюкозы.
а) спиртовое брожение глюкозы:
С6Н12О6
![]() 2С2Н5ОН
+ 2 СО2
+ 70 кДж
2С2Н5ОН
+ 2 СО2
+ 70 кДж
б) молочнокислое брожение глюкозы:
С6Н12О6
![]() 2
СН3-
СН-СООН
2
СН3-
СН-СООН
½
СН3
в) маслянокислое брожение гдюкозы:
С6Н12О6
![]() СН3-СН2-СН2-СООН
+ 2СО2
+ 2Н2
СН3-СН2-СН2-СООН
+ 2СО2
+ 2Н2
г) лимоннокислое брожение глюкозы:
С6Н12О6
+3[O]
![]() НООС-СН2-С(ОН)-СН2-СООН
+ 2Н2О
НООС-СН2-С(ОН)-СН2-СООН
+ 2Н2О
½
СООН
119
д) в живых организмах происходит окисление глюкозы по действием кислорода
воздуха по реакции: С6Н12О6 + 6О2 ®СО2 + 6Н2О + 2920 кДж
При этом выделяется энергия, которая используется организмом. Поэтому глюкоза является основным источником энергии организма.
Фруктоза (кетоноспирт), являясь изомером глюкозы, вступает во все реакции многоатомных спиртов, но в отличие от глюкозы (альдегидоспирта), не обладает восстанавливающими свойствами: не реагирует с аммиачным раствором оксида серебра, не окисляется Cu(OH)2.
Дисахариды состоят из остатков двух моносахаридов одинаковой или разной природы и имеют формулу С12Н22О11. К ним относят сахарозу, мальтозу, целлобиозу и лактозу. Все эти вещества представляют собой хорошо раствори-мые в воде бесцветные кристаллы сладкого вкуса.
Мальтоза состоит из двух остатков молекул глюкопиранозы, связанных между собой α-1,4-гликозидной связью (через 1-ый и 4-ый атомы углерода):
 α-глюкопираноза
α-глюкопираноза α-мальтоза
α-глюкопираноза
α-глюкопираноза α-мальтоза
Целлобиоза состоит из двух остатков молекул глюкопиранозы, связанных между собой β-1,4-гликозидной связью (один остаток фиксировано находится в β -форме):
 β-глюкопираноза
α-глюкопираноза
α-целлобиоза
β-глюкопираноза
α-глюкопираноза
α-целлобиоза
Лактоза образована из остатков β-галактопиранозы и a-глюкопиранозы, связанных между собой β-1,4-гликозидной связью:

β-галактопираноза α-глюкопираноза α-лактоза
120
Сахароза образована из остатка α-глюкопиранозы и остатка β-фруктофуранозы, связанных между собой α-1,2-гликозидной связью:
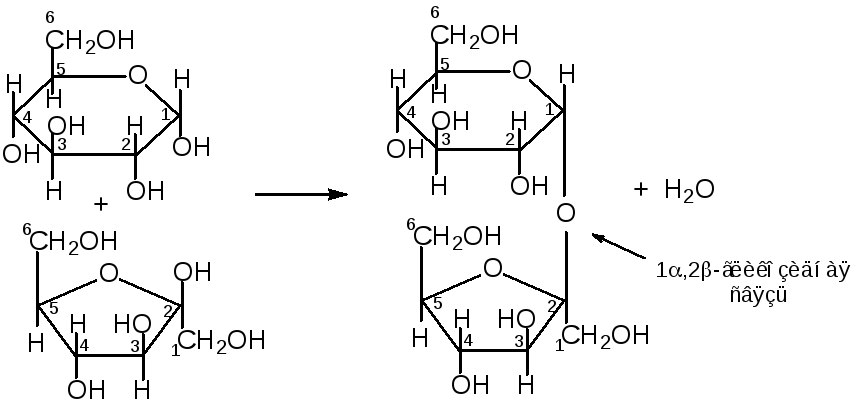
α-глюкопираноза + β-фруктофураноза сахароза
Наиболее распространенным дисахаридом является сахароза (тростниковый сахар). Его получают экстракцией из сахарной свеклы или сахарного тростника. Сахароза является важным источником углеводов в пище человека.
Лактоза (молочный сахар) содержится в молоке (2 - 8%) и получается из молочной сыворотки.
Мальтоза (солодовый сахар) содержится в проросшенных семенах хлебных злаков и образуется при неполном гидролизе крахмала под действием ферментов.
Целлобиоза получается при неполном гидролизе целлюлозы.
Дисахариды подразделяются на два типа: восстанавливающие и невосстанавливающие. К восстанавливающим дисахаридам относят мальтозу, лактозу и целлобиозу. В молекулах мальтозы, лактозы, целлобиозы один полуацетальный (гликозидный) гидроксил остается свободным и поэтому дисахариды существуют в двух таутомерных формах, одна из которых – альдегидная. Эти дисахариды могут участвовать в реакции серебряного зеркала и восстанавливать свежеосажденный Cu (OH)2 до Cu2O, например:
C12H22O11
+ Ag2O
![]() C12H22O12
+ 2 Ag¯
C12H22O12
+ 2 Ag¯
C12H22O11 + 2Cu(OH)2 ® C12H22O12 + Cu2O¯ + 2H2O
В молекуле сахарозы свободный гликозидный гидроксил отсутствует. В связи с этим сахароза не может раскрываться и переходить в альдегидную форму и поэтому она не обладает восстанавливающими свойствами. Поэтому сахароза невосстанавливающий дисахарид.
Дисахариды вступают во многие реакции, характерные для моносахаридов: реакции со спиртами, алкилгалогенидами, фосфорной кислотой, с галогенангидридами кислот.
Углеводы, содержащие в молекуле более 10 остатков моносахаридов, называются полисахаридами. Общая формула полисахаридов (С6Н10О5)n. Молекулярная масса природных полисахаридов, важнейшими из которых являются крахмал и целлюлоза, может быть от нескольких тысяч до нескольких миллионов.
121
|
Крахмал – природный полимер, образованный остатками a-глюкозы. Крахмал представляет собой смесь полисахаридов амилопектина и амилозы. Амилоза – растворимый в воде линейный полисахарид, в котором остатки a-глюкозы связаны между собой α-1,4-гликозидной связью. |
|
Линейная полимерная цепь амилозы свернута в спираль, внутри которой имеется тонкий (0,5 нм) канал, в который могут проникать некоторые молекулы. Например, при обработке крахмала йодом, туда проникают молекулы йода и окрашивают полимер в синий цвет. Эта реакция с йодом является качественной реакцией на крахмал.
Амилопектин – нерастворимый в воде полимер с разветвленным строением. В его молекуле остатки a-глюкозы связаны a-1,4- и a-1,6- гликозидными связями:


Крахмал не растворяется в холодной воде. В горячей воде образует коллоидный раствор (клейстер). При нагревании в кислой среде крахмал гидролизуется с разрывом связей между остатками a-глюкозы. При этом образуется ряд промежуточных продуктов (декстрины, затем мальтоза). Конечным продуктом гидролиза крахмала является a-глюкоза:
(С6Н10О5)n + n H2O ® n С6Н12О6
Крахмал – ценный питательный продукт. Он входит в состав хлеба (в муке 75-80%), картофеля (25%), круп и является важнейшим источником углеводов в человеческом организме. Используется в производстве глюкозы, этанола, молочной кислоты, в пищевой промышленности, в медицине.
Другим распространенным в природе полисахаридом является целлюлоза (или клетчатка). Он представляет собой твердое, нерастворимое в воде волок-нистое вещество. Является основным веществом растительных клеток. Например, 50% древесины, 95-98% хлопка и льна состоят из целлюлозы. Состав его такой же, как у крахмала -(С6Н10О5)n. В отличие от крахмала молекулы целлюлозы имеют линейное строение, причем цепи расположены параллельно друг к другу и соединены между собой водородными связями, в так называемые волокна. Остатки b-глюкозы в целлюлозе соединены между собой b-1,4-гликозидной связью:
122

При нагревании в кислой среде целлюлоза гидролизуется до b-глюкозы по схеме: целлюлоза®амилоид ®целлобиоза®b-глюкоза.
Целлюлоза растворяется а аммиачном растворе Cu(OH)2 (реактив Швейцера).
Для целлюлозы характерна способность к образованию сложных эфиров. Так, при взаимодействии с азотной или уксусной кислотами в присутствии концен-трированной серной кислоты образуются соответствующие сложные эфиры:
[C6H7O2(OH)3]n + 3nHNO3 ® [C6H7O2(ONO2)3]n + 3nH2O
[C6H7O2(OH)3]n + 3nCH3COOH ®[C6H7O2(OCOCH3)3]n + 3nH2O
Полный нитрат целлюлозы (пироксилин) – взрывчатое вещество, его используют для приготовления бездымного пороха. Из ацетата целлюлозы изготавливают ацетатное волокно, лаки и кинопленки.
Лабораторная работа

 осм.
− ?
осм.
− ? = 0,67
= 0,67
 аряд
белка − ?
аряд
белка − ? глюкоза
фруктоза
глюкоза
фруктоза