- •Руководство
- •Оглавление
- •Глава 1. Растворы……………………..………………………………………………..…...7
- •Глава 2. Элементы химической термодинамики и био-
- •Глава 1. Растворы
- •1.1. Способы выражения концентрации растворов
- •Примеры решения задач Массовая доля компонента.
- •Молярная концентрация
- •Молярная концентрация эквивалента (нормальная концентрация)
- •Моляльная концентрация
- •Лабораторная работа Приготовление растворов заданной концентрации
- •Вопросы и задачи для самоподготовки.
- •1.2. Растворы сильных и слабых электролитов
- •Примеры решения задач
- •Вопросы и задачи для самоподготовки.
- •1.3. Автопротолиз воды. Ионное произведение воды. Водородный и гидроксильный показатели. Гидролиз солей
- •Примеры решения задач
- •Гидролиз солей
- •1.4. Буферные растворы
- •Приготовление буферных растворов и определение буферной ёмкости
- •Примеры решения задач
- •Вопросы и задачи для самоподготовки.
- •1.5. Гетерогенное равновесие
- •Лабораторная работа Ислледование гетерогенных равновесий на реакциях ионного обмена
- •Примеры решения задач
- •Вопросы и задачи для самоподготовки
- •1.6. Коллигативные свойства растворов неэлектролитов
- •Примеры решения задач
- •Вопросы и задачи для самоподготовки.
- •Глава 2. Элементы химической термодинамики и биоэнергетики. Термохимия
- •Примеры решения задач
- •Вопросы и задачи для самоподготовки.
- •Глава 3. Химическая кинетика и катализ. Равновесие
- •3.1. Химическая кинетика и катализ
- •Скорость химической реакции
- •Примеры решения задач
- •Вопросы и задачи для самоподготовки.
- •3.2. Химическое равновесие
- •Химическое равновесие
- •Примеры решения задач
- •Вопросы и задачи для самоподготовки
- •Глава 4. Основы электрохимии
- •4.1. Электрическая проводимость растворов электролитов. Кондуктометрия
- •Кондуктометрические измерения
- •4.2. Потенциометрическое измерение рН растворов
- •Потенциометрическое измерение рН растворов
- •Примеры решения задач
- •Вопросы и задачи для самоподготовки
- •Глава 5. Поверхностные явления
- •5.1. Адсорбция на твердой поверхности
- •Адсорбция на твердом теле
- •Исходя из термодинамических представлений, д.Гиббс вывел зависимость между адсорбцией и поверхностным натяжением, т.Е. Уравнение изотермы адсорбции на жидкой поверхности: ,
- •Адсорбция на жидкой поверхности
- •5.3. Хроматография
- •Гель-фильтрация голубого декстрана и витамина в2 (рибофламина) на сефадексе g-25
- •Примеры решения задач
- •Вопросы и задачи для самоподготовки
- •Глава 6. Лиофобные коллоидные системы
- •6.1. Получение и очищение коллоидных растворов
- •Получение золей
- •6.2. Электрические свойства коллоидных систем
- •Определение знака заряда коллоидных частиц
- •6.3. Коагуляция в коллоидных растворах
- •Определение зависимости коагулирующей способности электролитов
- •Примеры решения задач
- •Вопросы и задачи для самоподготовки
- •Глава 7. Высокомолекулярные соединения
- •7.1. Свойства растворов высокомолекулярных соединений
- •Свойства растворов высокомолекулярных соединений
- •7.2. Вязкость растворов высокомолекулярных соединений
- •Вискозиметрическое определение молекулярной массы полиэтиленгликоля
- •Примеры решения задач
- •7.3. Углеводы
- •Определение константы скорости гидролиза сахарозы
- •Вопросы и задачи для самоподготовки
- •Глава 8. Мицеллярные поверхностно-активные вещества (системы с самопроизвольным мицеллообразованием, полуколлоиды)
- •Определение критической концентрации мицеллообразования методом измерения поверхностного натяжения
- •Вопросы и задачи для самоподготовки
- •Глава 9. Микрогетерогенные системы
- •Свойства эмульсий и пен
- •Примеры решения задач
- •Вопросы и задачи для самоподготовки
- •Образец билета модуля № 1 «Элементы общей химии. Поверхностные явления. Коллоидные системы»
- •Образец билета модуля № 2 «Микрогетерогенные системы»
7.2. Вязкость растворов высокомолекулярных соединений
Теоретическое пояснение: вязкостью или внутренним трением жидкости называется ее сопротивляемость течению. Внутреннее течение обусловлено силами притяжения между молекулами жидкости. При спокойном течении все слои её движутся параллельно и не перемешиваются. Такое течение жидкости называется послойным или ламинарным (от латинского lamina – слой). При увеличении скорости движения отдельные слои начинают перемешиваться. Такое течение с завихрениями называется турбулентным.
Вязкость
жидкостей и растворов зависит от
температуры. С повышением температуры
силы притяжения между молекулами
уменьшаются и вязкость снижается.
Вязкость раствора зависит и от концентрации
вещества, т.к. моле-кулы или частицы
растворенного вещества оказывают
дополнительное сопро-тивление течению.
Для низкомолекулярных веществ обычно
соблюдается простая линейная зависимость
между концентрацией раствора и удельной
вязкостью. Удельная
вязкость
представляет относительный прирост
вязкости растворителя при добавлении
к нему полимера:
![]() .
.
Где h − вязкость раствора, h0 − вязкость растворителя.
При одинаковой химической структуре молекул вязкость растворов возрас-тает с увеличением молекулярной массы. Это объясняется тремя причинами:
1.Молекулы высокомолекулярных соединений подобны длинным гибким цепям, свернутым в клубки. Такие молекулы оказывают наибольшее сопротив-ление течению, если располагаются поперек потока. При увеличении скорости потока макромолекулы в различной степени распрямляются и ориентируются вдоль потока. Вязкость раствора снижается.
2.Молекулы ВМС имеют много разнообразных группировок и поэтому силь-но взаимодействуют с молекулами растворителя и между собой, образуют боль-шие сольватные оболочки, которые создают дополнительные сопротивления движению макромолекул в растворе и обусловливают высокую вязкость.
3.Физическое взаимодействие макромолекул приводит к возникновению пространственных структур. Из-за этого вязкость раствора полимера повышается непропорционально концентрации. Структурообразование может привести к тому, что раствор потеряет текучесть и превращает в гель. Поэтому аномально высокая вязкость растворов полимера называют структурной вязкостью. С уве-личением внешнего давления скорость течения раствора возрастает и структуры разрушаются.
108
В условиях ламинарного течения при низкой концентрации растворов поли-меров, когда взаимодействие макромолекул минимально, вязкость разбавленных растворов пропорциональна массовой концентрации. Эта зависимость выражается уравнением Штаудингера: hуд=КМС.
Где
К − константа полимергомологического
ряда, т.е. величина постоянная для
полимеров любой молекулярной массы,
состоящих из данного мономера. По
уравнению Штаудингера молекулярная
масса полимера определяет прирост
удельной вязкости на единицу концентрации
раствора:
![]() =
КМ. Эта величина называется приведенной
вязкостью.
Она не зависит от концентрации и
опреде-ляется лишь молекулярной массой
полимера. Приведенная вязкость растворов
=
КМ. Эта величина называется приведенной
вязкостью.
Она не зависит от концентрации и
опреде-ляется лишь молекулярной массой
полимера. Приведенная вязкость растворов
|
Рис.10. графическое определение характеристической вязкости раствора полимера |
полимеров при бесконечном разведении раствора, когда отсутствует взаимодействие между макро-молекулами называется характеристической вязкостью или предельным числом вязкости [h]. На графике зависимости приведенной вязкости от концентрации раствора (рис.10 ) ей соответствует отрезок, отсекаемой прямой на ординате. Таким образом, характеристическая вязкость отражает гидродинамическое сопротивление, испытывае-мое молекулами полимера при движении в растворе.
|
С увеличением молекулярной массы возрастает гибкость цепей полимеров и макромолекулы свертывающиеся в клубки, что сказывается на вязкости. Влия-ние этих факторов учитывает обобщенное уравнение Марка-Куна-Хаувинка: [h] = КМa, где a − величина, учитывающая гибкость цепей гомологического ряда полимеров в данном растворителе.
|
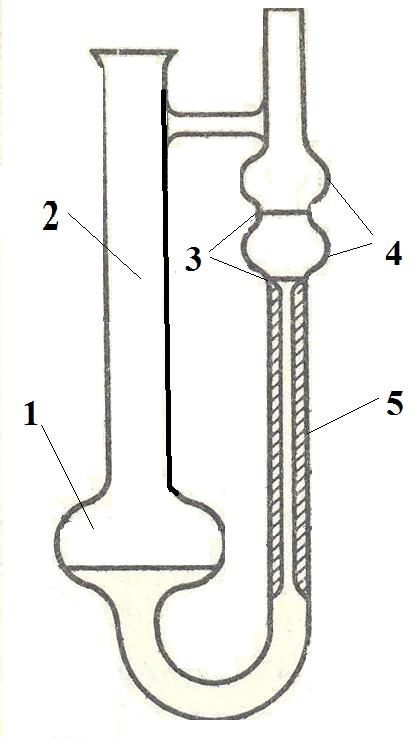
Рис.11. Вискозиметр Оствальда: 1 – расширение, 2 − широкое колено, 3 − риски (верхний и нижний метки), 4 – резервуары, 5 − капилляр |
Разработаны различные методы и приборы для измерения вязкости. Обычно вязкость определяют по методу шарика и капиллярным вискозометром. Для жидкостей с малой вязкостью наиболее просто определение ее капиллярными вискозиметрами. Простейший капиллярный вискозиметр Оствальда (рис.11) представляет − образную стеклянную труб-ку. В узком колене вискозиметра есть расширение (шарик), переходящее в капилляр. Объем шарика ограничивается верхней и нижней метками. Капил-ляр внизу переходит в широкое колено вискози-метра, в которое заливается исследуемая жидкость. При определении вязкости жидкость насасывают в шарик ограниченный метками. Измеряют время истечения определенного объема жидкости через капилляр в широкое колено под давлением сжатого |
109
воздуха или под действием силы тяжести.
Для
разбавленных растворов плотность
раствора можно принять равной плот-ности
растворителя. Тогда отношение вязкостей
(относительная вязкость раствора) будет
определяться просто отношением времени
истечения раствора и растворителя: ![]() .
Зная вязкость растворителя легко
вычислить вязкость раствора.
.
Зная вязкость растворителя легко
вычислить вязкость раствора.
Определение вязкости жидкостей называется вискозометрией. Вискозомет-рия широко используется для контроля технологических операций и качества продукции. Наиболее часто вискозометрию применяют для определения молеку-лярной массы полимеров. В медико-биологических исследованиях определение вязкости растворов белков и нуклеиновых кислот позволяет определить форму их молекул, степень денатурации, молекулярную массу нуклеиновых кислот. Определить молекулярную массу белков вискозометрическим методом невоз-можно, т.к. белки состоят из разных аминокислот и не составляют гомологи-ческий ряд и соответственно их растворы проявляют разную вязкость. В меди-цинских исследованиях иногда определяют вязкость крови. При эритремии вследствие ненормально большого числа эритроцитов вязкость крови повышена, что обуславливает перегрузку сердца. При кровопотерях, частых переливаниях крови плазмозаменяющими растворами может развиться гидремия − разжижение крови.
Лабораторная работа