- •Классификация по агрегатному состоянию дисперсной фазы и дисперсионной среды (по в.Оствальду)
- •Классификация по взаимодействию дисперсионной среды и дисперсной фазы (по г.Фрейндлиху)
- •Классификация по взаимодействию между частицами дисперсной фазы (по подвижности дисперсной фазы)
- •Электрокинетические явления
- •Методы получения коллоидных систем
- •Диспергационные методы получения коллоидных систем
- •Конденсационные методы получения коллоидных систем
- •Химическая конденсация
- •Методы очистки коллоидных систем
- •1. Теория Гельмгольца-Перрена (1878 г.)
- •2. Теория Гуи-Чепмена (1915 г.)
- •3. Теория Штерна (1924 г.)
- •Влияние электролитов на электротермодинамический и электрокинетический потенциалы
- •Взаимная коагуляция золей
- •Кинетика коагуляции
- •Правила коагуляции электролитами
- •Теории коагуляции электролитами
- •Чередование зон коагуляции или явление неправильных рядов
- •Вязкость коллоидных растворов
Влияние электролитов на электротермодинамический и электрокинетический потенциалы
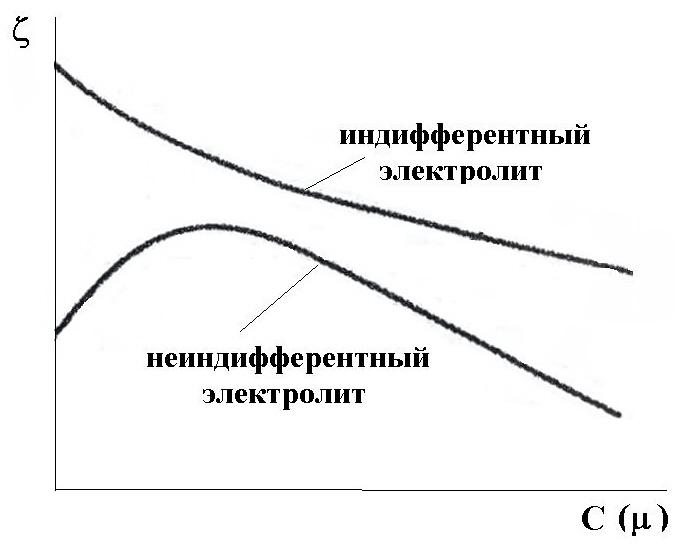
По отношению к золю электролиты делятся на индифферентные и неиндиффе-рентные. В индифферентных электролитах отсутствуют ионы, которые могли бы адсорбироваться на поверхности коллоидных частиц. При введении в коллоидный раствор такого электролита наблюдается ионный обмен между противоионами ДЭС и ионами добавляемого электролита, сжатие диффузной атмосферы вокруг частиц. Например, при введении в коллоидный раствор {mAgI,nI-(n-x)K+}xK+
|
Рис.5. Влияние ионной силы электролитов на электрокинетический потенциал |
электролита NaNO3, между ионами Na+ и противо-ионами ДЭС (K+) происходит ионный обмен. Взаимодействие этих ионов с потенциалопределяю-щими ионами (I-) примерно одинаково, поэтому диффузный слой будет содержать смесь ионов Na+ и K+. Увеличение концентрации противоионов приводит к увеличению ионной силы раствора, в результате чего уменьшается толщина ионной атмосферы и наблюдается сжатие диффузного слоя ДЭС. При этом часть противоионов из диффузного слоя переходит в адсорбционный слой и снижает величину дзета-потенциала.
|
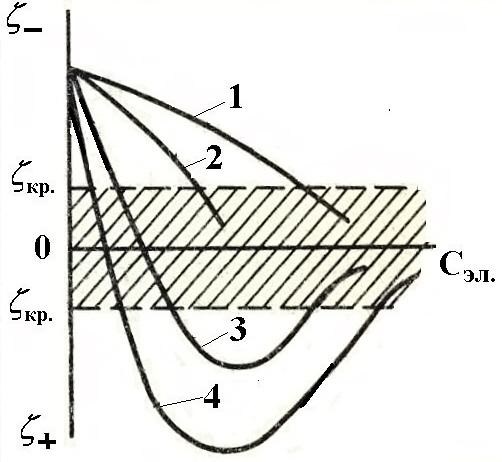
Влияние усиливается, если в электролите содержится многозарядный ион. Они более активно взаимодействуют с потенциалопределяющими ионами и вытесняют однозарядные ионы из адсорбционного и диффузного слоев в раствор, становясь на их место. При этом потенциал падает быстрее. При добавлении трех- и четы-
|
Рис.6. Зависимость z-потен-циала от концентрации электро-литов: 1–одно-, 2- двух-, 3-трех- и 4- четырехзарядные ионы |
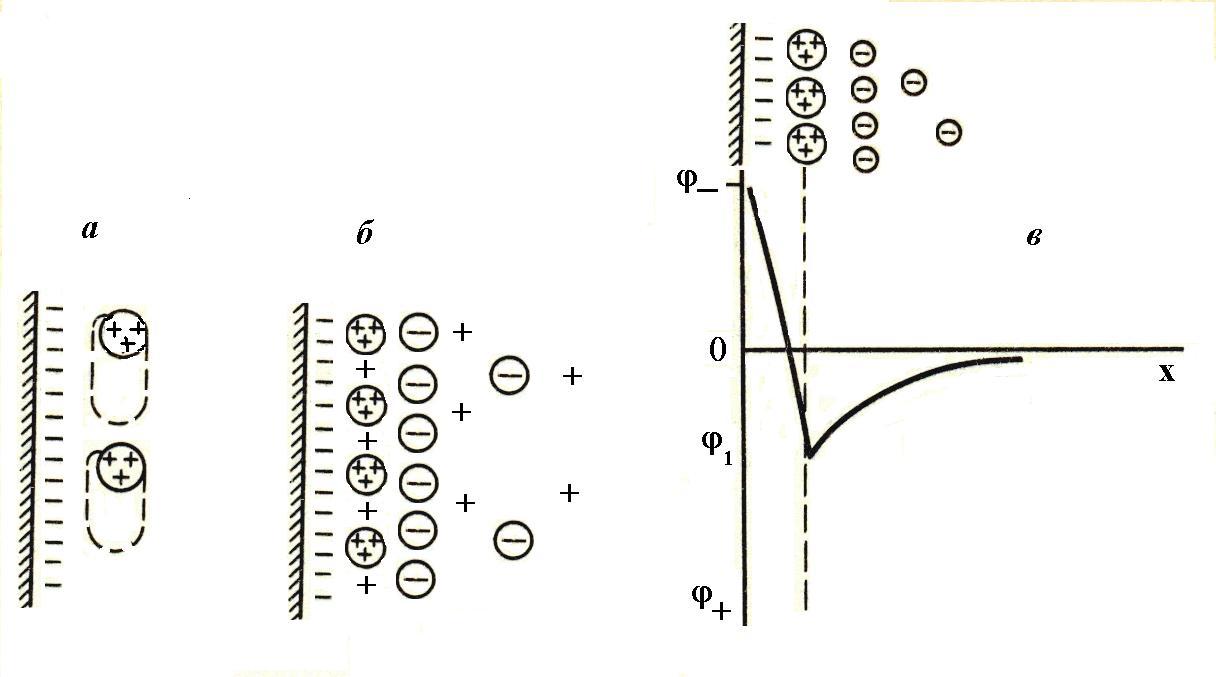
рехзарядных ионов возможна перемена знака z-потен-циала. Это явление называется перезарядкой золя. Изменение знака дзета-потенциала объясняют сверх-эквивалентной адсорбцией многозарядных ионов. Например, при введении электролита Al(NO3)3 ионы Al3+ вначале электростатически притягиваются к отри-цательно заряженной поверхности и входят в диффуз-ный слой наравне с ионами калия. Из-за высокой адсорбируемости они проникают в адсорбционный слой и вытесняют ионы калия. Из-за большого заряда и небольшого (малого) размера их количество больше количества однозарядных ионов. |
В силу этих же причин, заряд их не полностью компенсируется общим зарядом потенциалопределяющих ионов. Некомпенсированные заряды поляризуют по-
|
Рис.7. Схема сверхэквивалентной адсорбции тролитом. Они образуют диффузный слой. |
верхность
твердой фазы, придавая ей потенциал,
противоположный по знаку исходному
потенциалу. В рез-ультате перезарядки
многозаряд-ными ионами ДЭС становится
3-слойным. При этом потенциалоп-ределяющими
ионами становятся многозарядные ионы
(Al3+).
К ним из раствора притягиваются
протии-воионы ( |
следующим образом:
{mAgI,nI-,zAl3+[3(z-x)-n)]![]() }3x
}3x![]()
Влияние неиндифферентного электролита
Неиндифферентным называется электролит, содержащий ионы, способные достраивать кристаллическую решетку. Например, при введении в золь
{mAgI,
nAg+(n-x)![]() }х
}х![]() небольшого количества KI
наблюдается увеличи-вается ионная сила
раствора, приводящее к повышению
z-потенциала.
Избыточное количество KI
будет реагировать с AgNO3
и образовывать дополнительное коли-чество
дисперсных частиц AgI.
На их поверхности уже будут адсорбироваться
иодид-ионы и обуславливать отрицательный
заряд поверхности. Потенциалоп-ределяющими
ионами уже будут иодид-ионы, а противоионами
– ионы К+:
{mAgI,
nI-
(n-x)
K+}х
K+.В
этом случае перезарядки изменяется
знак не только дзета-потенциала, но и
электротермо-динамического (j-)
потенциала.
небольшого количества KI
наблюдается увеличи-вается ионная сила
раствора, приводящее к повышению
z-потенциала.
Избыточное количество KI
будет реагировать с AgNO3
и образовывать дополнительное коли-чество
дисперсных частиц AgI.
На их поверхности уже будут адсорбироваться
иодид-ионы и обуславливать отрицательный
заряд поверхности. Потенциалоп-ределяющими
ионами уже будут иодид-ионы, а противоионами
– ионы К+:
{mAgI,
nI-
(n-x)
K+}х
K+.В
этом случае перезарядки изменяется
знак не только дзета-потенциала, но и
электротермо-динамического (j-)
потенциала.
Коагуляция золей смесями электролитов (совместная коагуляция)
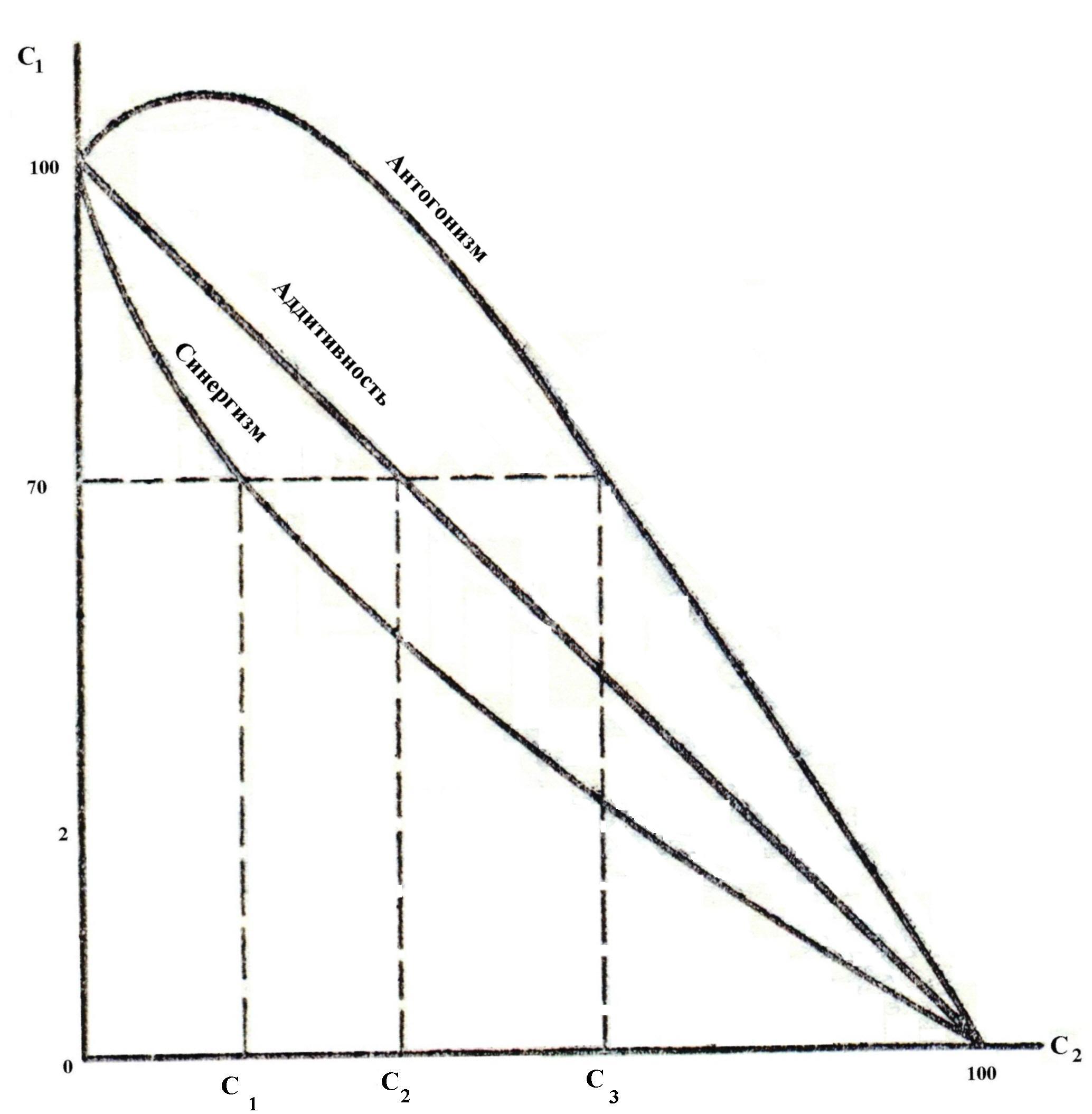
Коагуляция осложняется при применении смеси электролитов. При этом воз-можны 3 варианта действия электролитов. Аддитивность – суммарное коагули-рующее действие электролитов. Имеет место при отсутствии взаимодействия меж-ду ионами разных электролитов, т.е. когда электролиты содержат противоионы одинаковой валентности. Если один электролит присутствует в количестве 70% от его порога коагуляции, то для вызова коагуляции необходимо взять второй элек-тролит в количестве 30% от его порога коагуляции.
|
|
Синергизм – явление взаимного усиления коагули-рующего действия электролитов. Обусловлено химическим взаимодействием ионов смеси с образованием ионов с большим зарядом, чем исходные ионы. В связи с этим, согласно правила Шульца-Гарди, новообразованные ионы обладают большей коагулирующей способностью. Поэтому, чтобы вызвать коагуляцию, второй электролит должен быть взят в количестве, меньше 30% от его порога коагуляции. |
Антогонизм ( пептизация) – явление взаимного ослабления коагулирующей способности электролитов. Обусловлено образованием новых ионов, обладающих меньшим зарядом по сравнению с зарядом исходных ионов. Поэтому, чтобы вызвать коагуляцию, их суммарная концентрация должна быть больше 100%.