
- •Демонстрационные и компьютерные эксперименты при изучении атомной физики
- •1.Для обеспечения наглядности при изучении физики широко применяют “материальные” модели, в которых рассматриваются не сами изучаемые явления, а их аналоги.
- •2. Для того, что бы показать любой эксперимент по атомной физике во всей его полноте прибегают к компьютерному моделированию.
- •§3 Требования к электронному учебнику
- •Поддерадние внимания на примере млаших школьников
24. Атом Водорода. Модель Бора и его историческая роль. Спектр излучения атомарного водорода. Состояние электрона в многоэлектронном атоме(квантовые числа). Принцип Паули. Периодич-сист. эл-в Менделеева.
Н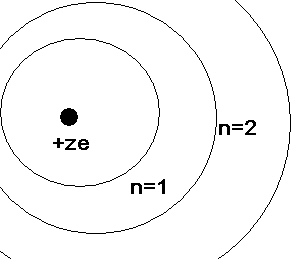 а
основе планет. модели атома Бор разработал
теорию атома водорода и атомов
изоэлектронного ряда водорода
(изоэлектронный ряд водорода – это
атомы или ионы имеющие в электронной
оболочке 1 единственный электрон). Теория
Бора позволила объяснить известные к
тому времени спектральные закономерности
этих атомов и предсказать другие спектр.
закон-ти которые были обнаружены позднее.
В основе теории Бора лежат несколько
постулатов. Во-первых предполагается,
что 1 единственный электрон данного
атома совершает движение по круговой
орбите.
I-постулат
Бора
утверждает, что устойчивыми орбитами
на которых и может находиться электрон
явл-ся круговой орбитой, удовлет-щей
условиям
а
основе планет. модели атома Бор разработал
теорию атома водорода и атомов
изоэлектронного ряда водорода
(изоэлектронный ряд водорода – это
атомы или ионы имеющие в электронной
оболочке 1 единственный электрон). Теория
Бора позволила объяснить известные к
тому времени спектральные закономерности
этих атомов и предсказать другие спектр.
закон-ти которые были обнаружены позднее.
В основе теории Бора лежат несколько
постулатов. Во-первых предполагается,
что 1 единственный электрон данного
атома совершает движение по круговой
орбите.
I-постулат
Бора
утверждает, что устойчивыми орбитами
на которых и может находиться электрон
явл-ся круговой орбитой, удовлет-щей
условиям
![]() ,
где n=1,2,3…
L
– вектор момента импульса мат. точки.
,
где n=1,2,3…
L
– вектор момента импульса мат. точки.
![]()
![]() т.к. круговая орбита то
т.к. круговая орбита то
![]()
![]()
![]() ;
II-
постулат Бора
утверждает, что движущийся ускоренно
по круговой орбите электрон не излучает
эл/магн. волну и не теряет свою энергию.
Равномерное движение по круговой орбите
является ускоренным (из кинематики).
III-
постулат Бора
утверждает, что излучение и поглощение
одной порции энергии или иначе кванта
энергии происходит при кратковременном
перескоке с одной боровской орбиты в
другую
;
II-
постулат Бора
утверждает, что движущийся ускоренно
по круговой орбите электрон не излучает
эл/магн. волну и не теряет свою энергию.
Равномерное движение по круговой орбите
является ускоренным (из кинематики).
III-
постулат Бора
утверждает, что излучение и поглощение
одной порции энергии или иначе кванта
энергии происходит при кратковременном
перескоке с одной боровской орбиты в
другую
![]() т.к.
т.к.
![]() и
и
![]()
![]() .
Из данных постулатов можно выйти на
спектры
.
Из данных постулатов можно выйти на
спектры
![]() ,
здесь q1=-e,
q2=ze,
а r
= rn.
Запишем ещё
,
здесь q1=-e,
q2=ze,
а r
= rn.
Запишем ещё
![]() и приравняем правые части, получим
и приравняем правые части, получим
![]() выразим
выразим
![]() разделим это выражение на
разделим это выражение на
![]() получим
получим
![]() где n=
1,2,3… Получается
где n=
1,2,3… Получается
![]() где n=
1,2,3…
где n=
1,2,3…
![]() то
то
![]() Выведем формулу для r
т.к.
Выведем формулу для r
т.к.
![]() то
то
![]() т.е.
т.е.
![]()
![]() то
то
![]()
![]()
![]()


![]()
![]()
![]()
![]() для
водорода z=1,
то
для
водорода z=1,
то
![]()
![]() (*)
(*)![]() Для
описания состояния электрона в атоме
удобно использовать энергетическую
диаграмму. Из (*) следует: E1=-13,6
эв, то E2=-3,4
E1=-1,51эв
E1=-0,75эв
…если n=∞,
то E∞=0.
Энергетическая диаграмма – это одноосная
диаграмма min
энергия E1(см.
рис) Из III
постулата следует что
Для
описания состояния электрона в атоме
удобно использовать энергетическую
диаграмму. Из (*) следует: E1=-13,6
эв, то E2=-3,4
E1=-1,51эв
E1=-0,75эв
…если n=∞,
то E∞=0.
Энергетическая диаграмма – это одноосная
диаграмма min
энергия E1(см.
рис) Из III
постулата следует что
![]()
![]() заменим
заменим
![]()
![]() R-
постоянная Ридберга, R=1,09677*107
м-1.
По теории Бора электрон может находиться
в одной из стационарных орбит. Для того
чтобы атом начал испускать надо его
возбудить, т.е. передать какую-то энергию
за счет какого-то процесса. атом находится
в возб. сост. некоторое время
R-
постоянная Ридберга, R=1,09677*107
м-1.
По теории Бора электрон может находиться
в одной из стационарных орбит. Для того
чтобы атом начал испускать надо его
возбудить, т.е. передать какую-то энергию
за счет какого-то процесса. атом находится
в возб. сост. некоторое время
![]() .
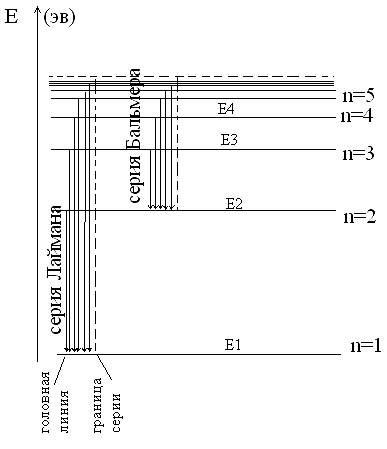
Излучение или поглощение происходит
при переходе с одной стац. орбиты в
другую (по III
постулату). Все переходы с какого-то
верхнего уровня на самый нижний формируют
серию спектральных линий, которая была
предсказана Бором и экспериментально
обнаружен в 1903 г. Лайманом, а все переходы
с верхних на второй уровень формирует
серию линий, часть которых находится в
видимой области – серия Бальмера.
Следующая серия была исследована Пашеном
в 1913 г. – серия Пашена. Для атомарного
водорода: серия Лаймана к→1
.
Излучение или поглощение происходит
при переходе с одной стац. орбиты в
другую (по III
постулату). Все переходы с какого-то
верхнего уровня на самый нижний формируют
серию спектральных линий, которая была
предсказана Бором и экспериментально
обнаружен в 1903 г. Лайманом, а все переходы
с верхних на второй уровень формирует
серию линий, часть которых находится в
видимой области – серия Бальмера.
Следующая серия была исследована Пашеном
в 1913 г. – серия Пашена. Для атомарного
водорода: серия Лаймана к→1
![]()
![]()
![]() ;
серия Бальмера: к→2
;
серия Бальмера: к→2
![]()
![]() ,
где 3646 – длина граничной линии, а вторая
головной. Серия Б. расположена в видимой
и ближней к ней УФ части спектра; серия
Пашена: к→3
,
где 3646 – длина граничной линии, а вторая
головной. Серия Б. расположена в видимой
и ближней к ней УФ части спектра; серия
Пашена: к→3
![]()
![]() Серия П. располагается в ближней ИК
области спектра и т.д. Рассмотрим вопрос
о заселенности энергетич. уровней, и о
невозможности получения серии Бальмера
поглощения в обычных условиях.
распределение ч-ц по эенргетич. уровням
выражается ф-лой Больцмана. если атом
возбужден, то
Серия П. располагается в ближней ИК
области спектра и т.д. Рассмотрим вопрос
о заселенности энергетич. уровней, и о
невозможности получения серии Бальмера
поглощения в обычных условиях.
распределение ч-ц по эенргетич. уровням
выражается ф-лой Больцмана. если атом
возбужден, то
![]() -
распределение по энергии Больцмана,
-
распределение по энергии Больцмана,
![]() Т=300 К, кТ=0,025 эВ Е2-Е1=10,2
эВ
Т=300 К, кТ=0,025 эВ Е2-Е1=10,2
эВ![]() т.о.
даже второй уровень практически не
заселен. Рассмотрим вопрос о поглощении
света. Серия Лаймана проявляется в
поглощении водородом находящемся при
комнатной температуре, потому что очень
велика заселенность нижнего Лаймановского
уровня, а это – осн. условие возможности
поглощения. Второе условие состоит в
том, чтобы в пучке излучения содержались
кванты соответствующих энергий. Серию
в которой проявляется поглощение
называют главн.серией. Серия Бальмера
не проявляется в поглощении при комн.
тем-рах, потому что бальмеровский уровень
при комнатной тем-ре оказ-ся незаселенным.
т.о.
даже второй уровень практически не
заселен. Рассмотрим вопрос о поглощении
света. Серия Лаймана проявляется в
поглощении водородом находящемся при
комнатной температуре, потому что очень
велика заселенность нижнего Лаймановского
уровня, а это – осн. условие возможности
поглощения. Второе условие состоит в
том, чтобы в пучке излучения содержались
кванты соответствующих энергий. Серию
в которой проявляется поглощение
называют главн.серией. Серия Бальмера
не проявляется в поглощении при комн.
тем-рах, потому что бальмеровский уровень
при комнатной тем-ре оказ-ся незаселенным.
П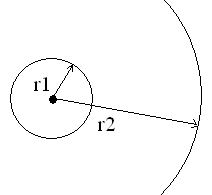 о
квантовой теории состояние электрона
в атоме хар-ся не одним квантовым числом,
несколькими. рассмотрим эти квант.
числа. 1.
главное квантовое число
– n.
Во многоэлектронной оболочке электроны
группируются слоями, в пределах одного
слоя эл-ны имеют примерно одинаковую
энергию. Гл. кв. число хар-ет принадлежность
эл-на к данному слою и вместе с тем хар-ет
осн. часть энергии эл-на
о
квантовой теории состояние электрона
в атоме хар-ся не одним квантовым числом,
несколькими. рассмотрим эти квант.
числа. 1.
главное квантовое число
– n.
Во многоэлектронной оболочке электроны
группируются слоями, в пределах одного
слоя эл-ны имеют примерно одинаковую
энергию. Гл. кв. число хар-ет принадлежность
эл-на к данному слою и вместе с тем хар-ет
осн. часть энергии эл-на
![]() если 1 то К-оболочка, если 2, то L-оболочка,
и т.д. M,
N,
O.
2. Азимутальное
кв. число –
l(эл).
При данном значении n:
если 1 то К-оболочка, если 2, то L-оболочка,
и т.д. M,
N,
O.
2. Азимутальное
кв. число –
l(эл).
При данном значении n:
![]() (n-значений)
при 0 – s-состояние,
при 1- p-состояние,
и т.д. d,
f.
(n-значений)
при 0 – s-состояние,
при 1- p-состояние,
и т.д. d,
f.
![]() ,
,
![]() -
момент импульса орбитального движения
Эта формула выражает квантование момента
импульса. 3.
«магнитное» квант. число орбитального
движения-
-
момент импульса орбитального движения
Эта формула выражает квантование момента
импульса. 3.
«магнитное» квант. число орбитального
движения-![]() При
данном значении l
может принимать одно из значений:
При
данном значении l
может принимать одно из значений:
![]() где
(2l+1)
различных значений
где
(2l+1)
различных значений
![]()
![]() -
проекция вектора
-
проекция вектора![]() на
преимущественное направление. Таким
преимущ-м напр-м может явл-ся направление
внешнего магнитного поля (или внутр.).
Оказывается вектор момента импульса
орбитального движения
на
преимущественное направление. Таким
преимущ-м напр-м может явл-ся направление
внешнего магнитного поля (или внутр.).
Оказывается вектор момента импульса
орбитального движения
![]() во
внешнем поле может быть ориентирован
в пространстве только в нескольких
строго определенных избранных
направлениях. Другие направления простр.
ориентации оказываются запрещенными.
4. спиновое
квантовое число – S.
S=1/2
во
внешнем поле может быть ориентирован
в пространстве только в нескольких
строго определенных избранных
направлениях. Другие направления простр.
ориентации оказываются запрещенными.
4. спиновое
квантовое число – S.
S=1/2
![]() где
где
![]() -
спин электрона или момент импульса
собственного движения эл-на. Понятие
спина выдвинули в 1925 году Уленбек и
Гаудстит. 5.
магнитое квантовое число
-
-
спин электрона или момент импульса
собственного движения эл-на. Понятие
спина выдвинули в 1925 году Уленбек и
Гаудстит. 5.
магнитое квантовое число
-
![]() .
при данном S=1/2:
.
при данном S=1/2:
![]()
![]() эта формула выражает явление
пространственного квантования спина.
Существ. 2 возможных направления
ориентации спинового момента.
эта формула выражает явление
пространственного квантования спина.
Существ. 2 возможных направления
ориентации спинового момента.![]()
![]() Если преписать этому явлению клссическую
модель, то надо предположить, что наряду
с орбит. Движением существует ещё и
собственное, подобное суточному вращению
планеты (Земли). 6.
внутреннее кв. число –J.
При данных
l
и s
может принимать
Если преписать этому явлению клссическую
модель, то надо предположить, что наряду
с орбит. Движением существует ещё и
собственное, подобное суточному вращению
планеты (Земли). 6.
внутреннее кв. число –J.
При данных
l
и s
может принимать
![]() - здесь (2s+1)
различных значений. Пусть l=1,
s=1/2
J=1/2;
3/2.
- здесь (2s+1)
различных значений. Пусть l=1,
s=1/2
J=1/2;
3/2.
![]()
![]() -определяет
суммарный мех. момент импульса орбитального
и спинового дв-я электрона. 7.
магнитное квантовое число суммарного
момента импульса. -
-определяет
суммарный мех. момент импульса орбитального
и спинового дв-я электрона. 7.
магнитное квантовое число суммарного
момента импульса. -![]()
![]() здесь
здесь
![]() -значений.
-значений.
![]() где
где![]() -
проекция суммарного мех.момента на
преимущественное направление. Она
выражает явление пространственного
квантования суммарного момента импульса.
Теория Бора хорошо описывает спектры
атомарного водорода и изоэлектронного
ряда, также состояния электрона. Однако
теория Бора оказалось не в состоянии
описать оптические спектры ни одного
другого атома гелия, лития и др. Значит
поведение эл-в во многоэлктронной
системе взаимодействующих эл-в подчиняется
каким-то другим законам. Эти законы были
раскрыты квантовой механикой. Одним из
важных принципов явл-ся принцип Паули.
Принцип Паули утверждает, что в
многоэлектроноой системе взаимодействующих
электронов не может быть одинаковых
электронов. хотя бы одной из своих
квантовых характеристик электроны
должны различаться. А этими характеристиками
явл-ся 4 квантовых числа: n,
l,
-
проекция суммарного мех.момента на
преимущественное направление. Она
выражает явление пространственного
квантования суммарного момента импульса.
Теория Бора хорошо описывает спектры
атомарного водорода и изоэлектронного
ряда, также состояния электрона. Однако
теория Бора оказалось не в состоянии
описать оптические спектры ни одного
другого атома гелия, лития и др. Значит
поведение эл-в во многоэлктронной
системе взаимодействующих эл-в подчиняется
каким-то другим законам. Эти законы были
раскрыты квантовой механикой. Одним из
важных принципов явл-ся принцип Паули.
Принцип Паули утверждает, что в
многоэлектроноой системе взаимодействующих
электронов не может быть одинаковых
электронов. хотя бы одной из своих
квантовых характеристик электроны
должны различаться. А этими характеристиками
явл-ся 4 квантовых числа: n,
l,
![]() ,
,
![]() .Можно
подсчитать сколько возможных значений
различных состояний при данном n.
Оказалось
.Можно
подсчитать сколько возможных значений
различных состояний при данном n.
Оказалось
![]() где
где![]() -число
разл. состояний при фиксированном гл.
кв. числе. Принцип Паули объясняет
закономерности таблицы Менделеева.
Основная закономерность – это
периодичность хим. и оптич. свойств. И
те и др. определяются состоянием валентных
внешних электронов. Периодичность св-в
эл-в таблицы Менделеева можно понять
исходя из принципа Паули и учитывая,
что при переходе от данного элемента к
следующему появляется ещё один электрон.
Если при этом застройка данной оболочки
заканчивается, то возникает очень
прочная система взаимодействующих
эл-в, такие атомы плохо взаимодействуют
с др. атомами – это инертные газы(аргон,
гелий и т.д.). В атоме следующего элемента
появляется единственный электрон во
внешней оболочке, который активно
участвует в химических процессах и в
образовании спектров (Li,
K,
Cu).
Рассмотрим структуру таблицы Менделеева
исходя из пр. Паули. n=1-
одноквантовая оболочка (K-оболочка)
l=0,
-число
разл. состояний при фиксированном гл.
кв. числе. Принцип Паули объясняет
закономерности таблицы Менделеева.
Основная закономерность – это
периодичность хим. и оптич. свойств. И
те и др. определяются состоянием валентных
внешних электронов. Периодичность св-в
эл-в таблицы Менделеева можно понять
исходя из принципа Паули и учитывая,
что при переходе от данного элемента к
следующему появляется ещё один электрон.
Если при этом застройка данной оболочки
заканчивается, то возникает очень
прочная система взаимодействующих
эл-в, такие атомы плохо взаимодействуют
с др. атомами – это инертные газы(аргон,
гелий и т.д.). В атоме следующего элемента
появляется единственный электрон во
внешней оболочке, который активно
участвует в химических процессах и в
образовании спектров (Li,
K,
Cu).
Рассмотрим структуру таблицы Менделеева
исходя из пр. Паули. n=1-
одноквантовая оболочка (K-оболочка)
l=0,
![]() =0,
=0,
![]() =±1/2
(почему см. выше).т.о. n=1,
l=0,
=±1/2
(почему см. выше).т.о. n=1,
l=0,
![]() =0,
=0,
![]() =±1/2-всего
2 состояния.
n=2-
двухквантовая оболочка (L-оболочка)
здесь уже
l=0,1,
если l=0,
то
=±1/2-всего
2 состояния.
n=2-
двухквантовая оболочка (L-оболочка)
здесь уже
l=0,1,
если l=0,
то
![]() =0,
=0,
![]() =±1/2
– 2 состояния за счет пространственного
квантования спина,
а если l=1,
то
=±1/2
– 2 состояния за счет пространственного
квантования спина,
а если l=1,
то
![]() =1,
0, -1;
=1,
0, -1;
![]() =±1/2
– 6 состояний p-состояние
(p-электрон).Значит
для двух атомной оболочки:
=±1/2
– 6 состояний p-состояние
(p-электрон).Значит
для двух атомной оболочки:
![]() (здесь
1-это К-оболочка, а 2 - L-оболочка).
n=3-
трехквантовая оболочка (M-оболочка)
(здесь
1-это К-оболочка, а 2 - L-оболочка).
n=3-
трехквантовая оболочка (M-оболочка)
![]() (здесь
1-это К-оболочка, 2 - L-оболочка,
3 - M-оболочка(помещается
18 электронов)).
(здесь
1-это К-оболочка, 2 - L-оболочка,
3 - M-оболочка(помещается
18 электронов)).
Демонстрационные и компьютерные эксперименты при изучении атомной физики
Демонстрационный эксперимент должен являться основной составляющей экспериментального курса физики, как правило, все основные физические понятия должны демонстрироваться на опыте. Хороший демонстрационный опыт, проведенный во время теоретического изложения и отражающий физическое явление, позволяет преодолеть часто возникающий на начальной стадии обучения формальный подход к физике. Демонстрационные опыты, как известно, формируются накопленные ранее предварительные представления, которые к началу изучения физики далеки и у всех учащихся бывают одинаковыми и безупречными. На протяжении всего курса изучения физики эти опыты накопляют и расширяют кругозор учащихся. Они зарождают правильные начальные представления о новых физических явлениях и процессах, раскрывают закономерности, знакомят с методами исследования, показывают устройство и действия некоторых новых приборов и установок, иллюстрируют практическое применение физических законов. Все это конкретизирует, делает более понятным и убедительным теоретическое изучение материала, возбуждает и поддерживает интерес к физике.
Однако поставить реальную демонстрацию по атомной физике довольно-таки сложно по причине опасности проведения для здоровья человека.
Существуют два выхода из такой ситуации:
1.Для обеспечения наглядности при изучении физики широко применяют “материальные” модели, в которых рассматриваются не сами изучаемые явления, а их аналоги.
Этот метод хорошо может применяться при изучении атомной физики. Примером такой демонстрации может служить аналогия строения атомного ядра и беспорядочного расположения детей (в равных количествах мальчиков и девочек) в центральном круге баскетбольной площадки.
Мальчики будут олицетворять протоны, а девочки нейтроны. Если же попросить детей собраться в кучки мальчики с мальчиками, а девочки с девочками, тогда в сутолоке они начнут толкаться и строй вытянется в овал, что является аналогией деления ядер.
Ещё одним примером такой модели может бать капельная модель ядра, где строение ядра рассматривается как капля жидкости.
Данные модели являются не плохой альтернативой для показа демонстраций. Однако главным минусом модельного эксперимента является то, что не ко всему можно сделать аналогию и механические модели искажают свойства микромира.
2. Для того, что бы показать любой эксперимент по атомной физике во всей его полноте прибегают к компьютерному моделированию.
С точки зрения преподавателя очевидное, лежащее на поверхности достоинство компьютерного моделирования заключается в возможности создавать впечатляющие и запоминающиеся зрительные образы. Такие наглядные образы способствуют пониманию изучаемого явления и запоминанию важных деталей в гораздо большей степени, нежели соответствующие математические уравнения. Моделирование позволяет придать наглядность абстрактным законам и концепциям, привлечь внимание учащихся к тонким деталям изучаемого явления, ускользающим при непосредственном наблюдении. Графическое отображение результатов моделирования на экране компьютера одновременно с анимацией изучаемого явления или процесса позволяет учащимся легко воспринимать большие объемы содержательной информации.
§3 Требования к электронному учебнику
Требования к текстовой информации.
Электронный учебник должен содержать только минимум текстовой информации, в связи с тем, что длительное чтение текста с экрана приводит к значительному утомлению и как следствие к снижению восприятия и усвоения знаний. Существенное значение имеет размер и начертание шрифта. Электронный вариант учебника позволяет выделить отдельные слова или фразы цветом и фоном, что улучшает наглядность, позволяет акцентировать внимание на главном. Электронный учебник должен содержать гиперссылки по элементам учебника и возможно иметь ссылки на другие электронные учебники и справочники. Желательно иметь содержание с быстрым переходом на нужную страницу.
Требования к графической информации.
Электронный учебник должен содержать большое количество иллюстративного материала. Причем, графические изображения должны быть как можно более просто оформлены (не более чем девять линий и одно понятие на одно изображение) и соответствовать размерам экрана или окна на экране. Что следует показывать графически:
– последовательные кадры, рисунки, которые показывают движение, причинные связи или структуру, диаграммы процессов, временные графики;
– диаграммы или рисунки, на которых опущены определенные частности для
того, чтобы выделить особенности изображаемого явления, такие как сечения, чертежи, рисунки машин;
– качественное представление числовых данных, такое как линейные графики, диаграммы, пиктограммы;
– физические, политические и специализированные карты;
– диаграммы или рисунки, на которых опущены определенные частности для того, чтобы выделить особенности изображаемого явления, такие как сечения, чертежи, рисунки машин;
– таблицы и диаграммы или разного рода матричные представления словесных и числовых данных, такие как расписания, таблицы спортивных результатов, диаграммы для сравнения;
– статические фотографии, которые хороши для привлечения внимания, демонстрации подлинников, введения в контекст.
Использование видеофрагментов позволяет передать в динамике процессы и явления. Несмотря на большие размеры файлов, применять их целесообразно, т.к. восприятие и заинтересованность студентов повышаются и как следствие, улучшается качество знаний.
Требования к компоновке учебного материала.
Исключительное дидактическое значение имеет компоновка текстового, графического и другого материала. Качество восприятия новой информации, возможность обобщения и анализа, скорость запоминания, полнота усвоения учебной информации в значительной мере зависят как от расположения информации на странице (экране компьютера), так и от последовательности идущих друг за другом страниц. Ведь, в отличие от печатного издания, в котором можно одновременно "заглядывать" в две страницы, держа промежуточные страницы в руках, в электронном учебнике это сделать невозможно. Но в связи с вышесказанным, электронный учебник должен позволять делать закладки в любом месте, отображать список закладок, отсортировав их в любом порядке. В электронном учебнике должен быть список рекомендованной литературы, изданной традиционным, печатным способом. Список литературы может быть дополнен не только ссылками на статьи в журналах, сборниках научных конференций и др., но также и на электронные публикации, размещенные на серверах учебного заведения или в сети Internet.
