
- •Федеральное государственное бюджетное образовательное учреждение высшего
- •Рецензент:
- •Общие методические указания
- •Лабораторная работа №1 Тема: Правила безопасности при работе в лаборатории общей химии. Элементы техники лабораторных работ. Весы и взвешивание
- •1.1 Техника безопасности при работе в лаборатории общей химии
- •1.2 Помощь при несчастных случаях
- •1.3 Правила обращения с реактивами
- •1.4 Химическая посуда и оборудование. Элементы техники лабораторных работ
- •1.4.1 Весы и взвешивание
- •1.4.2 Правила обращения с весами
- •1.4.3 Взвешивание цинка на аналитических весах
- •1.5 Необходимый уровень подготовки студентов
- •1.6 Вопросы для самоконтроля
- •Лабораторная работа №2 Тема: Определение молярной массы эквивалента цинка
- •2.1 Теоретические пояснения
- •2.2 Методика проведения опыта
- •2.3 Обработка результатов опыта
- •2.4 Примеры решения задач
- •2.5 Необходимый уровень подготовки студентов
- •2.6 Задания для самоконтроля
- •Тема: Основные классы неорганических соединений: оксиды, основания и амфотерные гидроксиды
- •3.1 Теоретические пояснения
- •3.2 Методика проведения опытов
- •3.2.1 Оксиды их получение и свойства
- •3.2.2 Гидроксиды, их получение и свойства
- •Лабораторная работа №4 Тема: Основные классы неорганических соединений: кислоты и соли
- •4.1 Теоретические пояснения
- •4.2 Методика проведения опытов
- •4.2.1 Кислоты, их получение и свойства
- •4.2.2 Соли, их получение и свойства
- •Опыт 5: Получение солей взаимодействием двух солей
- •4.3 Необходимый уровень подготовки студентов
- •4. Уметь писать уравнения реакций, отражающие химические свойства оксидов, гидроксидов, солей. Знать условия протекания до конца реакций ионного обмена
- •4.4 Задания для самоконтроля
- •Лабораторная работа №5 Тема: Кинетика химических реакций
- •5.1 Теоретические пояснения
- •5.2 Методика проведения опытов
- •5.3 Примеры решения задач
- •5.4 Необходимый уровень подготовки студентов
- •5.5 Задания для самоконтроля
- •Лабораторная работа №6 Тема: Химическое равновесие
- •6.1 Теоретические пояснения
- •6.2 Методика проведения опыта
- •6.3 Примеры решения задач
- •6.4 Необходимый уровень подготовки студентов
- •6.5 Задания для самоконтроля
- •Лабораторная работа №7 Тема: Синтез и исследование свойств координационных соединений
- •7.1 Теоретические пояснения
- •7.2 Методика проведения опытов
- •7.3 Необходимый уровень подготовки студентов
- •7.4 Задания для самоконтроля
- •Лабораторная работа №8 Тема: Приготовление растворов заданной концентрации
- •8.1 Теоретические пояснения
- •8.2 Методика проведения опыта
- •8.3 Примеры решения задач
- •8.4 Необходимый уровень подготовки студентов
- •8.5 Задания для самоконтроля
- •Лабораторная работа № 9 Тема: Гидролиз солей
- •9.1 Теоретические пояснения
- •Смещение равновесия в процессах гидролиза солей
- •9.2 Методика проведения опытов
- •8.3 Задания для самоконтроля
- •8.4 Примеры решения задач
- •8.5 Необходимый уровень подготовки студентов
- •Лабораторная работа №10 Тема: Окислительно-восстановительные реакции
- •10.1 Теоретические пояснения
- •10.2 Методика проведения опытов
- •10.3 Необходимый уровень подготовки студентов
- •10.4 Задания для самоконтроля
- •Лабораторная работа №11 Тема: Электрохимический ряд напряжений металлов
- •11.1 Теоретические пояснения
- •11.2 Методика проведения опытов
- •11.4 Задания для самоконтроля
- •Лабораторная работа № 12 Тема:Гальванический элемент
- •12.1 Теоретические пояснения
- •12.2 Методика проведения опыта
- •12.3 Необходимый уровень подготовки студентов
- •12.4 Задания для самоконтроля
- •Лабораторная работа №13 Тема: Изучение свойств азотной, серной и ортофосфорной кислот
- •13.1 Теоретические пояснения
- •13.2 Методика проведения опытов
- •13.3 Необходимый уровень подготовки студентов
- •13.4 Задания для самоконтроля
- •Лабораторная работа №14 Тема: Электролиз солей
- •14.1 Теоретические пояснения
- •14.2 Методика проведения опыта
- •14.3 Необходимый уровень подготовки студентов
- •14.4 Задания для самоконтроля
- •Лабораторная работа № 15 Тема: Коррозия металлов. Защита металлов от коррозии
- •15.1 Теоретические пояснения
- •15.2 Методика проведения опыта
- •Опыт 7: Пассивация алюминия.
- •15.3 Необходимый уровень подготовки студентов
- •15.4 Задания для самоконтроля
- •Лабораторная работа №16 Тема: Криоскопический метод определения молекулярной массы растворенного вещества
- •16.1 Теоретические пояснения
- •16.2 Методика проведения опыта
- •4. Толстостенный стакан
- •6,7. Мешалки
- •8. Крышка
- •16.3 Примеры решения задач
- •16.4 Необходимый уровень подготовки студентов
- •16.5 Задания для самоконтроля
- •Лабораторная работа №17 Тема: Определение кажущейся степени диссоциации хлорида калия криоскопическим методом
- •17.1 Теоретические пояснения
- •17.2 Методика проведения опыта
- •4. Толстостенный стакан
- •6,7. Мешалки
- •8. Крышка
- •17.3 Примеры решения задач
- •17.4 Необходимый уровень подготовки студентов
- •17.5 Задания для самоконтроля
- •Содержание
- •Лукашов Сергей Викторович
- •Методические указания по выполнению лабораторных работ
- •241037. Г. Брянск, пр. Станке Димитрова, 3, редакционно-издательский
1.6 Вопросы для самоконтроля
1. Почему нельзя выливать в раковину концентрированные растворы кислот и щелочей, органические растворители, выбрасывать остатки щелочных металлов?
2. Какую последовательность следует соблюдать при приготовлении разбавленного раствора из концентрированной серной кислоты?
3. Почему запрещается проводить опыты в грязной посуде?
4. Что нужно предпринять при попадании капель концентрированной кислоты или щелочи на кожу?
5. Нарисуйте схему частей пламени спиртовки или горелки. В какой части пламени температура максимальна?
6. Какие правила необходимо соблюдать при нагревании жидкости в пробирке на пламени спиртовки и в стакане на электроплитке?
7. Какую посуду называют мерной, для чего она используется?
8. Какая фарфоровая посуда используется в лаборатории, и для каких целей?
9. Какие способы проведения фильтрования вы знаете?
10. Что такое арретир, для чего он нужен в весах?
Лабораторная работа №2 Тема: Определение молярной массы эквивалента цинка
Цель работы: познакомиться с понятием химического эквивалента, определить молярную массу химического эквивалента цинка методом вытеснения водорода.
Оборудование и реактивы: прибор для определения молярной массы эквивалента металла (см. рис. 1), термометр, барометр, 25%-ный раствор соляной кислоты, металлический цинк.
2.1 Теоретические пояснения
Химическим эквивалентом (Э) называется реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом эквивалентна (равноценна) одному иону водорода в кислотно-основных и обменных реакциях, либо одному электрону в окислительно-восстановительных реакциях.
Реальные частицы - это атомы, ионы, молекулы и т.д., а условные частицы - это, например, 1/2 (H2SO4), 1/4( С), 1/3( Fe3+).
В общем случае эквивалент любого вещества X может быть записан в виде ЭХ =1/z(X), где z - число эквивалентности, или эквивалентное число, которое всегда > 1. Оно показывает, сколько эквивалентов содержится в одной формульной единице вещества.
Для данного вещества z находится по конкретной реакции. В окислительно-восстановительных процессах z определяется числом электронов, принятых или отданных одной формульной единицей вещества, например, в реакции:
Mg + 2HCl → MgCl2 + H2
Z(Mg)=2, т.к. магний в ходе окислительно-восстановительной реакции отдает 2 электрона, а ЭMg =½ (Mg). В обменных процессах Z определяется стехиометрией и равно знаменателю правильной дроби, которая получается при делении коэффициента перед веществом на самый большой коэффициент в реакции:
АI2O3 + 6HCI =2AICI3 +3H2O
Z
(АI2O3)
= 6, т.к. при делении коэффициента перед
АI2O3
на
самый большой коэффициент в реакции -
6, получается правильная дробь
 ,
знаменатель которой равен 6;Z(HCI)
=
1, т.к. при делении коэффициента перед
HCI
на самый большой коэффициент в реакции
- 6, получается 1.
,
знаменатель которой равен 6;Z(HCI)
=
1, т.к. при делении коэффициента перед
HCI
на самый большой коэффициент в реакции
- 6, получается 1.
Когда речь не идет о конкретной реакции, при определении z для сложных веществ можно воспользоваться следующими правилами:
1) для оксидов z равно числу атомов элемента, умноженному на степень окисления элемента;
2) для кислот z равно основности кислоты;
3) для оснований z равно кислотности основания;
4) для солей z равно числу катионов металла, умноженному на заряд катиона.
Количество вещества эквивалента обозначается vЭ, единица измерения - моль. Один моль эквивалента вещества содержит 6,022-1023 эквивалентов.
Молярная масса эквивалента MЭ - это масса 1 моль эквивалентов вещества, измеряется в г/моль.
Связь между молярной массой эквивалента, количеством вещества эквивалента, массой и молярной массой вещества выражается соотношениями:


Экспериментальное определение молярной массы химического эквивалента цинка в данной работе основано на законе эквивалентов:
Вещества
реагируют друг с другом в равных
количествах эквивалентов
 .
.
Из закона эквивалентов следует, что массы реагирующих друг с другом веществ, а также массы продуктов реакции относятся друг к другу как молярные массы их эквивалентов:

Если
вещество находится в газообразном
состоянии то для него справедливы
соотношения: ;
;
 ;
где
;
где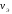 –
количество вещества эквивалента;V–
объем газообразного вещества в данных
условиях;
–
количество вещества эквивалента;V–
объем газообразного вещества в данных
условиях;
 –
молярный объем эквивалента вещества в
тех же условиях;VM
–
молярный объем вещества; Z–
число эквивалентности.
–
молярный объем эквивалента вещества в
тех же условиях;VM
–
молярный объем вещества; Z–
число эквивалентности.
