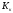- •Федеральное государственное бюджетное образовательное учреждение высшего
- •Рецензент:
- •Общие методические указания
- •Лабораторная работа №1 Тема: Правила безопасности при работе в лаборатории общей химии. Элементы техники лабораторных работ. Весы и взвешивание
- •1.1 Техника безопасности при работе в лаборатории общей химии
- •1.2 Помощь при несчастных случаях
- •1.3 Правила обращения с реактивами
- •1.4 Химическая посуда и оборудование. Элементы техники лабораторных работ
- •1.4.1 Весы и взвешивание
- •1.4.2 Правила обращения с весами
- •1.4.3 Взвешивание цинка на аналитических весах
- •1.5 Необходимый уровень подготовки студентов
- •1.6 Вопросы для самоконтроля
- •Лабораторная работа №2 Тема: Определение молярной массы эквивалента цинка
- •2.1 Теоретические пояснения
- •2.2 Методика проведения опыта
- •2.3 Обработка результатов опыта
- •2.4 Примеры решения задач
- •2.5 Необходимый уровень подготовки студентов
- •2.6 Задания для самоконтроля
- •Тема: Основные классы неорганических соединений: оксиды, основания и амфотерные гидроксиды
- •3.1 Теоретические пояснения
- •3.2 Методика проведения опытов
- •3.2.1 Оксиды их получение и свойства
- •3.2.2 Гидроксиды, их получение и свойства
- •Лабораторная работа №4 Тема: Основные классы неорганических соединений: кислоты и соли
- •4.1 Теоретические пояснения
- •4.2 Методика проведения опытов
- •4.2.1 Кислоты, их получение и свойства
- •4.2.2 Соли, их получение и свойства
- •Опыт 5: Получение солей взаимодействием двух солей
- •4.3 Необходимый уровень подготовки студентов
- •4. Уметь писать уравнения реакций, отражающие химические свойства оксидов, гидроксидов, солей. Знать условия протекания до конца реакций ионного обмена
- •4.4 Задания для самоконтроля
- •Лабораторная работа №5 Тема: Кинетика химических реакций
- •5.1 Теоретические пояснения
- •5.2 Методика проведения опытов
- •5.3 Примеры решения задач
- •5.4 Необходимый уровень подготовки студентов
- •5.5 Задания для самоконтроля
- •Лабораторная работа №6 Тема: Химическое равновесие
- •6.1 Теоретические пояснения
- •6.2 Методика проведения опыта
- •6.3 Примеры решения задач
- •6.4 Необходимый уровень подготовки студентов
- •6.5 Задания для самоконтроля
- •Лабораторная работа №7 Тема: Синтез и исследование свойств координационных соединений
- •7.1 Теоретические пояснения
- •7.2 Методика проведения опытов
- •7.3 Необходимый уровень подготовки студентов
- •7.4 Задания для самоконтроля
- •Лабораторная работа №8 Тема: Приготовление растворов заданной концентрации
- •8.1 Теоретические пояснения
- •8.2 Методика проведения опыта
- •8.3 Примеры решения задач
- •8.4 Необходимый уровень подготовки студентов
- •8.5 Задания для самоконтроля
- •Лабораторная работа № 9 Тема: Гидролиз солей
- •9.1 Теоретические пояснения
- •Смещение равновесия в процессах гидролиза солей
- •9.2 Методика проведения опытов
- •8.3 Задания для самоконтроля
- •8.4 Примеры решения задач
- •8.5 Необходимый уровень подготовки студентов
- •Лабораторная работа №10 Тема: Окислительно-восстановительные реакции
- •10.1 Теоретические пояснения
- •10.2 Методика проведения опытов
- •10.3 Необходимый уровень подготовки студентов
- •10.4 Задания для самоконтроля
- •Лабораторная работа №11 Тема: Электрохимический ряд напряжений металлов
- •11.1 Теоретические пояснения
- •11.2 Методика проведения опытов
- •11.4 Задания для самоконтроля
- •Лабораторная работа № 12 Тема:Гальванический элемент
- •12.1 Теоретические пояснения
- •12.2 Методика проведения опыта
- •12.3 Необходимый уровень подготовки студентов
- •12.4 Задания для самоконтроля
- •Лабораторная работа №13 Тема: Изучение свойств азотной, серной и ортофосфорной кислот
- •13.1 Теоретические пояснения
- •13.2 Методика проведения опытов
- •13.3 Необходимый уровень подготовки студентов
- •13.4 Задания для самоконтроля
- •Лабораторная работа №14 Тема: Электролиз солей
- •14.1 Теоретические пояснения
- •14.2 Методика проведения опыта
- •14.3 Необходимый уровень подготовки студентов
- •14.4 Задания для самоконтроля
- •Лабораторная работа № 15 Тема: Коррозия металлов. Защита металлов от коррозии
- •15.1 Теоретические пояснения
- •15.2 Методика проведения опыта
- •Опыт 7: Пассивация алюминия.
- •15.3 Необходимый уровень подготовки студентов
- •15.4 Задания для самоконтроля
- •Лабораторная работа №16 Тема: Криоскопический метод определения молекулярной массы растворенного вещества
- •16.1 Теоретические пояснения
- •16.2 Методика проведения опыта
- •4. Толстостенный стакан
- •6,7. Мешалки
- •8. Крышка
- •16.3 Примеры решения задач
- •16.4 Необходимый уровень подготовки студентов
- •16.5 Задания для самоконтроля
- •Лабораторная работа №17 Тема: Определение кажущейся степени диссоциации хлорида калия криоскопическим методом
- •17.1 Теоретические пояснения
- •17.2 Методика проведения опыта
- •4. Толстостенный стакан
- •6,7. Мешалки
- •8. Крышка
- •17.3 Примеры решения задач
- •17.4 Необходимый уровень подготовки студентов
- •17.5 Задания для самоконтроля
- •Содержание
- •Лукашов Сергей Викторович
- •Методические указания по выполнению лабораторных работ
- •241037. Г. Брянск, пр. Станке Димитрова, 3, редакционно-издательский
Опыт 7: Пассивация алюминия.
В пробирку поместить кусочек алюминия и прилить 2 – 3 мл концентрированной азотной кислоты. Через 3 – 4 минуты кислоту слить, промыть металл водой и подействовать на него 2н раствором соляной кислоты. Почему теперь алюминий не растворяется в соляной кислоте?
Опыт 8: Протекторная защита металла.
В две пробирки налейте (1/2 объема) 0,4 М раствора уксусной кислоты и добавьте в каждую несколько капель раствора иодида калия. В одну пробирку поместите пластинку свинца, а в другую пластинку свинца, соединенную с цинковой пластинкой. Наблюдайте, в какой из пробирок быстрее появится желтое окрашивание.
Объясните наблюдаемые явления. Приведите схемы катодного и анодного процессов, составьте схемы коррозионных элементов.
15.3 Необходимый уровень подготовки студентов
Знать, что называется коррозией металлов, какие существуют ее виды, в чем их отличие.
Знать причины возникновения коррозионных микрогальванических элементов, что такое коррозия с водородной и кислородной деполяризацией.
Уметь писать уравнения анодных и катодных процессов, протекающих при электрохимической коррозии.
Иметь представление о методах защиты металлов от коррозии.
15.4 Задания для самоконтроля
Что называют коррозией металлов?
Какие виды коррозии вы знаете?
В чем отличие электрохимической коррозии от химической?
Чем вызвана электрохимическая неоднородность поверхности металла?
Каковы причины возникновения коррозионных микрогальванических элементов?
Возможна ли коррозия с выделением водорода в растворе, в котором активность Cu2+ равна 10-3 моль/л и рН среды равен 3?
Возможна ли коррозия меди с поглощением кислорода на воздухе в растворе, в котором активность Cu2+ равна 10-4 моль/л, а среда нейтральна?
Как можно снизить скорость коррозии металлов?
Какие защитные покрытия вам известны, и какими методами их получают?
Что такое анодные и катодные защитные покрытия?
Какие вещества называют ингибиторами коррозии?
Лабораторная работа №16 Тема: Криоскопический метод определения молекулярной массы растворенного вещества
Цель работы: определение молекулярных масс криоскопическим методом.
Оборудование и реактивы: прибор для определения молекулярной массы криоскопическим методом (рис. 1): пробирка с боковым отростком, широкая пробирка, толстостенный стакан, термометр Бекмана, мешалки, крышка; аналитические весы с разновесом, мерный цилиндр, шпатель, снег (толченый лед) и хлорид натрия для охладительной смеси, бюкс с 1,2-1,5 г мочевины, дистиллированная вода.
16.1 Теоретические пояснения
При образовании растворов характер взаимодействия компонентов определяется их химической природой, что затрудняет выявление общих закономерностей. Поэтому удобно прибегнуть к некоторой идеализированной модели раствора. Такой раствор, образование которого не связано с тепловым эффектом и с изменением объема называют идеальным раствором.
Хотя большинство растворов и не обладает в полной мере свойствами идеальных, однако свойства многих из них могут быть описаны при помощи этой модели. Наиболее подходящими в этом плане являются разбавленные растворы, в которых содержание растворенного вещества очень мало по сравнению с содержанием растворителя.
Рассмотрим свойства разбавленных растворов, которые зависят от числа частиц растворенного вещества и от количества растворителя, но практически не зависят от природы растворенных частиц (коллигативные свойства).
К таким свойствам относятся: понижение давления насыщенного пара растворителя над раствором, повышение температуры кипения, понижение температуры замерзания раствора по сравнению с чистым растворителем, осмотическое давление.
Согласно закону Рауля, относительное понижение давления насыщенного пара над раствором равно мольной доле растворенного нелетучего вещества:

Повышение температуры кипения и понижение температуры замерзания растворов по сравнению с чистым растворителем, по следствию из закона Рауля прямопропорциональны моляльной концентрации растворенного вещества:

где
 -
изменение температуры,
-
изменение температуры, -
моляльная концентрация (моль/кг),
-
моляльная концентрация (моль/кг),
 -
коэффициент пропорциональности, в
случае повышения температуры кипения
называется эбулиоскопической константой,
а для понижения температуры замерзания
– криоскопической. Эти константы,
численно различные для одного и того
же растворителя, характеризуют повышение
температуры кипения и понижение
температуры замерзания одномоляльного
раствора, т.е. при растворении 1 моль
электролита в 1000 г растворителя. Поэтому
их часто называют моляльным повышением
температуры кипения и понижением
температуры замерзания раствора.
Криоскопические и эбулиоскопические
константы не зависят от природы
растворенного вещества, а лишь зависят
от природы растворителя и характеризуются
размерность
-
коэффициент пропорциональности, в
случае повышения температуры кипения
называется эбулиоскопической константой,
а для понижения температуры замерзания
– криоскопической. Эти константы,
численно различные для одного и того
же растворителя, характеризуют повышение
температуры кипения и понижение
температуры замерзания одномоляльного
раствора, т.е. при растворении 1 моль
электролита в 1000 г растворителя. Поэтому
их часто называют моляльным повышением
температуры кипения и понижением
температуры замерзания раствора.
Криоскопические и эбулиоскопические
константы не зависят от природы
растворенного вещества, а лишь зависят
от природы растворителя и характеризуются
размерность .
Ниже приведены криоскопические
.
Ниже приведены криоскопические и эбулиоскопические
и эбулиоскопические константы
для некоторых растворителей:
константы
для некоторых растворителей:
|
Растворитель |
Температура, 0С |
Константа,
| ||
|
Кипения |
Плавления |
|
| |
|
Н2О |
100 |
0 |
0,52 |
1,86 |
|
С6Н6 |
80,1 |
5,5 |
2,53 |
5,12 |
|
ССI4 |
76,5 |
-22 |
5,03 |
30,0 |
|
СНСI3 |
61,7 |
-63,5 |
3,63 |
4,7 |
Криоскопия и эбулиоскопия – методы определения молекулярных масс растворенных веществ. Эти методы позволяют определить молекулярную массу не диссоциирующих при растворении веществ по понижению температуры замерзания и по повышению температуры кипения растворов известной концентрации:

где
 -
масса растворенного вещества в граммах,
-
масса растворенного вещества в граммах, -
масса растворителя в граммах,
-
масса растворителя в граммах, -
молярная масса растворенного вещества
вг/моль,
1000- коэффициент пересчета от граммов
растворителя к килограммам. Из (1) молярная
масса неэлектролита выразится как:
-
молярная масса растворенного вещества
вг/моль,
1000- коэффициент пересчета от граммов
растворителя к килограммам. Из (1) молярная
масса неэлектролита выразится как: