
- •Амины: классификация, номенклатура; химическая идентификация, спектральные характеристики. Представители: анилин, n–метиланилин, n,n–диметиланилин, толуидины, фенетидины, дифениламин.
- •Амины: реакции первичных, вторичных и третичных алифатических и ароматических аминов с азотистой кислотой; карбиламинная реакция (изонитрильная проба).
- •Ароматические амины: влияние аминогруппы на реакционную способность ароматического ядра; реакции галогенирования, сульфирования, нитрования. Защита аминогруппы.
- •Диазосоединения: номенклатура; реакция диазотирования (вопр. 29), механизм и условия проведения; строение солей диазония; влияние рН среды на устойчивость солей диазония.
- •Диазосоединения: реакции солей диазония с выделением азота, синтетические возможности реакций.
- •Диазосоединения: реакции без выделения азота; реакция азосочетания, ее механизм, диазо– и азосоставляющие; использование реакции азосочетания для идентификации фенолов и ароматических аминов.
- •Азосоединения: азокрасители (метиловый оранжевый), индикаторные свойства; основы теории цветности.
- •Альдегиды и кетоны: факторы, определяющие реакционную способность; реакции присоединения воды и спиртов, механизм, роль кислотного катализа в образовании ацеталей и полуацеталей.
- •Альдегиды и кетоны: механизм аn; присоединение гидросульфита натрия, циановодорода, магнийорганических соединений, значение этих реакций.
- •Альдегиды и кетоны: реакции присоединения-отщепления – образование иминов, оксимов, гидразонов, семикарбазонов, использование этих реакций для идентификации оксосоединений.
- •Альдегиды и кетоны: реакции восстановления – гидридами и комплексными гидридами, восстановление по Кижнеру–Вольфу и Клемменсену; реакции окисления альдегидов катионами серебра (I) и меди (II).
- •Карбоновые кислоты: кислотные свойства, строение карбоксилат-аниона; сравнительная характеристика кислотных свойств алифатических и ароматических моно- и дикарбоновых кислот; образование солей.
- •Карбоновые кислоты: реакции нуклеофильного замещения, механизм; образование функциональных производных.
- •Сложные эфиры: номенклатура, кислотный и щелочной гидролиз, аммонолиз; идентификация.
- •Дикарбоновые кислоты: специфические свойства. Представители: щавелевая, малоновая, янтарная, глутаровая, фталевая кислоты.
- •Фталевая кислота, фталевый ангидрид, фталимид; синтез фенолфталеина, его индикаторные свойства.
- •Аминокислоты: номенклатура, химические свойства как гетерофункциональных соединений; специфические реакции –, β–, –аминокислот; лактамы, дикетопиперазины, отношение к гидролизу.
- •Пептиды и белки: первичная структура, строение (электронное, пространственное) пептидной группы, частичный и полный гидролиз.
- •Кето-енольная таутомерия β – дикарбонильных соединений (ацетилацетон, ацетоуксусный эфир, щавелевоуксусная кислота). Реакции кетонной и енольной форм ацетоуксусного эфира.
- •Ацетоуксусный эфир: строение, таутомерия; синтез карбоновых кислот и кетонов.
- •Сульфаниловая кислота: строение, биполярная структура; реакция диазотирования (вопр. 29); сульфаниламид (стрептоцид), общий принцип строения сульфаниламидных лекарственных препаратов.
-
Дикарбоновые кислоты: специфические свойства. Представители: щавелевая, малоновая, янтарная, глутаровая, фталевая кислоты.
Дикарбоновые кислоты — это соединения, в которых две карбоксильные функциональные группы —СООН.
Практически все дикарбоновые кислоты — твердые вещества. Высшие монокарбоновые и дикарбоновые кислоты из-за низкой летучести запаха не имеют. В ряду дикарбоновых алифатических кислот низшие гомологи лучше растворяются в воде, чем высшие.
Нейтральные соли карбоновых кислот называют, перечисляя названия аниона кислоты и катиона (в родительном падеже). Названия анионов кислот, в свою очередь, образуются заменой суффикса -ил в названии ацильного радикала на –am. Анион, полученный из названия кислоты с суффиксом -карбоновая кислота, называется R-карбоксилат.

Кислые соли дикарбоновых кислот называют аналогично нейтральным. Наличие иона водорода обозначают префиксом гидро- перед названием аниона:

Химические свойства.
Кислотные свойства.
Карбоновые кислоты в целом — слабые кислоты: в водных растворах их соли сильно гидролизованы. Дикарбоновые кислоты образуют два ряда солей — кислые и средние (!). Вследствие затухания индуктивного эффекта второй карбоксильной группы кислотные свойства дикарбоновых кислот (по первой ступени диссоциации) уменьшаются по мере удаления карбоксильных групп друг от друга.
Реакции нуклеофильного замещения.
Одну из важнейших групп реакций, характерных для карбоновых кислот, составляют реакции нуклеофильного замещения у sp2-12C карбоксильной группы, в результате которых гидроксильная группа замещается на другой нуклеофил. За счет положительного мезомерного эффекта гидроксильной группы электрофильность атома углерода карбоксильной группы значительно ниже, чем у атома углерода карбонильной группы альдегидов и кетонов, поэтому реакции нуклеофильного замещения в карбоксильной группе проводятся в присутствии кислотного катализатора.
В результате этих реакций образуются функциональные производные карбоновых кислот — сложные эфиры, амиды, ангидриды, галогенангидриды и др.
Образование сложных эфиров. В случае сильных карбоновых кислот, таких, как щавелевая (!), муравьиная, трифтороуксусная, отпадает необходимость добавления минеральной кислоты, так как подобные карбоновые кислоты сами катализируют реакцию:
![]()
Образование галогенангидридов (также как у других карбоновых кислот). Для получения хлорангидридов, особенно высококипящих, часто используют тионилхлорид SOC12:
![]()
Образование ангидридов (!). Ангидриды некоторых дикарбоновых кислот образуются при нагревании их и в отсутствие водоотнимающих средств. Важно, чтобы образующийся циклический ангидрид содержал пяти- или шестичленный цикл. Такие ангидриды образуют, например, янтарная, глутаровая и фталевая кислоты.

Легко образует ангидрид двухосновная ненасыщенная малеиновая кислота (Z-изомер бутендиовой кислоты), тогда как ее Е-изомер — фумаровая кислота — ангидрида вообще не имеет. Тем не менее при нагревании фумаровая кислота также превращается в ангидрид, но в малеиновый, предварительно изомеризуясь в малеиновую кислоту:

Декарбоксилирование.
В процессе декарбоксилирования карбоновые кислоты отщепляют оксид углерода(IV) и превращаются в соединения разных классов в зависимости от условий проведения реакции.
(!) Дикарбоновые кислоты при нагревании кальциевых, бариевых, ториевых солей, а также солей железа(II) превращаются в циклические кетоны. Хорошие выходы имеют место тогда, когда образуются устойчивые пяти- и шестичленные циклы, тем не менее метод позволяет получать и макроциклические кетоны, содержащие до 30 атомов углерода в цикле.

Декарбоксилирование α,β-ненасыщенных и ароматических кислот проводят нагреванием их в хинолине в присутствии порошкообразной меди или солей меди:
![]()
Особенно легко декарбоксилируются цианоуксусная N=CCH2COOH, малоновая НООС-СН2-СООН и производные, 3-оксокарбоновые кислоты — ацетоуксусная СН3СОСН2-СООН, щавелевоуксусная НOОС-СОСН2-СООН, ацетондикарбоновая НООС-СН2СОСН2-СООН.
Представители:
Щавелевая кислота — НООС-СООН — простейшая дикарбоновая кислота, широко распространена в растительном мире. В виде солей содержится в листьях щавеля, кислицы, ревеня. Нерастворимая кальциевая соль является составной частью почечных камней.
Щавелевая кислота— одна из самых сильных органических кислот, соли и эфиры ее имеют название оксалаты. При нагревании щавелевой кислоты с хлоридом фосфора(V) образуется оксалилхлорид (полный хлорангидрид), используемый в препаративной органической химии для получения хлорангидридов других карбоновых кислот:
![]()
В промышленности щавелевую кислоту получают из формиата натрия:
![]()
Щавелевая кислота проявляет восстановительные свойства: в кислом растворе окисляется перманганатом калия в оксид углерода(IV). Эта реакция используется в аналитической химии для установления точной концентрации растворов перманганата калия (качественная реакция). На восстановительных свойствах щавелевой кислоты основан способ удаления буро-коричневых пятен от перманганата калия.
![]()
При нагревании в присутствии серной кислоты сначала происходит декарбоксилирование щавелевой кислоты, а затем разложение образовавшейся из нее муравьиной кислоты:
![]()
Качественной реакцией для обнаружения щавелевой кислоты и ее солей служит образование нерастворимого оксалата кальция (качественная реакция).
Малоновая кислота — НООС-СН2-СООН — вещество, выделенное из сока сахарной свеклы. В промышленности малоновую кислоту получают из хлороуксусной кислоты.
Большое практическое значение имеет диэтиловый эфир малоновой кислоты, называемый просто малоновым эфиром, который широко применяют в синтезе карбоновых кислот. Малоновый эфир за счет двух электроноакцепторных групп, связанных с α-атомом углерода, обладает СН-кислотными свойствами. Анион малонового эфира является нуклеофилом.
Янтарная кислота — НООС-(СН2)2-СООН — впервые выделена из продуктов сухой перегонки янтаря, откуда и получила свое название. Соли и эфиры янтарной кислоты имеют название сукцинаты. Янтарная кислота — промежуточный продукт биологического расщепления белков, углеводов и жиров.
Глутаровая кислота (пентандиовая кислота) — НООС-(СН2)3-СООН — двухосновная предельная карбоновая кислота. Используется в производстве полимеров, типа полиэстера и полиамидов.
Кето-производное глутаровой кислоты — α-кетоглутаровая кислота (α-кетоглутарат) является важным биологическим соединением. Эта кетокислота образуется при дезаминировании глутамата, и является одним из промежуточных продуктов цикла Кребса.
Фталевая кислота — в промышленности получается гидролизом фталевого ангидрида, который в свою очередь образуется при каталитическом окислении о-ксилола или нафталина кислородом воздуха.
Фталевая кислота при нагревании легко отщепляет воду и превращается во фталевый ангидрид. Именно фталевый ангидрид, а не сама кислота, служит источником для получения различных производных фталевой кислоты. Более половины производимого в мире фталевого ангидрида расходуется на получение средних (полных) эфиров фталевой кислоты — диметил-, диэтил- и диоктилфталатов. Эти эфиры добавляют в качестве пластификаторов к поливинилхлориду для придания эластичности изделиям из него. Диметилфталат используется как средство, отпугивающее комаров.

-
СН–кислотные свойства малонового эфира, синтезы на основе малонового эфира.
Малоновая кислота — НООССН2СООН — вещество, выделенное из сока сахарной свеклы.
Большое практическое значение имеет диэтиловый эфир малоновой кислоты, называемый просто малоновым эфиром, который широко применяют в синтезе карбоновых кислот. Малоновый эфир за счет двух электроноакцепторных групп, связанных с α-атомом углерода, обладает СН-кислотными свойствами (рКа = 13). Под действием сильных оснований, таких, как металлический натрий или этоксид натрия, от молекулы малонового эфира отщепляется протон. В образовавшемся анионе заряд делокализован при участии двух соседних сложноэфирных групп.
Анион малонового эфира является нуклеофилом и может быть проалкилирован первичными или вторичными алкилгалогенидами. После гидролиза сложноэфирных групп и декарбоксилирования замещенной малоновой кислоты получается карбоновая кислота, содержащая на два атома углерода больше, чем у исходного галогенида.

С соединениями, обладающими СН-кислотными свойствами, альдегиды и кетоны способны вступать в различные реакции конденсации. Соединение, содержащее подвижный водород, в этих реакциях выступает в качестве нуклеофильного реагента и называется метиленовой компонентой, а альдегид или кетон — карбонильной компонентой. Реакции присоединения часто сопровождаются отщеплением воды.
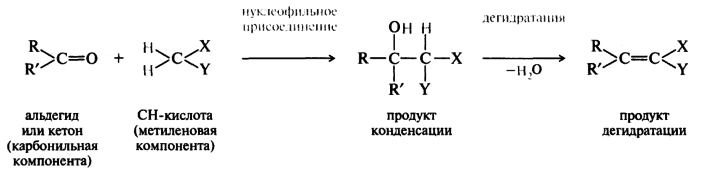
Где Х и У – электроноакцепторные заместители. Реакции конденсации карбонильных соединений протекают в условиях кислотного и основного катализа.
Конденсация альдегидов и кетонов с сильными СН-кислотами. В тех случаях, когда метиленовая компонента имеет довольно высокую СН-кислотность (рКа = 9-13) конденсацию типа альдольной можно осуществить при катализе аммиаком или органическими основаниями (алифатическими аминами, аминокислотами, азотсодержащими гетероциклическими соединениями — пиридином, пиперидином, хинолином):

В качестве метиленовой компоненты в конденсации, известной как реакция Кнёвенагеля, используют обычно вещества общей формулы X—СН2—Y, где X и (или) Y — сильные электроноакцепторные группы (малоновый эфир).
