
- •Амины: классификация, номенклатура; химическая идентификация, спектральные характеристики. Представители: анилин, n–метиланилин, n,n–диметиланилин, толуидины, фенетидины, дифениламин.
- •Амины: реакции первичных, вторичных и третичных алифатических и ароматических аминов с азотистой кислотой; карбиламинная реакция (изонитрильная проба).
- •Ароматические амины: влияние аминогруппы на реакционную способность ароматического ядра; реакции галогенирования, сульфирования, нитрования. Защита аминогруппы.
- •Диазосоединения: номенклатура; реакция диазотирования (вопр. 29), механизм и условия проведения; строение солей диазония; влияние рН среды на устойчивость солей диазония.
- •Диазосоединения: реакции солей диазония с выделением азота, синтетические возможности реакций.
- •Диазосоединения: реакции без выделения азота; реакция азосочетания, ее механизм, диазо– и азосоставляющие; использование реакции азосочетания для идентификации фенолов и ароматических аминов.
- •Азосоединения: азокрасители (метиловый оранжевый), индикаторные свойства; основы теории цветности.
- •Альдегиды и кетоны: факторы, определяющие реакционную способность; реакции присоединения воды и спиртов, механизм, роль кислотного катализа в образовании ацеталей и полуацеталей.
- •Альдегиды и кетоны: механизм аn; присоединение гидросульфита натрия, циановодорода, магнийорганических соединений, значение этих реакций.
- •Альдегиды и кетоны: реакции присоединения-отщепления – образование иминов, оксимов, гидразонов, семикарбазонов, использование этих реакций для идентификации оксосоединений.
- •Альдегиды и кетоны: реакции восстановления – гидридами и комплексными гидридами, восстановление по Кижнеру–Вольфу и Клемменсену; реакции окисления альдегидов катионами серебра (I) и меди (II).
- •Карбоновые кислоты: кислотные свойства, строение карбоксилат-аниона; сравнительная характеристика кислотных свойств алифатических и ароматических моно- и дикарбоновых кислот; образование солей.
- •Карбоновые кислоты: реакции нуклеофильного замещения, механизм; образование функциональных производных.
- •Сложные эфиры: номенклатура, кислотный и щелочной гидролиз, аммонолиз; идентификация.
- •Дикарбоновые кислоты: специфические свойства. Представители: щавелевая, малоновая, янтарная, глутаровая, фталевая кислоты.
- •Фталевая кислота, фталевый ангидрид, фталимид; синтез фенолфталеина, его индикаторные свойства.
- •Аминокислоты: номенклатура, химические свойства как гетерофункциональных соединений; специфические реакции –, β–, –аминокислот; лактамы, дикетопиперазины, отношение к гидролизу.
- •Пептиды и белки: первичная структура, строение (электронное, пространственное) пептидной группы, частичный и полный гидролиз.
- •Кето-енольная таутомерия β – дикарбонильных соединений (ацетилацетон, ацетоуксусный эфир, щавелевоуксусная кислота). Реакции кетонной и енольной форм ацетоуксусного эфира.
- •Ацетоуксусный эфир: строение, таутомерия; синтез карбоновых кислот и кетонов.
- •Сульфаниловая кислота: строение, биполярная структура; реакция диазотирования (вопр. 29); сульфаниламид (стрептоцид), общий принцип строения сульфаниламидных лекарственных препаратов.
-
Амины: классификация, номенклатура; химическая идентификация, спектральные характеристики. Представители: анилин, n–метиланилин, n,n–диметиланилин, толуидины, фенетидины, дифениламин.
Аминами называются производные аммиака, в которых один, два иди три атома водорода заменены на углеводородные радикалы.
В зависимости от числа углеводородных радикалов различают первичные, вторичные и третичные амины. Существуют также четвертичные аммониевые соли и основания, представляющие собой производные иона аммония, в котором все четыре атома водорода замещены органическими радикалами. По природе радикала амины подразделяются на алифатические и ароматические.
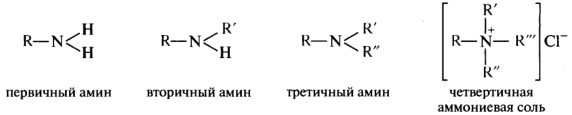
Для аминов более употребительны названия, построенные по радикально-функциональной, а не по заместительной номенклатуре.
Родовое название амины относится к соединениям RNH2, RR'NH и RR'R"N, которые являются первичными, вторичными и третичными аминами соответственно. В более широком смысле к аминам относятся и соединения, содержащие группу —NH— в цикле.
Названия первичных аминов образуются добавлением суффикса -амин к названию радикала R (способ а) или к названию родоначальной структуры (способ б). Так, соединение CH3CH2CH2NH2 будет называться пропиламин (а) или пропанамин-1 (б). Способ а обычно используют для производных простых соединений, а способ б — для сложных циклических соединений. В способе а применяется принцип замещения атома водорода в молекуле аммиака, который формально является родоначальной структурой. По сути он похож на принцип радикально-функциональной номенклатуры, но в правилах ИЮПАК относится к заместительной.
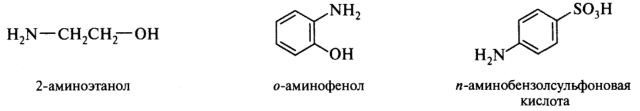
В тех случаях, когда группа —NH2 не является старшей, она обозначается префиксом амино-:
Некоторые амины сохраняют тривиальные названия:

Первичные диамины и полиамины, в которых все аминогруппы присоединены к алифатической цепи или циклическому ядру, называют путем прибавления суффиксов -диамин, -триамин и т. д. к названию родоначальной структуры или многовалентного радикала. Тривиальное название «бензидин» сохраняется.

Симметричные вторичные и третичные амины называют, присоединяя умножающие приставки ди- или три- к названиям алкильных радикалов с суффиксом -амин. Несимметричные соединения получают названия как Ж-замещенные производные первичных аминов, причем за исходный первичный амин принимают соединение с более сложным радикалом:
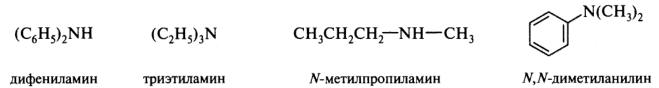
Радикалы аминов RNH—, R2N—, RR'N— называют как замещенные аминогруппы или к тривиальным названиям аминов добавляют букву о:
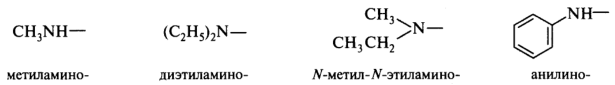
Низшие алифатические амины — газы или жидкости с запахом, похожим на запах аммиака. Высшие гомологи алифатических аминов и ароматические амины представляют собой жидкости или твердые вещества. Амины образуют слабые водородные связи и непрочные ассоциаты, поэтому их температуры кипения ниже, чем у спиртов и карбоновых кислот с тем же числом атомов углерода, но выше, чем у альдегидов или простых эфиров. Низшие алифатические амины хорошо растворимы в воде, с увеличением числа углеводородных радикалов и их длины растворимость снижается. Ароматические амины плохо растворимы в воде.
Представители.
Анилин — C6H5NH2 — бесцветная жидкость со слабым запахом, похожим на запах бензола, при стоянии на воздухе довольно быстро окисляется и приобретает желто-коричневую окраску и неприятный запах. Токсичен.
Более половины производимого анилина расходуется на производство стабилизаторов и ускорителей вулканизации каучуков. Второй по значимости сферой его применения является производство изоцианатов, используемых для получения полиуретанов. Применяют также в производстве красителей различных классов, лекарственных средств, фотоматериалов и средств защиты растений. В нашей стране анилин используют для получения капролактама.
N–метиланилин (монометиланилин) — С6H5NHCH3 — представляет собой маслянистую жидкость желтого цвета с плотностью 0,98 г/см3, растворимую в бензинах, спиртах и эфирах. Главной задачей монометиланилина является получение необходимых детонационных свойств бензина при его производстве. Кроме того, при добавлении его в топливо регулируется октановое число продукта и его экологичность.
Диметиланилин — C6H5N(CH3)2 — третичный жирноароматический амин, бесцветная жидкость. Применяется в производстве полиэфирных смол и в органическом синтезе. Диметиланилин применяют в синтезе красителей (малахитовый зелёный, метиленовый голубой и др.), взрывчатых веществ и др.
Толуидины — CH3C6H4NH2 — бесцветные кристаллические соединения со своеобразными запахами, на воздухе быстро окисляются и темнеют. Получают восстановлением нитротолуолов. Применяют в производстве красителей разных классов (трифенилметановых, азокрасителей, тиазиновых, сернистых), а также для получения крезолов. Толуидины, как и некоторые другие ароматические амины, ядовиты и канцерогенны.
Фенетидины (этоксианилины, аминофенетолы) — NH2–C6H4–OC2H3 (орто-, пара- и мета-) — представляют жидкости. Применяют в производстве азотолов; n-фенетидин также в синтезе лекарственныз средствв (фенацетина, риванола). Фенетидины вызывают отравление при попадании на кожу и вдыхании паров, поражают печень и почки.
Дифенилами́н ((N-фенил)-анилин) — (С6Н5)2NН — бесцветные кристаллы, темнеющие на свету. Дифениламин — исходный продукт в производстве антиоксидантов для полимеров; стабилизатор и флегматизатор термо- и атмосферостойкости нитратов целлюлозы, в том числе пироксилиновых порохов; промежуточный продукт в синтезе триарилметановых и азокрасителей, инсектицидов; ингибитор коррозии мягких сталей. Используется в аналитической химии для обнаружения ионов, как окислительно-восстановительный индикатор.
Спектральные характеристики.
ИК-спектроскопия. Положение полос поглощения аминогрупп в спектре определяется условиями съемки спектров (в твердом виде, жидком состоянии, в растворах или газовой фазе) и зависит от того, является ли аминогруппа свободной (неассоциированной) или она участвует в образовании меж- и внутримолекулярных водородных связей.
Полосы поглощения, обусловленные валентными колебаниями связей N—Н, проявляются в ИК-спектрах в области 3500-3200 см-1. Первичные амины имеют две полосы поглощения. Более высокочастотная обусловлена асимметричными валентными колебаниями N—Н, менее высокочастотная — симметричными. В спектрах аминов в разбавленных растворах в инертных растворителях эти две узкие полосы наблюдаются при 3500 и 3400 см-1. Вторичные амины имеют одну полосу поглощения, соответствующую валентным колебаниям N—Н. Для алифатических аминов в инертных растворителях она наблюдается в области 3350-3310 см-1, в спектрах смешанных аминов Аг—NH—Alk полоса поглощения N—Н расположена при более высоких частотах 3450 см-1.
Если аминогруппа участвует в меж- или внутримолекулярной водородной связи (в твердом или жидком состоянии, в концентрированных растворах), то полосы поглощения валентных колебаний N—Н смещаются в низкочастотную сторону. Однако это смещение не столь значительно. Ассоциированные первичные амины дают полосы поглощения в областях 3420-3330 см-1 (vasNH2) и 3330-3250 см-1 (vsNH2), вторичные — в области 3300-3150 см-1. При неполной ассоциации можно наблюдать одновременно полосы свободной и ассоциированной аминогруппы, поэтому в области 3500-3200 см-1 может быть более двух полос, характерных для первичных аминов, и более одной полосы, характерной для вторичных.
Деформационные колебания аминогруппы наблюдаются в области 1650-1500 и 950-650 см-1. Первичные амины имеют полосы поглощения плоских деформационных колебаний средней интенсивности 1650-1580 см-1, вторичные — слабой интенсивности в интервале 1600-1500 см-1. При образовании водородных связей частоты деформационных колебаний повышаются.
Амины имеют также полосы поглощения валентных колебаний С—N. В алифатических аминах этим колебаниям соответствует поглощение в области 1250-1020 см-1 средней интенсивности, в ароматических аминах — интенсивное поглощение в интервале частот 1340-1260 см-1.
Взаимодействие аминов с кислотами вызывает сильные изменения в спектрах. В солях первичных аминов колебаниям N—Н соответствует широкая сильная полоса в области 3100-2600 см-1. Соли вторичных и третичных аминов имеют интенсивное поглощение в области 2700-2250 см-1. Соли аминов можно дополнительно идентифицировать по деформационным колебаниям. Соли первичных аминов поглощают в области 1600-1575 и 1550-1500 см-1, соли вторичных аминов — в диапазоне 1620-1560 см-1.
Спектроскопия ПМР. Сигналы протонов группы NH алифатических и циклических аминов наблюдаются в интервале 0,5-3,0 м. д., ароматических аминов — при 3,0-5,0 м. д. Поскольку амины могут образовывать водородные связи, положение сигналов зависит от концентрации амина, природы растворителя и температуры. Протоны NH-группы могут обмениваться на дейтерии, и при добавлении к образцу тяжелой воды D2O эти сигналы исчезают.
Аминогруппа, находящаяся в сопряжении с бензольным кольцом, повышает электронную плотность в орто- и пара-положениях кольца, что приводит к экранированию соответствующих протонов и смешению их сигналов в более сильное поле по сравнению с бензолом. В спектрах ПМР как аминов сигналы ароматических протонов представляют собой сложные мультиплеты.
Электронная спектроскопия. Алифатические амины в УФ- и видимой области не поглощают. Сопряжение аминогрупп с бензольным кольцом приводит к значительному батохромному смещению полос поглощения бензола с увеличением их интенсивности. Полагают, что наряду с локальным π→π*-переходом бензольного кольца в данное поглощение вносит вклад переход с переносом заряда от донорной группы в кольцо (анилин. Анилин в ближней УФ-области имеет две полосы поглощения — 230 нм и 280 нм.
-
Амины: кислотно-основные свойства; нуклеофильные свойства – реакции алкилирования аминов и аммиака, четвертичные аммониевые соли, раскрытие –оксидного цикла аминами с образованием аминоспиртов.
Химические свойства.
В молекулах алифатических аминов атом азота находится в состоянии sp3-гибридизации, поэтому они, подобно аммиаку, имеют пирамидальную конфигурацию. Например, углы связей С—N—С в триметиламине равны 108° и очень близки к величинам углов Н—N—Н в молекуле аммиака.
Теоретически вторичные и третичные амины с разными углеводородными радикалами могут существовать в виде энантиомеров, однако обычные алифатические и ароматические амины до сих пор не выделены в виде индивидуальных энантиомеров. Это объясняется тем, что молекулы аммиака и аминов постоянно претерпевают пирамидальную инверсию, которую следует рассматривать как быстрое обращение конфигурации. Инверсия осуществляется через тригональное переходное состояние (в центре схемы):

В молекулах ароматических аминов неподеленная пара электронов атома азота находится в сопряжении с π-электронами ароматического кольца, вследствие чего амплитуда, с которой совершается пирамидальная инверсия, значительно уменьшается.

Четвертичные аммониевые соли, имеющие четыре разных радикала, могут быть разделены на индивидуальные энантиомерные формы, т. е. эти формы обладают конфигурационной устойчивостью. Так, аллилбензилметилфениламмонийиодид выделен в виде индивидуальных энантиомеров, каждый из которых обладает оптической активностью:

Основные свойства.
Амины, как и аммиак, проявляют основные свойства, что обусловлено наличием в их молекулах атома азота с неподеленной парой электронов. При взаимодействии с кислотами амины превращаются в аммониевые соли:
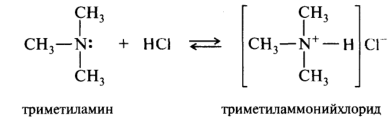
Соли аминов в отличие от других ониевых солей гидролитически устойчивы, хорошо растворимы в воде, легко кристаллизуются из водных растворов и, как правило, более устойчивы, чем свободные основания. Многие лекарственные вещества, относящиеся к классу аминов, применяются в виде солей с минеральными и реже органическими кислотами.
Алифатические амины — сильные основания. Водные растворы аминов имеют щелочную среду по лакмусу:

Можно предположить, что третичные амины с тремя алкильными заместителями, обладающими +I-эффектом, будут более сильными основаниями, чем вторичные и первичные амины. Однако стерические факторы, определяющие доступность основного центра для атаки протоном, оказывают противоположное влияние. Чем больше у атома азота радикалов и чем они разветвленнее, тем сильнее экранирована неподеленная пара электронов атома азота и затруднено ее взаимодействие с протоном. Поэтому самыми сильными основаниями должны быть первичные и вторичные амины со сравнительно короткими и неразветвленными радикалами. Сольватация (взаимодействие молекулы растворенного вещества с молекулами растворителя) оказывает на основность влияние, сходное с влиянием стерических факторов, поскольку с увеличением числа и разветвленности углеводородных радикалов уменьшается способность катиона замещенного аммония (сопряженной кислоты) связывать молекулы растворителя.
Многие экспериментальные данные не укладываются в изложенные выше сравнительно простые схемы. Таким образом, чисто умозрительные рассуждения не могут служить достоверной основой для предсказания сравнительной основности алифатических аминов. На практике можно руководствоваться тем, что значения рКВН+ большинства алифатических аминов укладываются в сравнительно узкий интервал: от 10,6 до 11,2. Такое небольшое различие в основности не обеспечивает существенного преимущества какому-нибудь из аминов в конкурентной реакции протонирования.
Основность ароматических аминов существенно ниже, чем у аминов алифатического ряда. Это объясняется тем, что неподеленная пара электронов атома азота вступает в р,π-сопряжение с электронами бензольного кольца:
![]()
Заместители в кольце существенным образом влияют на основность: электроноднорные заместители ее увеличивают, а электроноакцепторные снижают.
Если из-за стерических затруднений неподеленная пара электронов выводится из сопряжения, то основность амина значительно возрастает. Так, объемные алкильные радикалы N,N-диизопропиланилина не могут расположиться в одной плоскости с бензольным кольцом из-за взаимного отталкивания с атомами водорода в орто-положениях, поэтому его основность (pKBH+ 7,4) значительно выше, чем у анилина. Аналогичного рода стерические затруднения возникают у N,N-диалкиланилинов, имеющих одновременно заместители в положениях 2 и 6. В молекуле 1,8-бис(диметиламино)нафталина обе диметиламиногруппы также не могут расположиться в одной плоскости с ароматической системой, и это соединение обладает удивительно высокой основностью (рKвн+ 12,4), его протонированная форма устойчива за счет того, что протон прочно удерживается неподеленными парами электронов двух атомов азота.

Кислотные свойства.
NH-Кислотные свойства аминов выражены в значительно меньшей степени, чем основные. Для алифатических и ароматических первичных и вторичных аминов рКA имеют значения 30—35. Таким образом, более слабыми кислотами, чем амины, являются разве что алканы. Амины проявляют кислотные свойства только в присутствии очень сильных оснований, таких, как, например, металлоорганические соединения, и превращаются при этом в амиды металлов (не путать с амидами карбоновых и сульфоновых кислот!):

Амиды щелочных металлов являются очень сильными основаниями и используются в органическом синтезе.
Нуклеофильные свойства.
Нуклеофильные свойства аминов, как и основные, обусловлены наличием неподеленной пары электронов атома азота. Некоторые реакции, в которых амины участвуют в качестве нуклеофильных реагентов, будут далее и были ранее. Это — алкилирование аминов [(1)], взаимодействие с карбонильными соединениями [(2)] и ацилирование производными карбоновых кислот [(3)]:

Алкилирование. Амины, как и аммиак, подвергаются алкилированию галогеноалканами. Алкилирование аммиака приводит к образованию первичного амина, из первичных аминов образуются вторичные, из вторичных — третичные, из третичных — четвертичные аммониевые соли. Образующаяся в ходе реакции замещенная аммониевая соль обменивается протоном с аммиаком или амином, поэтому в реакции алкилирования получается смесь аминов с разным числом алкильных радикалов:

Реакцию алкилирования редко удается остановить на какой-то отдельной стадии ввиду того, что различия в нуклеофильности и основности первичных, вторичных и третичных аминов не настолько значительны, чтобы повлиять на различие в скоростях реакций алкилирования аминов разной степени замещения.
В промышленности аммиак и низшие амины алкилируют низшими спиртами в газовой фазе при температуре 300—500 °С над оксидами алюминия, кремния, тория, хрома и др. При этом образуются смеси первичных, вторичных и третичных аминов. Этим способом получают в основном метил- и этиламины:
![]()
Реакции аминов с эпоксидами. При взаимодействии первичных и вторичных аминов с эпоксидами (оксиранами) происходит нуклеофильное раскрытие напряженного трехчленного α-оксидного цикла и образуются β-аминоспирты. В замещенных эпоксидах нуклеофильная атака происходит, как правило, на наименее замещенный атом углерода оксидного цикла (правило Красуского):

