
- •Специальные разделы курса
- •Моносахариды: образование простых и сложных эфиров, отношение эфиров к гидролизу; гликозидов (на примере d–маннозы); строение гликозидов, o–,n–,s–гликозиды, отношение гликозидов к гидролизу.
- •Моносахариды: окисление в гликоновые, гликаровые и гликуроновые кислоты; представители – d–глюконовая, d–глюкуроновая, d–галактуроновая кислоты; аскорбиновая кислота (витамин с).
- •Моносахариды: восстановление в полиолы; представители: d–сорбит, ксилит; открытая и циклические формы моносахаридов (на примере d–фруктозы и d–ксилозы).
- •Олигосахариды: принцип строения невосстанавливающих дисахаридов; сахароза; номенклатура; отношение к гидролизу, окислению катионами серебра (I) и меди (II).
- •Полисахариды: классификация; принцип строения гомополисахаридов на примере крахмала (амилоза, амилопектин), тип гликозидной связи; отношение крахмала к гидролизу.
- •Полисахариды: классификация; принцип строения на примерах декстранов, инулина, пектиновых веществ, типы гликозидной связи.
- •Полисахариды: строение целлюлозы; простые и сложные эфиры целлюлозы – ацетаты, нитраты, метил–, карбоксиметил– и диэтиламиноэтилцеллюлоза.
- •Производные пятичленных азотсодержащих ароматических гетероциклов: пиразолон и его таутомерия, лекарственные средства на основе пиразолона–3; гистидин, гистамин, бензимидазол, дибазол.
- •Шестичленные кислородсодержащие гетероциклы с одним гетероатомом: бензопироны – хромон, кумарин, флавон; флавоноиды – лютеолин, кверцетин; цианидиновая проба; катехины (вопр. 18).
- •Шестичленные гетероциклы с двумя гетероатомами: гидрокси– и аминопроизводные пиримидина (урацил, тимин, цитодин) – электронное строение, лактим–лактамная таутомерия.
- •Шестичленные гетероциклы с двумя гетероатомами: барбитуровая кислота – синтез, виды таутомерии, кислотные свойства; производные барбитуровой кислоты – барбитал, фенобарбитал.
- •Конденсированные гетероциклы: электронное строение, кислотно–основные свойства, таутомерия пурина; гидрокси– и аминопроизводные пурина – гипоксантин, ксантин, их таутомерия.
- •Конденсированные гетероциклы: мочевая кислота, ее электронное строение, лактим–лактамная таутомерия, кислотные свойства; соли мочевой кислоты (ураты); мурексидная проба.
- •Конденсированные гетероциклы: пурин – строение, ароматичность; производные пурина – аденин, гуанин, их таутомерия (вопр. 22).
- •Нуклеозиды: строение, классификация, номенклатура; отношение к гидролизу.
- •Нуклеотиды: строение, номенклатура, отношение к гидролизу.
- •Нуклеотидные коферменты: атф–строение, отношение к гидролизу.
- •Нуклеиновые кислоты: рнк и днк, первичная структура.
- •Алкалоиды: химическая классификация; основные свойства, образование солей. Представители: хинин, никотин, атропин.
- •Алкалоиды: метилированные ксантины (кофеин, теофиллин, теобромин); кислотно-основные свойства; их качественные реакции.
- •Алкалоиды: группа пиридина (никотин, анабазин) – строение, реакционная способность, общие реакции алкалоидов.
- •Алкалоиды: группа хинолина (хинин) – строение, талейохинная проба, основные свойства, образование солей.
- •Алкалоиды: группа изохинолина и фенантренизохинолина (папаверин, морфин, кодеин) – строение, основные свойства, характеристика реакционной способности.
- •Алкалоиды: группа тропана (атропин, кокаин) – строение, основные свойства, характеристика реакционной способности.
- •Липиды: триацилглицерины – принцип строения, номенклатура, реакционная способность (гидролиз, гидрогенизация, окисление), аналитические характеристики (иодное число, число омыления).
- •Липиды: фосфатидная кислота – строение; фосфолипиды (фосфатидилколамины, фосфатидилхолины) – состав, строение, гидролиз.
- •Терпены и терпеноиды: состав, химическое и пространственное строение производных ментана (ментол, терпин), их реакционная способность.
- •Терпены и терпеноиды: состав и строение бициклических монотерпенов (-пинен, борнеол, камфора), их реакционная способность.
- •Терпены и терпеноиды: классификация по числу изопреновых звеньев; дитерпены и тетратерпены (ретинол, ретиналь, β–каротин) – строение, реакционная способность.
- •Стероиды: родоначальные углеводороды (эстран, андростан, прегнан, холан, холестан); стереоизомерия, цис–транссочленение циклогексановых колец, –,β–стереохимические ряды.
- •Стероиды: производные холестана (стерины) – холестерин, эргостерин, витамин d2: номенклатура, строение, характеристика реакционной способности.
- •Производные холана (желчные кислоты): холевая и дезоксихолевая кислоты; гликохолевая и таурохолевая кислоты; их дифильный характер; строение, номенклатура, реакционная способность.
- •Производные прегнана (кортикостероиды): дезоксикортикостерон, гидрокортизон, преднизолон; строение, номенклатура, характеристика реакционной способности.
- •Производные эстрана (эстрогенные гормоны): эстрон, эстрадиол, эстриол; строение, номенклатура, характеристика реакционной способности.
- •Производные андростана (андрогенные гормоны): тестостерон, андростерон; строение, номенклатура, характеристика реакционной способности.
- •Агликоны сердечных гликозидов: дигитоксигенин, строфантидин; общий принцип строения и реакционная способность сердечных гликозидов.
-
Нуклеотиды: строение, номенклатура, отношение к гидролизу.
Нуклеотиды образуются в результате частичного гидролиза нуклеиновых кислот, либо путем синтеза. Они содержатся в значительных количествах во всех клетках. Нуклеотиды являются фосфатами нуклеозидов.
В зависимости от природы углеводного остатка различают дезоксирибонуклеотиды и рибонуклеотиды. Фосфорная кислота обычно этерифицирует спиртовый гидроксил при С-5' или при С-З' в остатках дезоксирибозы (дезоксирибонуклеотиды) или рибозы (рибонуклеотиды). В молекуле нуклеотида для связывания трех структурных компонентов используются сложноэфирная связь и N-гликозидная связь.

Принцип строения мононуклеотидов
Нуклеотиды можно рассматривать как фосфаты нуклеозидов (эфиры фосфорной кислоты) и как кислоты (в связи с наличием протонов в остатке фосфорной кислоты). За счет фосфатного остатка нуклеотиды проявляют свойства двухосновной кислоты и в физиологических условиях при рН ~7 находятся в полностью ионизированном состоянии.

Для нуклеотидов используют два вида названий. Один из них включает наименование нуклеозида с указанием положения в нем фосфатного остатка, например аденозин-3'-фосфат, уридин-5'-фосфат. Другой вид названий строится путем добавления сочетания -иловая кислота к названию остатка нуклеинового основания, например 3'-адениловая кислота, 5'-уридиловая кислота.

В химии нуклеотидов также принято использование сокращенных названий. Свободные мононуклеотиды, т. е. не находящиеся в составе полинуклеотидной цепи, называют как монофосфаты с отражением этого признака в сокращенном коде буквой «М». Например, аденозин-5'-фосфат имеет сокращенное название АМР (в отечественной литературе — АМФ, аденозинмоно- фосфат) и т. п.
Для записи последовательности нуклеотидных остатков в составе полинуклеотидных цепей применяется другой вид сокращений с использованием однобуквенного кода для соответствующего нуклеозидного фрагмента. При этом 5'-фосфаты записываются с добавлением латинской буквы «р» перед однобуквенным символом нуклеозида, 3'-фосфаты — после однобуквенного символа нуклеозида. Например, аденозин-5'-фосфат — рА, аденозин-3'-фосфат — Ар и т. п..
Нуклеотиды способны гидролизоваться в присутствии сильных неорганических кислот (НС1, НВr, Н2SО4) и некоторых органических кислот (СС13СООН, НСООН, СН3СООН) по N-гликозидной связи, фосфорноэфирная связь проявляет при этом относительную устойчивость. В то же время под действием фермента 5'-нуклеотидазы гидролизуется сложноэфирная связь, а N- гликозидная связь сохраняется.
-
Нуклеотидные коферменты: атф–строение, отношение к гидролизу.
Нуклеотиды имеют большое значение не только как мономерные единицы полинуклеотидных цепей различных видов нуклеиновых кислот. В живых организмах нуклеотиды являются участниками важнейших биохимических процессов. Особенно они важны в роли коферментов, т. е. веществ, тесно связанных с ферментами и необходимых для проявления ими ферментативной активности. Во всех тканях организма в свободном состоянии содержатся моно-, ди- и трифосфаты нуклеозидов.
Особенно известны аденинсодержащие нуклеотиды:
• аденозин-5'-фосфат (АМР, или в русской литературе АМФ);
• аденозин-5'-дифосфат (ADP, или АДФ);
• аденозин-5'-трифосфат (АТР, или АТФ).
Нуклеотиды, фосфорилированные в разной степени, способны к взаимопревращениям путем наращивания или отщепления фосфатных групп. Дифосфатная группа содержит одну, а трифосфатная — две ангидридные связи, обладающие большим запасом энергии и поэтому называемые макроэргическими. При расщеплении макроэргической связи Р-О выделяется -32 кДж/моль. С этим связана важнейшая роль АТФ как «поставщика» энергии во всех живых клетках.
Взаимопревращения фосфатов аденозина.

В приведенной выше схеме взаимопревращений формулы АМФ, АДФ и АТФ соответствуют неионизированному состоянию молекул этих соединений. С участием АТФ и АДФ в организме осуществляется важнейший биохимический процесс — перенос фосфатных групп.
-
Нуклеотидные коферменты: НАД+ и НАДФ+ – строение, алкилпиридиниевый ион и его взаимодействие с гидрид–ионом как химическая основа окислительного действия, НАД+.
Никотинамидадениндинуклеотиды. К этой группе соединений относятся никотинамидадениндинуклеотид (NAD, или НАД) и его фосфат (NADP, или НАДФ). Эти соединения выполняют важную роль коферментов в реакциях биологического окисления органических субстратов путем их дегидрирования (с участием ферментов дегидрогеназ). Поскольку эти коферменты являются участниками окислительно-восстановительных реакций, то они могут существовать как в окисленной (НАД+, НАДФ+), так и в восстановленной (НАДН, НАДФН) формах.
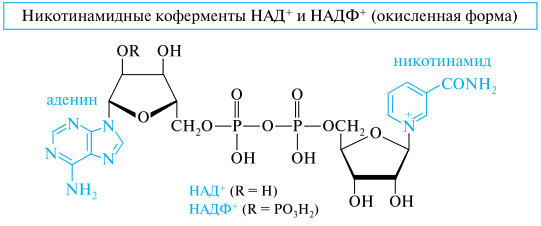
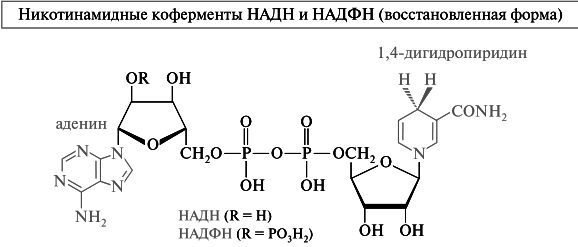
Структурным фрагментом НАД+ и НАДФ+ является никотинамидный остаток в виде пиридиниевого иона. В составе НАДН и НАДФН этот фрагмент превращается в остаток замещенного 1,4-дигидропиридина.

В ходе биологического дегидрирования, являющегося особым случаем окисления, субстрат теряет два атома водорода, т. е. два протона и два электрона (2Н+, 2е) или протон и гидрид-ион (Н+ и Н). Кофермент НАД+ рассматривается как акцептор гидрид-иона. В результате восстановления за счет присоединения гидрид-иона пиридиниевое кольцо переходит в 1,4-дигидропиридиновый фрагмент. Данный процесс обратим.
В ходе окисления ароматический пиридиниевый цикл переходит в неароматический 1,4-дигидропиридиновый цикл. В связи с потерей ароматичности возрастает энергия НАДН по сравнению с НАД+. Увеличение энергетического содержания происходит за счет части энергии, выделяющейся в результате превращения спирта в альдегид. Таким образом, НАДН запасает энергию, которая затем расходуется в других биохимических процессах, требующих энергетических затрат.
