
Методичка 3
ЛАБОРАТОРНАЯ РАБОТА №1
Электролиз водного раствора хлорида натрия
Общие сведения
Электролизом называются процессы, протекающие на электродах при пропускании постоянного электрического тока через растворы или расплавы электролитов в аппаратах, называемых электролизерами.
Молекулы электролитов в растворах или расплавах в определенной степени диссоциированы на ионы. Под воздействием приложенной ЭДС ионы приобретают направленное движение к соответствующим электродам :положительно заряженные ионы (катионы) движутся к катоду, отрицательно заряженные ионы (анионы) – к аноду.
На аноде происходят реакции окисления (отщепление электронов), на катоде- восстановления (присоединение электродов).
Для протекания электролиза необходимо, чтобы потенциал рабочего электрода превышал равновесный потенциал разряда данного вида иона …, определяемый по уравнению Нернта:
![]() (1.1.)
(1.1.)
Где –Е![]() стандартный электродный потенциал, В;
стандартный электродный потенциал, В;
R- универсальная газовая постоянная, равная 8,31 Дж/(моль. К);
T- температура, К;
F- число Фарадея;F=96500 Кл/моль=26,8 А.ч/моль;
Число Фарадея равно количеству электричества, необходимому для превращения молярной массы эквивалента вещества на электроде.
![]()
![]() (1.2)
(1.2)
Где N![]() - число Авогадро;N
- число Авогадро;N![]() =
6,02 .10
=
6,02 .10![]() ;
;
е - заряд электрона; е = 1,6. 10![]() Кл;
Кл;
F= 6,02 . 10![]() .1
,6. 10
.1
,6. 10![]() =
96500 Кл/моль.
=
96500 Кл/моль.
a![]() ,a
,a![]() – активность (концентрация) окисленной
и восстановленной форм вещества,
соответственно, моль/дм
– активность (концентрация) окисленной
и восстановленной форм вещества,
соответственно, моль/дм![]() ;
;
n- число электронов, участвующих в электронной реакции:
Теоретически минимальное напряжение
на электроде ..,необходимое для проведения
реакции на электродах, определяется
как разность равновесных потенциалов
анодной Е![]() и катодной Е
и катодной Е![]() реакций
реакций
![]() (1.3)
(1.3)
Стр 4
Практическая величина напряжения на электролизе превышает теоретическую
U![]() -U
-U![]() =
=
![]() E
E![]() +E
+E![]()
![]()
![]() +
+![]() E(1.4)
E(1.4)
Где
![]() E
E![]() ,E
,E![]()
![]()
![]() - величины поляризации анода и катода,
соответственно, В;
- величины поляризации анода и катода,
соответственно, В;
![]() E- падение напряжения в электролите,
шинопроводах , контактах, В.
E- падение напряжения в электролите,
шинопроводах , контактах, В.
Поляризация характеризует отклонение
потенциала электрода при пропускании
тока от его равновесного потенциала
Е![]() ,
связанное с наличием лимитирующей
стадии электродного процесса.
,
связанное с наличием лимитирующей
стадии электродного процесса.
В настоящее время в промышленности хлор и едкий натр получают в основном электролизом раствора хлорида натрия двумя способами: диафрагменным и ртутным. Большее распространение получил диафрагменный способ, как более дешевый и экономически менее вредный, хотя качество его продуктов ниже, чем в ртутном:
В диафрагменном способе при электролизе раствора хлорида натрия на стальном катоде происходит реакция образования водорода:
![]()
Ионы ОН – у катода накапливаются и с
ионами Na![]() .. образуют щелочь.
.. образуют щелочь.
На графитовом аноде преимущественно выделяется хлор:
![]()
Суммарная реакция при электролизе хлорида натрия может быть выражена следующим уравнением:
![]()
Побочными реакциями на аноде являются:
Выделение кислорода
![]()
Образование диоксида углерода (если анод графитовый):
![]()
![]()
Который реагирует со щелочью с образованием карбоната натрия:
![]()
Образование хлората:
![]()
Кроме того, в объеме раствора протекают вторичные химические реакции. Газообразный хлор, частично растворяясь в электролите,
взаимодействует с водой:
![]()
5 стр.
В случае смешения анодных и катодных продуктов образующиеся кислоты нейтрализуются щелочью с образованием хлористого натрия и гипохлорита:
![]()
На катоде возможны:
Восстановление растворенного хлора:
![]()
Восстановление гипохлорита:
![]()
Восстановление хлората:
![]()
Побочные химические и электрохимические реакции загрязняют продукты электролиза и снижают выходы по току на электродах.
В хлор – газе в незначительных количествах содержаться О…, а из-за не герметичности электролизной ванны может попадать азот воздуха.
В католите , кроме едкого натра и неразложившегося хлористого натрия, могут быть гипохлорит, хлорат натрия и сода.
Для снижения выхода по току побочных продуктов необходимо уменьшить взаимодействие хлора с водой и предотвратить смещение анодных и катодных продуктов.
Растворимость хлора в рассоле уменьшают
путем использования концентрированных
растворов (
![]() г/дм
г/дм![]() NaCl) и повышения температуры
электролиза ( 80…95 С).
NaCl) и повышения температуры
электролиза ( 80…95 С).
Для предотвращения смешения анодных и катодных продуктов устанавливают разделительные диафрагмы.
Превращения веществ на электродах подчиняются законам Фарадея.
Согласно первому закону Фарадея количество вещества, превращенного на электроде, прямо пропорционально количеству пропущенного через электролит электричества:
![]() (1.5)
(1.5)
Где
![]() - масса вещества, г;
- масса вещества, г;
![]() -
электрохимический эквивалент, г/(А ч);
-
электрохимический эквивалент, г/(А ч);
I- сила тока, А;
![]() - время электролиза, ч.
- время электролиза, ч.
Связь между химическим эквивалентом Э
и электрохимическим К![]() .
устанавливается соотношением:
.
устанавливается соотношением:
6 стр.
![]() (1.6 )
(1.6 )
Где М – молярная масса вещества (или А- грамм- атомная масса вещества)
Из формул 1.5 и 1.6 следует что
![]() (1.7)
(1.7)
Основными показателями процесса электролиза являются:
выход по току,
 .
.коэффициент использования энергии,
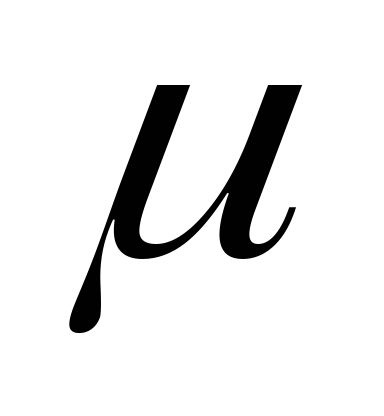 .
.напряжение на электролизной ванне,

Выходом по току называется отношение
практически полученного вещества m![]() к количеству веществаm
к количеству веществаm![]() ,
выделившееся согласно законам Фарадея
и рассчитанное по уравнению (1.7)
,
выделившееся согласно законам Фарадея
и рассчитанное по уравнению (1.7)
Выход по току обычно выражают в процентах
![]() (1.8)
(1.8)
Выход по току обычно ниже 100% за счет протекания побочных химических и электрохимических реакций, а также за счет возможной утечки тока при плохой изоляции проводов и электролизной ванны.
Коэффициентом использования электрической энергии называется отношение количества электрической энергии, теоретически необходимой для получения 1 г вещества .. к практически затраченной .
Коэффициент использования энергии выражают в процентах
![]() (1.9)
(1.9)
Теоретический расход энергии на единицу вещества определяется по уравнению
![]()
![]() (1.10)
(1.10)
Практический расход энергии на единицу полученного вещества
![]() (1.11)
(1.11)
Тогда
![]() ( 1.12)
( 1.12)
![]()
Для увеличения коэффициента использования энергии необходимо повышать выход по току и снижать практическое напряжение на электролизной ванне
2 Цель работы
2.1 Ознакомиться с технологией процесса электрохимического получения хлора, едкого натрия и водорода на лабораторной установке.
2.2 . По результатам эксперимента составить материальный баланс по Na
2.3 . Определить выход едкого натра по току и коэффициент использования энергии
3 Описание лабораторной установки
Лабораторная установка для электролиза водного раствора хлорида натрия состоит из электролизера, выпрямителя, реостата и амперметра (рис 1.1).Электролизер с не подвижным электролитом представляет собой сосуд, внутри которого находятся графитовый анод и стальной катод. Анодное и катодное пространства разделены асбестовой диафрагмой. Анодное пространство герметизировано с помощью крышки, в которой имеются два отверстия: для заполнения его электролитом и для отвода хлор-газа,.
Водный раствор хлорида натрия заливают в анодное и катодное пространства. хлор-газ выводят в атмосферу или газоанализатор, водород уходит в атмосферу.
стр.
рисунок 1.1.
Схема лабораторной установки для электролиза водного раствора хлорида натрия:
1- выпрямитель; 2- реостат; 3- амперметр; 4-электролизер; 5- асбестовая диафрагма.
…
порядок проведения работы
Залить в анодное и катодное пространства водный раствор NaClв объемах, заданных преподавателем.
Включить выпрямитель, установить с помощью реостата на амперметре заданную силу тока и поддерживать ее постоянной в течение заданного периода времени. Напряжение на электролизере
 замерить вольтметром.
замерить вольтметром.Перед началом работы провести анализ исходного раствора на содержание NaClпо методичке 6.1.
По истечении заданного периода времени выключить выпрямитель.
Определить объемы растворов в анодном пространстве (анолит) и в катодном пространстве (католит) по калибровочным шкалам на электролизере.
Отобрать пробы католита для анализа на содержание NaCl,NaOH,Na
 CO
CO по методичкам 6.2, 6.3.
по методичкам 6.2, 6.3.Полученные результаты представить преподавателю, после чего освободить электролизер от растворов и вымыть его.
Рассчитать заданный баланс, показатели процесса электролиза и оформить отчет.
5. Задание на выполнение работы
5.1. Сила тока электролиза 1…3А.
5.2 .Объем раствора, заливаемого в катодное пространство 100..150 см.
5.3 . Объем раствора, заливаемого в анодное пространство 100.. 150 см.
5.4 . Время электролиза 1..2 часа
5.5 . Составить материальный баланс по
Na![]()
5.6 Рассчитать выход едкого натра по току и коэффициент использования энергии.
стр.
6. Методика анализов.
6.1. Анализ исходного рассола на содержание
хлорида натрия. Для анализа с помощью
пипетки берут 5 см![]() рассола и разбавляют дистиллированной
водой в
рассола и разбавляют дистиллированной
водой в![]() мерной
колбе до 250 см
мерной
колбе до 250 см![]() .
После тщательного перемешивания отбирают
чистой пипеткой 5 см
.
После тщательного перемешивания отбирают
чистой пипеткой 5 см![]() раствора,
прибавляют 1..2 капли индикатора К
раствора,
прибавляют 1..2 капли индикатора К![]() С
С![]() О
О![]() и титрируют раствором азотнокислого
серебра концентрации 0,1 моль/дм
и титрируют раствором азотнокислого
серебра концентрации 0,1 моль/дм![]() до получения неисчезающего красноватого
осадка.
до получения неисчезающего красноватого
осадка.
Концентрацию NaClв рассоле рассчитывают по формуле 6.1 :
![]() (6.1)
(6.1)
Где С
![]() - концентрацияNaClв
исходном рассоле, г/дм
- концентрацияNaClв
исходном рассоле, г/дм![]() ;
;
V![]() -
объем азотнокислого серебра, пошедшего
на титрование пробы, см
-
объем азотнокислого серебра, пошедшего
на титрование пробы, см![]() .
.
N- молярная концентрация раствора азотнокислого серебра, моль/дм;
К- поправочный коэффициент к концентрации раствора азотного серебра;
V![]() -
объем раствора, взятого на титрование,
см
-
объем раствора, взятого на титрование,
см![]() .
.
S- объем исходного
раствора рассола, взятого для разбавления,
см![]() ;
;
