
Министерство образования и науки Российской Федерации
Национальный исследовательский ядерный университет «МИФИ»
Балаковский инженерно-технологический институт
Электролитическая диссоциация
Методические указания к выполнению лабораторной работы
по курсу «Химия» для студентов технических
специальностей и направлений,
по курсу «Общая и неорганическая химия»
для студентов направления ХМТН
всех форм обучения
Балаково 2014
Цель работы – изучение механизма диссоциации водных растворов электролитов.
ОСНОВНЫЕПОНЯТИЯ
Электролитической диссоциацией называется процесс распада молекул веществ на ионы под действием полярных молекул растворителя. Электролиты – вещества, проводящие в растворе или расплаве электрический ток (к ним относятся многие кислоты, основания, соли).
Согласно теории электролитической теории С. Аррениуса (1887 г), при растворении в воде электролиты распадаются (диссоциируют) на положительно и отрицательно заряженные ионы. Положительно заряженные ионы называют катионами, к ним относятся ионы водорода и металлов. Отрицательно заряженные ионы называются анионами, к ним относятся ионы кислотных остатков и гидроксид-ионы. Суммарный заряд всех ионов равен нулю, поэтому раствор в целом нейтрален. Свойства ионов отличаются от свойств атомов, из которых они образованы. Электролитическая диссоциация - процесс обратимый (обратная реакция называется ассоциацией). Эту теорию позднее дополнили Д.И. Менделеев и И.А. Каблуков.
Механизм электролитической диссоциации
Электролитами являются вещества, в молекулах которых атомы связаны ионной или полярной связью. По современным представлениям электролитическая диссоциация происходит в результате взаимодействия молекул электролита с полярными молекулами растворителя. Сольватация - взаимодействие ионов с молекулами растворителя. Гидратация –процесс взаимодействия ионов с молекулами воды.
В зависимости от структуры растворяющегося вещества в безводном состоянии его диссоциация протекает по–разному.
Легче всего диссоциируют вещества с ионной связью, которые состоят из ионов. При растворении таких соединений (например, NaCl) диполи воды ориентируются вокруг положительного и отрицательного ионов кристаллической решетки. Между ионами и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, происходит переход ионов из кристалла в раствор. При этом образуются гидратированные ионы, т.е. ионы, химически связанные с молекулами воды

Рис.1. Схема диссоциации молекулы вещества с ионной связью
Процесс электролитической диссоциации можно выразить уравнением
NaCl +
(m+n)H2O![]() Na+(H2O)m
+ Cl-(H2O)n
Na+(H2O)m
+ Cl-(H2O)n
Обычно, процесс диссоциации записывают в виде уравнения, опуская растворитель (H2O)
NaCl
![]() Na++
Cl-
Na++
Cl-
Аналогично диссоциируют и молекулы с ковалентной полярной связью (например, HCl). Вокруг каждой полярной молекулы вещества также ориентируются диполи воды, которые своими отрицательными полюсами притягиваются к положительному полюсу молекулы, а положительными полюсами - к отрицательному полюсу. В результате этого взаимодействия связующее электронное облако (электронная пара) полностью смещается к атому с большей электроотрицательностью, полярная молекула превращается в ионную и затем легко образуются гидратированные ионы. Диссоциация полярных молекул может быть полной или частичной.

Рис.2. Схема диссоциации молекулы вещества с ковалентной
полярной связью
Электролитическая диссоциация HCl выражается уравнением
HCl
+ (m+n)H2O![]() H+(H2O)m
+ Cl-(H2O)n
H+(H2O)m
+ Cl-(H2O)n
или, опуская растворитель (H2O),
КАn
![]() K+
+ A-
K+
+ A-
Для количественной характеристики процесса диссоциации введено понятие степени диссоциации (α). Степень диссоциации электролита показывает, какая часть растворенных молекул вещества распалась на ионы. Степенью диссоциации электролита называется отношение числа продиссоциировавших молекул (Nдисс) к общему числу растворенных молекул (N)
![]() (1)
(1)
Степень диссоциации принято выражать или в долях единицы, или в процентах, например, для 0,1н раствора уксусной кислоты СН3СООН
α= 0,013 ( или 1,3). Степень диссоциации зависит от природы электролита и растворителя, температуры и концентрации.
По степени диссоциации (α) все электролиты делят на три группы. Электролиты со степенью диссоциации больше 0,3 (30%) обычно называют сильными, со степенью диссоциации от 0,02 (2%) до 0,3 (30%)—средними, менее 0,02 (2%)—слабыми электролитами.
Сильные электролиты — химические соединения, молекулы которых в разбавленных растворах практически полностью диссоциированы на ионы. В растворе сильного электролита растворённое вещество находится в основном в виде ионов (катионов и анионов); недиссоциированные молекулы практически отсутствуют. Степень диссоциации таких электролитов близка к 1. К сильным электролитам относятся:
1) кислоты (H2SO4, HCl, HNO3, HBr, HI, HClO4, HМnO4);
2) основания – гидроксиды металлов первой группы главной подгруппы (щелочи) – LiOH, NaOH, KOH, RbOH, CsOH, а также гидроксиды щелочноземельных металлов – Ba(OH)2 , Ca(OH)2, Sr(OH)2;.
3) соли, растворимые в воде (см. таблицу растворимости).
К электролитам средней силы относятся H3PO4, HF и др.
Слабые электролиты диссоциируют на ионы в очень малой степени, в растворах они находятся, в основном, в недиссоциированном состоянии (в молекулярной форме). К слабым электролитам относятся:
1) неорганические кислоты (H2CO3, H2S, HNO2, H2SO3 , HCN, H2SiO3, HCNS, HСlO, HClO2, HBrO, Н3ВО3 и др.);
2) гидроксид аммония (NH4OH);
3) вода Н2О;
4) нерастворимые и малорастворимые соли и гидроксиды некоторых металлов (см. таблицу растворимости);
5) большинство органических кислот (например, уксусная CH3COOH, муравьиная HCOOH).
Для слабых электролитов устанавливается равновесие между недиссоциированными молекулами и ионами.
CH3COOH![]() Н+
+ CH3COO-
Н+
+ CH3COO-
При установившемся равновесии на основании закона действующих масс
![]()
Константа диссоциации K указывает на прочность молекул в данном растворе: чем меньше K, тем слабее диссоциирует электролит и тем устойчивее его молекулы.
Константа диссоциации связана со степенью диссоциации зависимостью
![]() ,
,
![]()
![]() (2)
(2)
где – α –степень диссоциации;
c –молярная концентрация электролита в растворе, моль/л.
Если степень диссоциации α очень мала, то ею можно пренебречь, тогда
К=![]() или α=
или α=![]() (4)
(4)
Зависимость (4) является математическим выражением закона разбавления В. Оствальда.
Поведение растворов слабых электролитов описывается законом Оствальда, а разбавленных растворов сильных электролитов – Дебая-Хюккеля (5):
К=![]() ,
(5)
,
(5)
где концентрация (с) заменена на активность (а) наиболее точно характеризующую поведение сильных электролитов. Коэффициенты активности зависят от природы растворителя и растворенного вещества, от концентрации раствора, а также от температуры.
Активность связана с концентрацией следующим соотношением:
![]() (6)
(6)
где γ – коэффициент активности, который формально учитывает все виды взаимодействия частиц в данном растворе, приводящие к отклонению от свойств идеальных растворов.
Диссоциация различных электролитов
Согласно теории электролитической диссоциации, кислотой является электролит, диссоциирующий с образованием ионов Н+ и кислотного остатка
HNO3
![]() H+
+ NO3-
H+
+ NO3-
H2SO4
![]() 2H+
+ SO42-
2H+
+ SO42-
Электролит, диссоциирующий с образованием гидроксид-ионов ОН-, называется основанием. Например, гидроксид натрия диссоциирует по схеме:
NaOH
![]() Na+
+ OH-
Na+
+ OH-
Многоосновные кислоты, а также основания многовалентных металлов диссоциируют ступенчато, например,
1 ступень
H2CO3![]() H+
+ HCO3–
H+
+ HCO3–
2 ступень
HCO3–![]() H+
+ CO32–
H+
+ CO32–
Диссоциация по первой ступени характеризуется константой диссоциации K1 = 4,3·10–7
![]()
Диссоциация по второй ступени характеризуется константой диссоциации K2 = 5,6·10–11
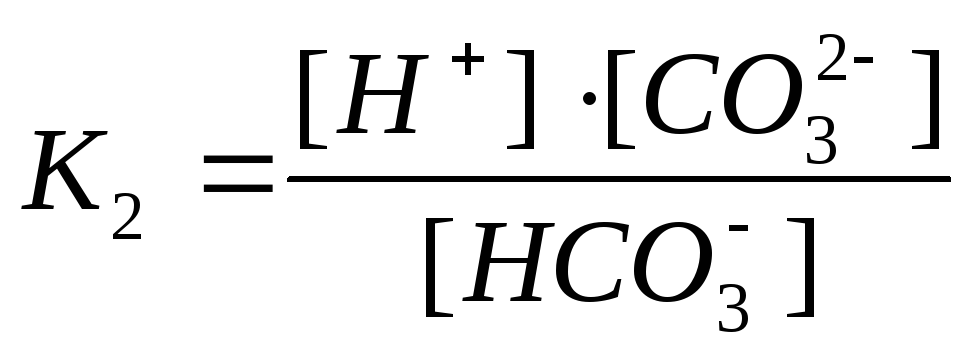
Суммарное равновесие
H2CO3![]() 2H+
+ CO32-
2H+
+ CO32-
Суммарная константа равновесия
![]()
Ступенчатая диссоциация многовалентных оснований
1 ступень Cu(OH)2
![]() [CuOH]+
+ OH-
[CuOH]+
+ OH-
![]()
2 ступень
[CuOH]+
![]() Cu2+
+ OH-
Cu2+
+ OH-
![]()
Для ступенчатой диссоциации всегда K1>K2>K3>..., т.к. энергия, которую необходимо затратить для отрыва иона, минимальна при отрыве его от нейтральной молекулы.
Электролиты называют амфотерными, если они диссоциируют как кислота и как основание, например, гидроксид цинка:
2H+
+ [Zn(OH)4]2-
![]() Zn(OH)2
+ 2H2O
Zn(OH)2
+ 2H2O
![]() [Zn(OH)2-2]+
2OH-
[Zn(OH)2-2]+
2OH-
К амфотерным электролитам относится гидроксид алюминия Al(OH)3, свинца Pb(OH)2, олова Sn(OH)2 и другие.
Средние (нормальные) соли, растворимые в воде, диссоциируют с образованием положительно заряженных ионов металла и отрицательно заряженных ионов кислотного остатка
Ca(NO3)2
![]() Ca2+
+ 2NO3–
Ca2+
+ 2NO3–
Al2(SO4)3 → 2Al3+ +3SO42–
Кислые соли (гидросоли) – электролиты, содержащие в анионе водород, способный отщепляться в виде иона водорода Н+. Диссоциация кислых солей происходит по ступеням, например:
1 ступень KHCO3
![]() K+
+ HCO3–
K+
+ HCO3–
2 ступень HCO3–![]() H+
+ CO32–
H+
+ CO32–
Степень электролитической диссоциации по второй ступени очень мала, поэтому раствор кислой соли содержит лишь незначительное число ионов водорода.
Основные соли (гидроксосоли) – электролиты, содержащие в катионе одну или несколько гидроксо-групп OH–.Основные соли диссоциируют с образованием основных и кислотных остатков. Например:
1 ступень
FeOHCl2![]() [FeOH]2+
+ 2Cl–
[FeOH]2+
+ 2Cl–
2 ступень [FeOH]2+
![]() Fe3+
+ OH–
Fe3+
+ OH–
Двойные соли диссоциируют на катионы металлов и анионы
KAl(SO4)2
![]() K+
+ Al3+
+ 2SO42-
K+
+ Al3+
+ 2SO42-
Комплексные соли диссоциируют с образованием комплексного иона
К3[Fe(CN)6]
![]() 3K+
+[Fe(CN)6]3-
3K+
+[Fe(CN)6]3-
Реакции обмена в растворах электролитов
Обменные реакции между электролитами в растворе идут в направлении связывания ионов и образования малорастворимых, газообразных веществ или слабых электролитов. Ионно-молекулярные или просто ионные уравнения реакций обмена отражают состояние электролита в растворе. В этих уравнениях сильные растворимые электролиты записывают в виде составляющих их ионов, а слабые электролиты, малорастворимые и газообразные вещества условно записывают в молекулярной форме, независимо от того, являются они исходными реагентами или продуктами реакции. В ионно-молекулярном уравнении одинаковые ионы из обеих его частей исключаются. При составлении ионно-молекулярных уравнений следует помнить, что сумма зарядов в левой части уравнения должна быть равна сумме зарядов в правой части уравнения. При составлении уравнений см. табл. 1,2 приложения.
Например, написать ионно-молекулярные уравнения реакции между веществма Сu(NO3)2 и Na2S.
Уравнение реакции в молекулярном виде:
Сu(NO3)2
+ Na2S
= СuS![]() +2NaNO3
+2NaNO3
В результате взаимодействия электролитов образуется осадок СuS.
Ионно-молекулярное уравнение
Сu2+
+ 2NO3-
+ 2Na++
S2-
= СuS![]() +2Na+
+ 2NO3-
+2Na+
+ 2NO3-
Исключив одинаковые ионы из обеих частей равенства Na+ и NO3- получим сокращенное ионно-молекулярное уравнение реакции:
Сu2+
+ S2-
= СuS![]()
Диссоциация воды
Вода является слабым электролитом и в малой степени диссоциирует на ионы
Н2О![]() Н+
+ ОН-
Н+
+ ОН-
К=![]()
или [H+][OH-] = K · [H2O] = Kв
Kв = 10-14 называется ионным произведением воды и является постоянной величиной. Для чистой воды при 250С концентрации ионов H+ и OH- равны между собой и равны 10-7моль/л, поэтому [H+]· [OH-]= 10-14.
Для нейтральных растворов [H+]=10-7, для кислых растворов [H+]>10-7, а для щелочных [H+]<10-7. Но какова бы ни была реакция раствора, произведение концентраций ионов водорода и гидроксид-ионов остается постоянным. Если концентрация ионов водорода равна 10-4, то концентриция гидроксид-ионов равна:
[OH-]= /10-4= 10-10 моль/л.
На практике кислотность или щелочность раствора выражают более удобным способом, используя водородный показатель рН или рОН.
рН =– lg[H+] ;
рОН =– lg[ОH-]
Например, если [H+] = 10-3 моль/л, то рН =– lg[10-3] = 3; если [H+] = 10-8 моль/л, то рН =– lg[10-8] = 8. В нейтральной среде рН = 7, в кислой среде рН< 7, в щелочной среде рН >7.
Приближено реакцию раствора можно определить с помощью специальных веществ, называемых индикаторами, окраска которых изменятся в зависимости от концентрации ионов водорода.
ТРЕБОВАНИЯ БЕЗОПАСНОСТИ ТРУДА
1. Опыты с неприятнопахнущими и ядовитыми веществами проводить обязательно в вытяжном шкафу.
2. При распознавании выделяющегося газа по запаху следует направлять струю движениями руки от сосуда к себе.
3. Выполняя опыт, необходимо следить за тем, чтобы реактивы не попали на лицо, одежду и рядом стоящего товарища.
При нагревании жидкостей, особенно кислот и щелочей, держать пробирку отверстием в сторону от себя.
При разбавлении серной кислоты нельзя приливать воду к кислоте, необходимо вливать кислоту осторожно, небольшими порциями в холодную воду, перемешивая раствор.
Отработанные растворы кислот и щелочей рекомендуется сливать в специально приготовленную посуду.
Все склянки с реактивами необходимо закрывать соответствующими пробками.
Оставшиеся после работы реактивы нельзя выливать или высыпать в реактивные склянки (во избежания загрязнения).
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
Задание 1. Изменение окраски индикаторов в нейтральной, кислой и щелочной среде.
Реактивы и оборудование: лакмус; метилоранж; фенолфталеин; раствор соляной кислоты HCl, 0,1н; раствор гидроксида NaOH, 0,1н; пробирки.
1. Налейте в три пробирки по 1-2 мл дистиллированной воды и прибавьте индикаторы: лакмус, метилоранж, фенолфталеин. Отметьте их цвет.
2. Налейте в три пробирки по 1-2 мл 0,1 раствора соляной кислоты и прибавьте тех же индикаторов. Наблюдайте изменение окраски индикаторов по сравнению с их цветом в воде.
3. Налейте в три пробирки по 1-2 мл 0,1н раствор гидроксида натрия и прибавьте тех же индикаторов. Наблюдайте изменение окраски индикаторов по сравнению с их цветом в воде.
Результаты наблюдения оформите в виде таблицы:
|
Среда |
Индикатор | ||
|
Лакмус |
Метилоранж |
Фенолфталеин | |
|
Нейтральная (рН = 7) |
|
|
|
|
Кислая (рН< 7) |
|
|
|
|
Щелочная (рН > 7) |
|
|
|
Задание 2. Относительная сила оснований
Реактивы и оборудование: раствор хлорида кальция СаCl2, 2н; раствор гидроксида NaOH, 2н; раствор гидроксида аммония NН4ОН, 2н; пробирки.
Налейте в две пробирки по 1-2 мл хлорида кальция, в первую пробирку прибавьте раствор гидроксида аммония, во вторую – столько же раствора гидроксида натрия.
Запишите наблюдения. Сделайте вывод о степени диссоциации указанных оснований.
Составьте уравнения происходящих реакций в молекулярном, ионном и сокращенном ионном виде.
Задание 3. Обменные реакции между растворами электролитов
Реактивы и оборудование: раствор хлорида железа FeCl3, 0,1н; раствор сернокислой меди CuSO4, 0,1н; раствор карбоната натрия Na2CO3, 0,1н; раствор гидроксида NaOH, 0,1н; раствор соляной кислоты HCl, 0,1н; раствор хлорида бария BaCl2, 0,1н; раствор сернокислого натрия Na2SO4, 0,1н; раствор гексацианоферрата(II) калия K4[Fe(CN)6], 0,1н; пробирки.
а) Реакции с образование нерастворимых веществ (осадка).
Налейте в первую пробирку 1-2 мл хлорида железа FeCl3 и прибавьте такой же объем гидроксида натрия NaOH , во вторую пробирку – 1-2 мл BaCl2 и такой же объем сернокислого натрия Na2SO4 .
Составьте уравнения происходящих реакций в молекулярном, ионном и сокращенном ионном виде.
б) Реакции с образованием газов.
Налейте в пробирку 1-2 мл раствора карбоната натрия Na2CO3 и добавьте такой же объем раствор соляной кислоты HCl.
Запишите наблюдения (укажите цвет и запах газа). Назовите полученнoе газообразнoе веществo.
Составьте уравнения происходящих реакций в молекулярном, ионном и сокращенном ионном виде.
в) Реакции, идущие с образованием малодиссоциирующих веществ .
Налейте в первую пробирку– 1-2 мл раствора гидроксида NaOH и добавьте такой же объем раствора соляной кислоты HCl, во вторую пробирку - 1-2 мл раствора сульфата меди CuSO4 добавить такой же объем раствора гексацианоферрата(II) калия K4[Fe(CN)6].
Запишите наблюдения (укажите цвет образовавшегося осадка комплексной соли гексацианоферрата меди).
Составьте уравнения происходящих реакций в молекулярном, ионном и сокращенном ионном виде.
Задание 4. Различие между двойной и комплексной солью
Реактивы и оборудование: раствор хлорида железа FeCl3, 0,1н; раствор роданида калия KSCN, 0,1н; раствор железо-аммиачных квасцов NH4Fe(SO4)2, 0,1н; раствор железо-синеродистого калия K3[Fe(CN)6]; 0,1н; пробирки.
1. В пробирку налейте раствор хлорного железа FeCl3, затем добавьте немного роданида калия KSCN. Запишите наблюдения.
Составьте уравнения происходящих реакций в молекулярном, ионном и сокращенном ионном виде. Ион SCN– является характерным реактивом на ион Fe3+, при их взаимодействии получается родановое железо Fe(SСN)3 – слабодиссоциирующая соль кроваво-красного цвета.
2. В одну пробирку налейте раствор железоаммиачных квасцов NH4Fe(SO4)2, в другую – раствор железо-синеродистого калия K3[Fe (CN)6] и в каждую из них прилейте понемногу раствор роданида калия KSCN.
Составьте уравнения происходящих реакций в молекулярном, ионном и сокращенном ионном виде.
Запишите наблюдения. В каком соединении обнаруживается ион трехвалентного железа? В каком соединении этот ион связан в виде комплексного иона?
Задание 5. Смещение ионного равновесия при введении в раствор одноименного иона
NH4ОН – слабое основание, диссоциирующее по уравнению:
NH4ОН![]() NH4++ОН–
NH4++ОН–
NH4Cl – в растворе диссоциирует по уравнению
NH4Cl
![]() NH4++
Cl
NH4++
Cl
Реактивы и оборудование: 0,1м раствор гидроксида аммония NH4OH, 0,1н; фенолфталеин, кристаллический хлорид аммония NH4Сl; пробирки.
В пробирку с раствором NH4ОН прибавьте 2-3 капли фенолфталеина, который является индикатором на группу ОН -, перемешайте и разлейте раствор в две пробирки: одну пробирку оставьте для сравнения, во вторую прибавьте щепотку кристаллического NH4Сl – наблюдается ослабление цвета раствора.
Ослабление малиновой окраски раствора объясняется тем, что при введении в раствор хлористого аммония увеличивается концентрация иона NH4+, что смещает равновесие в левую сторону, а это приводит к уменьшению концентрации ионов ОН– в растворе.
