
Биохимия_Ответы
.pdf28. Коферменти і вітаміни. Роль металів та інших кофакторів у функціонуванні ферментів.
Коферменты (синоним коэнзимы) — органические соединения небелковой природы, необходимые для осуществления каталитического действия многих ферментов. Соединяясь с белковой частью молекулы фермента — апоферментом, К. образуют каталитически активный комплекс — холофермент. Прочно связанные с белками К. называются простетическими группами. Многие К. легко отделяются от ферментного белка и служат переносчиками электронов, отдельных атомов или групп атомов субстрата, превращение которого катализирует данный фермент, т.е. функционируют в качестве промежуточных акцепторов. К. могут участвовать в активировании молекул субстратов, образуя с ними реакционно-способные соединения, которые затем подвергаются ферментативному превращению. Некоторые метаболиты, выступающие в ферментативных реакциях как обычные субстраты, в определенных условиях могут выполнять роль К. Многие К. являются производными витаминов, поэтому нарушение обмена веществ при витаминной недостаточности опосредовано через понижение активности определенных ферментов.
Коферменты, как правило, термостабильны, разнообразны по химическому строению и механизму действия. Наиболее распространенную группу составляют соединения нуклеотидной природы, а также К., содержащие остатки фосфорной кислоты. Адениловые нуклеотиды наряду с их ключевой ролью в обмене энергии (см. Макроэргические соединения, Обмен веществ и энергии) в качестве К. участвуют в реакциях переноса и активации орто- и пирофосфатных остатков, аминоацильных групп, остатков неорганических кислот. В группу адениловых нуклеотидов входят аденозинфосфорные кислоты — нуклеотиды, содержащие аденин, рибозу и остатки фосфорной кислоты (АДФ и АМФ). В подобных реакциях могут участвовать в качестве К. также производные инозин-5'-фосфорной и гуанозин-5'-фосфорной кислот. Гуаниловые рибонуклеотиды (гуанозин-5'- моно-, ди- и трифосфорные кислоты) выполняют роль К. в реакциях переноса сукцинильной группы, при биосинтезе рибонуклеопротеинов в микросомах, биосинтезе адениловой кислоты из инозиновой кислоты и др. Цитидиловые рибонуклеотиды (цитидил-5'-моно-, ди- и трифосфорные кислоты) играют роль К. при биосинтезе фосфолипидов, участвуя в переносе остатков, образующих полярные «головки» молекул фосфолипидов (0-фосфоэтанолхолина, 0-фосфоэтаноламина и др.). Уридиловые рибонуклеотиды (уридин-5'-моно, ди- и трифосфорные кислоты) участвуют в качестве К. в процессах трансгликозилирования (переноса остатков простых сахаров и их производных) при биосинтезе ди- и полисахаридов, гликозаминогликанов и реакциях взаимопревращения сахаров.
К важнейшим К. нуклеотидной природы относятся никотинамидные К. никотинамидадениндинуклеотид (НАД, NAD+; синоним: дифосфопиридиннуклеотид, ДПН; устаревшее кофермент I, Kol, козимаза, кодегидр (оген)аза I] и его фосфорилированное производное никотинамидадениндинуклеотидфосфат [НАДФ, NADP+; синоним: трифосфопиридиннуклеотид, ТПН; устаревшее кофермент II, KoII, фосфокозимаза, фосфокодегидр(оген)аза]. Никотинамидные К. входят в состав ряда дегидрогеназ — катализаторов ключевых окислительно-восстановительных реакций энергетического и пластического обмена. Молекула НАД представляет собой динуклеотид, построенный из аденинрибонуклеотида и никотинамидрибонуклеотида (последний отвечает за проявление каталитической активности НАД), связанных фосфоангидридным мостиком, а НАДФ имеет третий остаток фосфорной кислоты в положении 2' рибозы аденилового нуклеотида. Способность НАД и НАДФ переносить электроны и протоны от окисляемого субстрата к другому акцептору обеспечивает выполнение этими К. важной биологической функции в процессе клеточного дыхания (см. Дыхание тканевое). Окислительно-восстановительные реакции, протекающие с участием никотинамидных К., могут быть изображены в виде общего уравнения; АН2 + НАД(Ф)+ = А + НАД(Ф)Н + Н+, где АН2 восстановленная форма субстрата. А — окисленная форме субстрата. Эти реакции состоят в обратимом переносе двух восстановительных эквивалента от субстрата к окисленному никотинамидному К. Один восстановительный эквивалент присутствует в восстановленном К. в виде атома водорода, другой — в виде электроне, при этом катион второго атома водорода переходит в среду а виде свободного Н+. Обнаружено около 350 НАД(Ф)-зависимых дегидрогеназ, как правило, специфичных в отношении либо НАД, либо НАДФ. Обычно связь никотинамидных и других нуклеотидных К. с белками легко диссоциирует. НАД-зависимые дегидрогеназы участвуют преимущественно в процессах катаболизма (например, в клеточном дыхании), в НАДФ-зависимые — главным образом в анаболических процессах (восстановительных биосинтетических реакциях). Содержание никотинамидных К., соотношение между их окисленными

и восстановленными формами (НАДН и НАДФН), к также величию отношения НАД/НАДФ являются показателями активности метаболических процессов в ткани, характеризуют ее функциональное состояние. В организме НАД и НАДФ синтезируются из никотиновой кислоты (ниацина, или витамина РР) или никотинамида, поэтому недостаточность ниацина ведет к нарушению биосинтеза никотинамидных коферментов.
Определение этих К. производят обычно спектрофотометрически (по характерному поглощению окисленных форм при 260 нм восстановленных форм или при 340 нм), флюориметрически (длина волны возбуждения 340 нм, флюоресценции 480 нм) или потенциометрически.
Флавиновые нуклеотиды, или флавиновые К. (флавинмононуклеотид, ФМН, 5-фосфорный эфир рибофлавина.; флавинадениндинуклеотид, ФАД, рибофлавин-5'-аденозиндифосфат), являются К. так называемых флавопротеинов — ферментов, широко распространенных в живых клетках, принимающих участие в обмене основных классов органических соединений и играющих важную роль в процессе биологического окисления (см. Дыхание тканевое). К флавиновым К. относится рибофлавин (витамин В2), недостаточность которого приводит к нарушению нормального функционирования флавинзависимых ферментов. В окисленном состоянии флавиновые К. имеют интенсивный желтый цвет, в восстановленном состоянии они бесцветны. Как правило, ФМН и ФАД прочно связаны с соответствующими белками-апоферментами. Флавопротеины (ферменты, коферментами которых являются производные флавинов) принадлежат к дыхательным ферментам класса оксидоредуктаз. Механизм окислительно-восстановительных реакций, катализируемых ими, обусловлен последовательным окислением и восстановлением флавиновых коферментов. Ряд ферментов (например, монооксигеназы) наряду с флавиновыми используют и никотинамидные К. Определение флавиновых К. проводят спектрофотометрически или флюориметрически в характерных для них областях поглощения при определенных длинах волн.
Кофермент А (КоА, восстановленная форма KoASH; синоним коэнзим А) — соединение аденозин- 3',5'- -меркаптоэтиламида пантотеновой кислоты, образующее с остатками органических кислот (R) тиоэфиры типа R—СО—SKoA. Играет роль К. в переносе и активировании кислотных остатков в реакциях ацилирования, конденсации, оксидоредукции или гидратации органических кислот. КоА участвует в клеточном дыхании, биосинтезе и окислении жирных кислот, синтезе стероидов. Для нормального синтеза КоА необходимо адекватное поступление в организм пантотеновой кислоты, входящей в состав КоА.
Кофермент В12 (КоВ12, витамин В12) — -(5,6-диметилбензимидазолил)-кобаламинцианид является коферментом ферментов, участвующих в переносе одноуглеродных фрагментах, обмене метионина и других соединений. Недостаток в рационе витамина В12, вызывающий в организме дефицит кофермента В12, клинически проявляется мегалобластной гиперхромной анемией, ее так называемой нутритивной (алиментарной) В12-дефицитной формой. Эндогенная недостаточность витамина В12 вследствие нарушения всасывания этого витамина в кишечнике также приводит к дефициту кофермента В12, клинически проявляющемуся одной из форм мегалобластной гиперхромной анемии — пернициозной (В12-дефицитной) анемией, или анемией Аддисона — Бирмера.
Пиридоксальфосфат и его производные являются простетическими группами ряда ферментов, участвующих в обмене аминокислот (реакциях трансаминирования, декарбоксилирования и др.), а также фермента гликогенфосфорилазы. При недостаточном поступлении в организм пиридоксальфосфата — производного витамина В6 — нарушаются функции пиридоксальзависимых ферментов.
Дифосфотиамин является коферментом кетолаз и транскетолаз — ферментов, участвующих в -кетокислот и расщеплении углеродной цепи фосфорилированных сахаров, и
представляет собой производное витамина В1 (тиамина).
Менее распространены К. пептидной природы, важнейшим представителем которых является глутатион (CSH, ГSH, окисленный глутатион — CSSC или ГSSГ) — -L-глутамил-L-цистеинил-L- глицин, который принимает активное участие во многих окислительно-восстановительных реакциях и обеспечивает функционирование ряда SH-зависимых ферментов. Наиболее важной функциональной группой восстановленной формы глутатиона является сульфгидрильная (SH-) группа, которая легко подвергается ферментативному или неферментативному окислению с образованием дисульфидной (окисленной) формы глутатиона, состоящей из двух молекул восстановленного глутатиона (Г—S— S—Г). Таким образом глутатион функционирует как переносчик водорода. Глутатион принимает прямое участие в некоторых реакциях цис-транс-

изомеризации, является коферментом системы глиоксилазы, формальдегид-дегидрогеназы, глутатионпероксидазы. С генетически обусловленным нарушением обмена глутатиона связан ряд наследственных болезней, в т.ч. наследственные гемолитические анемии. Определение глутатиона производят колориметрически и ферментативными методами с применением глутатионпероксидазы и глутатионредуктазы.
Липоевая (тиоктовая) кислота — насыщенная серосодержащая жирная кислота — входит в качестве
-
-кетоглутаровой кислот). Выполняет роль промежуточного акцептора водорода и кислотных остатков за счет своей способности к обратимому восстановлению (переход S—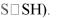
Витамины К — жирорастворимые соединения, производные нафтохинона — играют роль К. в реакциях системы свертывания крови. Их водорастворимый аналог — викасол — применяют в медицине в качестве лекарственного средства.
Биотин (витамин Н) — водорастворимый витамин — выступает в качестве К. (простетической группы) в составе ряда ферментов, катализирующих реакции карбоксилирования — декарбоксилирования некоторых органических кислот, например пируваткарбоксилазы и ацетил- КоА-карбоксилазы — ферментов начальных этапов глюконеогенеза и синтеза липидов соответственно. В активном центре молекулы карбоксилаз биотин прочно связан амидной связью с
-аминогруппой остатка лизина фермента.
О биохимической функции некоторых витаминов впервые стало известно в 30-е годы благодаря слиянию двух направлений исследований, одно из которых имело целью изучение химической структуры коферментов, а другое-изучение строения витаминов. В 1935 г. неметкому биохимику Отто Варбургу удалось выделить и установить структуру кофермента (сейчас его называют ниндинуклеотидфосфатом), необходимого для катализа определенных окислительновосстановительных реакций в клетке. Варбург показал, что один из компонентов этого кофермента представляет собой простое органическое соединение-никотинамид, которое задолг о до того было впервые выделено из табака. Несколько позже американские биохимики Д. Уайн Улли и Конрад Элведжем попитались установить химическое строение выделенного ими из мяса и других пищевых продуктов вещества, которое предотвращало или излечивало обусловленное неполноценным питанием заболевание собак «черный язык», аналогичное пеллагре человека. Улли и Элведжем были поражены тем, что по некоторым химическим свойствам выделенное ими вещество напоминало никотинамид. Поэтому они попробовали лечить собак чистым амидом, и такое лечение оказалось успешным. В скором времени было установлено, что никотинамидом можно излечивать также и пеллагру у людей. Теперь мы знаем, что никотинамид-это компонент кофермента, необходимого для ферментативного катализа ряда жизненно важных окислительных реакций. Несмотря на очень простое строение молекулы никотинамида, большинство животных не может синтезировать его в достаточных количествах и потому должно получать его с пищей. Вскоре после этого выяснилось, что другие витамины также функционируют в качестве компонентов коферментов и простетических групп ферментов. Содержание витаминов в пище может бать крайне незначительным, поскольку ферменты, выполняющие функции катализаторов, необходимы клеткам в очень низких концентрациях. Например, минимальное количество витамина В6, которое должно содержаться в суточном рационе человека, составляет около 2 мг, а витамина В, 2-менее 3 мкг. Примерно в то же время было обнаружено, что в пище животных, кроме витаминов, должен присутствовать целый ряд неорганических элементов, которые так же, как и коферменты, необходимы для активности определенных ферментов. В качестве примера можно привести цинк - незаменимый элемент питания человека и животных, являющийся важным компонентом множества различных ферментов. В этой главе мы в общих чертах рассмотрим функции различных витаминов как коферментов. В последующих главах мы узнаем, почему не достаток витаминов, а следовательно, и нарушение действия ферментов могут приводить к серьезным изменениям ключевых путейметаболизма углеводов, жиров и белков.
29. Гормони: загальна характеристика, роль у міжклітинній інтеграції функцій організму. Класифікація гормонів.
Гормоны — сигнальные вещества, образующиеся а клетках эндокринных желез. После синтеза гормоны поступают в кровь и переносятся к органам-мишеням, где выполняют определенные биохимические и физиологические регуляторные функции. Границы между гормонами и другими сигнальными веществами, такими, как медиаторы, нейромедиаторы и ростовые факторы довольно условные. Часто эти сигнальные вещества имеют общие закономерности биосинтеза, метаболизма и механизма действия.
Существуют три класса гормонов: пептидные, стероидные и амины. К числу пептидных гормонов, которые могут содержать от 3 до 200 аминокислотных остатков, относятся все гормоны гипоталамуса и гипофиза, а также инсулин и глюкагон, секретируемые поджелудочной железой. Гормоны, принадлежащие к классу аминов, представляют собой низкомолекулярные водорастворимые соединения, содержащие в своем составе аминогруппы, к их числу относятся адреналин, секретируемый мозговым слоем надпочечников, и тиреоидные гормоны. К стероидным гормонам (которые хорошо растворимые в жирах) относятсягормоны коры надпочечников, андрогены (мужские половые гормоны) и эстрогены (женские половые гормоны). Из всех гормонов наиболее полно изучен адреналин. Его хорошо известный механизм действия используется в качестве модели при исследовании других гормонов. Органы мишени адреналина – печень и скелетные мышци, а также сердце и сердечно – сосудистая система. Адреналин и норадреналин очень близкие по структуре гормоны. Они образуются в мозговом слое надпочечнков, расположенных непосредственно над почками.
Гормоны щитовидной железы представляют два различных класса гормонов, выполняющих разные физиологические функции. Щитовидная железа производит два так называемых тиреоидных гормона:
•тироксин
•трийодтиронин, Они являются йодированными производными аминокислоты тирозина и отличаются лишь числом
атомов |
йода |
в |
молекуле, |
но |
имеют |
общие |
физиологические |
свойства. |
|
Кроме |
того, |
щитовидная |
железа |
производит |
также |
пептидный |
гормон |
||
•тиреокальцитонин (кальцитонин), который принимает участие в регуляции фосфорно-кальциевого обмена, активности остеокластов и остеобластов. Гормоны щитовидной железы обладают специфической чертой. Для их биологической активности требуется микроэлемент йод, который в малых количествах присутствует в пище и воде. Превращение минерального йода в форму, способную включаться в состав органических веществ осуществляется с помощью сложного механизма и может идти лишь в одном органе человеческого организма - щитовидной железе.
Ворганизме человека насчитываются разнообразные гормоны: гормоны щитовидной железы, женские гормоны, мужские гормоны, гормоны крови, гормоны роста, стероидные гормоны, гормоны отвечающие за рост груди, пептидные гормоны и некоторые другие.
Каждый гормон является центральным звеном сложной системы гормональной регуляции. Гормоны синтезируются в виде предшественников, прогормонов, а зачастую и депонируются, в специализированных клетках эндокринных желез. Отсюда они по мере метаболической необходимости поступают в кровоток. Большинство гормонов переносится в виде комплексов с плазматическими белками, так называемыми переносчиками гормонов, причем связывание с переносчиками носит обратимый характер. Гормоны разрушаются соответствующими ферментами, обычно в печени. Наконец, гормоны и продукты их деградации выводятся из организма экскреторной системой, обычно почками. Все перечисленные процессы влияют на концентрацию гормонов и осуществляют контроль за передачей сигналов.
Ворганах-мишенях имеются клетки, несущие рецепторы, способные связывать гормоны и тем самым воспринимать гормональный сигнал. После связывания гормонов рецепторы передают информацию клетке и запускают цепь биохимических реакций, определяющих клеточный ответ на действие гормона.
Используются в организме для поддержания его гомеостаза, а также для регуляции многих функций (роста, развития, обмена веществ, реакции на изменения условий среды).
Когда гормон, находящийся в крови, достигает клетки-мишени, он вступает во взаимодействие со специфическими рецепторами; рецепторы «считывают послание» организма, и в клетке начинают происходить определенные перемены. Каждому конкретному гормону соответствуют исключительно «свои» рецепторы, находящиеся в конкретных органах и тканях — только при взаимодействии гормона с ними образуется гормон-рецепторный комплекс.
Механизмы действия гормонов могут быть разными. Одну из групп составляют гормоны, которые соединяются с рецепторами, находящимися внутри клеток — как правило, в цитоплазме. К ним относятся гормоны с липофильными свойствами — например, стероидные гормоны (половые, глюко- и минералокортикоиды), а также гормоны щитовидной железы. Будучи жирорастворимыми, эти гормоны легко проникают через клеточную мембрану и начинают взаимодействовать с рецепторами в цитоплазме или ядре. Они слабо растворимы в воде, при транспорте по крови связываются с белками-носителями. Считается, что в этой группе гормонов гормон-рецепторный комплекс выполняет роль своеобразного внутриклеточного реле — образовавшись в клетке, он начинает взаимодействовать с хроматином, который находится в клеточных ядрах и состоит из ДНК и белка, и тем самым ускоряет или замедляет работу тех или иных генов. Избирательно влияя на конкретный ген, гормон изменяет концентрацию соответствующей РНК и белка, и вместе с тем корректирует процессы метаболизма.
Биологический результат действия каждого гормона весьма специфичен. Хотя в клетке-мишени гормоны изменяют обычно менее 1 % белков и РНК, этого оказывается вполне достаточно для получения соответствующего физиологического эффекта.
Большинство других гормонов характеризуются тремя особенностями:
они растворяются в воде;
не связываются с белками-носителями;
начинают гормональный процесс, как только соединяются с рецептором, который может находиться в ядре клетки, ее цитоплазме или располагаться на поверхности плазматической мембраны.
Вмеханизме действия гормон - рецепторного комплекса таких гормонов обязательно участвуют посредники, которые индуцируют ответ клетки. Наиболее важные из таких посредников — ц АМФ (циклический аденозинмонофосфат), инозитолтрифосфат, ионы кальция. Так, в среде, лишенной ионов кальция, или в клетках с недостаточным их количеством действие многих гормонов ослабляется; при применении веществ, увеличивающих внутриклеточную концентрацию кальция, возникают эффекты, идентичные воздействию некоторых гормонов. Участие ионов кальция как посредника обеспечивает воздействие на клетки таких гормонов, как вазопрессин и катехоламины. Однако есть гормоны, у которых внутриклеточный посредник до сих пор не обнаружен. Из наиболее известных таких гормонов можно назвать инсулин, у которого на роль посредника предлагали цАМФ и цГМФ, а также ионы кальция и даже перекись водорода, но убедительных доказательств в пользу какого-нибудь одного вещества до сих пор нет. Многие исследователи считают, что в таком случае посредниками могут выступать химические соединения, структура которых полностью отличается от структуры уже известных науке посредников.
Выполнив свою задачу, гормоны либо расщепляются в клетках-мишенях или в крови, либо транспортируются в печень, где расщепляются, либо, наконец, удаляются из организма в основном с мочой (например, адреналин).
Общие свойства гормонов:
1.Строгая специфичность физиологического действия.
2.Высокая биологическая активность: гормоны оказывают свое физиологическое действие в чрезвычайно малых дозах.
3.Дистантный характер действия: клетки-мишени располагаются обычно далеко от места образования гормона.
4.Многие гормоны (стероидные и производные аминокислот) не имеют видовой специфичности.
5.Генерализованность действия.
6.Пролонгированность действия.
30. Біологічні мембрани. Функції, будова. Будова ліпідного біслоя, типи зв`язків та рух його окремих компонентів. Білки мембран. Механізми трансмембранного переносу.
Клеточная мембрана (или цитолемма, или плазмалемма, или плазматическая мембрана) отделяет содержимое любой клетки от внешней среды, обеспечивая ее целостность; регулируют обмен между клеткой и средой; внутриклеточные мембраны разделяют клетку на специализированные замкнутые отсеки — компартменты или органеллы, в которых поддерживаются определенные условия внутриклеточной среды.
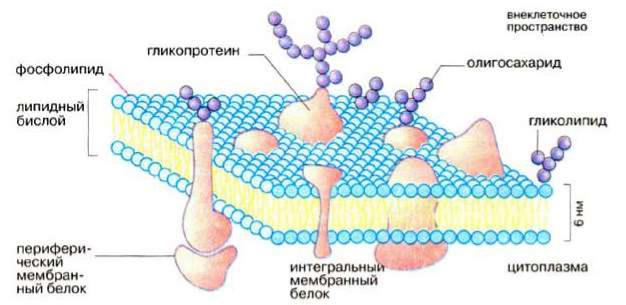
Плазматическая мембрана, или плазмалемма, — наиболее постоянная, основная, универсальная для всех клеток мембрана. Она представляет собой тончайшую (около 10 нм) пленку, покрывающую всю клетку. Плазмалемма состоит из молекул белков и фосфолипидов. Все биомембраны построены одинаково; они состоят из двух слоев липидных молекул толщиной около 6 нм, в которые встроены белки. Некоторые мембраны содержат, кроме того, углеводы, связанные с липидами и белками. Соотношение липиды : белки : углеводы является характерным для клетки или мембраны и существенно варьирует в зависимости от типа клеток или мембран. Компоненты мембран удерживаются нековалентными связями , вследствие чего они обладают лишь относительной подвижностью, т. е. могут диффундировать в пределах липидного бислоя. Текучесть мембран зависит от липидного состава и температуры окружающей среды. С увеличением содержания ненасыщенных жирных кислот текучесть возрастает, так как наличие двойных связей способствует нарушению полукристаллической мембранной структуры. Подвижными являются и мембранные белки. Если белки не закреплены в мембране, они «плавают» в липидном бислое как в жидкости. Поэтому говорят, что биомембраны имеют жидкостно-мозаичную структуру.
Биомембраны и их составляющие выполняют следующие функции:
1.Ограничение и обособление клеток и органелл. Обособление клеток от межклеточной среды обеспечивается плазматической мембраной, защищающей клетки от механического и химического воздействий. Плазматическая мембрана обеспечивает также сохранение разности концентраций метаболитов и неорганических ионов между внутриклеточной и внешней средой.
2.Контролируемый транспорт метаболитов и ионов определяет внутреннюю среду, что существенно для гомеостаза, т.е. поддержания постоянной концентрации метаболитов и неорганических ионов, и других физиологических параметров. Регулируемый и избирательный транспорт метаболитов и неорганических ионов через поры и посредством переносчиков становится возможным благодаря обособлению клеток и органелл с помощью мембранных систем.
3.Восприятие внеклеточных сигналов и их передача внутрь клетки, а также инициация сигналов.
4.Ферментативный катализ. В мембранах на границе между липидной и водной фазами локализованы ферменты. Именно здесь происходят реакции с неполярными субстратами. Примерами служат биосинтез липидов и метаболизм неполярных ксенобиотиков . В мембранах локализованы наиболее важные реакции энергетического обмена, такие, как окислительное фосфорилирование и фотосинтез.
5.Контактное взаимодействие с межклеточным матриксом и взаимодействие с другими клетками при слиянии клеток и образовании тканей.
6.Заякоривание цитоскелета , обеспечивающее поддержание формы клеток и органелл и клеточной подвижности.
Липидный бислой - это основная структура мембраны , которая создает относительно непроницаемый барьер для большинства водорастворимых молекул. Липидный бислой - основа мол. организации мембран биологических. Легко формируется липидами, у к-рых невелики различия между площадью поперечного сечения головки и углеводородных цепей. Это свойственно
большинству фосфолипидов биол. мембран. Характерный признак липидов, образующих липидный бислой, - низкая величина критич. концентрации мицеллообразования (ок. 10-10 М). Толщина липидного бислоя определяется прежде всего длиной углеводородных цепей и обычно находится в пределах 4-5 нм. Присутствие в цепях цис-двойных связей, боковых метильных групп и др. заместителей нарушает плотность упаковки молекул и приводит к уменьшению толщины бислоя. В зависимости от т-ры липидный бислой может находиться в двух состояниях - кристаллическом (гелевом) и жидкокристаллическом.
Протеины могут связываться с мембраной различным путем.
Интегральные мембранные белки имеют трансмембранные спирализованные участки (домены), которые однократно или многократно пересекают липидный бислой. Такие белки прочно связаны с липидным окружением.
Периферические мембранные белки удерживаются на мембране с помощью липидного «якоря» и связаны с другими компонентами мембраны; например, они часто бывают ассоциированы с интегральными мембранными белками.
У интегральных мембранных белков фрагмент пептидной цепи, пересекающий липидный бислой, обычно состоит из 21-25 преимущественно гидрофобных аминокислот, которые образуют правую α- спираль с 6 или 7 витками (трансмембранная спираль).
Простейшей формой транспорта через биомембраны является свободная диффузия (облегченная диффузия). Она часто облегчается определенными мембранными белками, которые можно разделить на две группы:
1. Канальные белки образуют в биомембранах заполненные водой поры, проницаемые для
определенных ионов. Например, имеются специфические ионные каналы для ионов Na+, К+, Са2+ и
Cl- .
2. В отличие от ионных каналов транспортные белки избирательно связывают молекулы субстрата и за счет конформационных изменений переносят их через мембрану. В этом отношении транспортные белки (белки-переносчики, пермеазы) похожи на ферменты. Единственное различие состоит в том, что они «катализируют» направленный транспорт, а не ферментативную реакцию. Они проявляют специфичность - иногда групповую - к субстратам, подлежащим переносу. Кроме того, для них характерны определенное сродство, выражаемое в виде константы диссоциации Kd и максимальная транспортная способность V. Свободная диффузия и транспортные процессы, обеспечиваемые ионными каналами и переносчиками, осуществляются по градиенту концентрации или градиенту электрическою заряда (называемым вместе электрохимическим градиентом). Такие механизмы транспорта классифицируются как «пассивный транспорт». Некоторые транспортные процессы осуществляются за счет гидролиза других макроэргических соединений, таких, например, как фосфоенолпируват, или за счет энергии света. Активный перенос может сочетаться с другим, спонтанно идущим транспортным процессом (так называемый вторичный активный транспорт). Так, к примеру, происходит в эпителиальных клетках кишечника и почек, где глюкоза переносится против концентрационного градиента за счет того, что одновременно с глюкозой из просвета кишечника и первичной мочи переносятся ионы Na+. Здесь движущей силой для транспорта глюкозы является градиент концентрации ионов Na+ . С помощью транспортных систем осуществляется регуляция объема клеток, величины рН и ионного состава цитоплазмы. Благодаря транспортным системам клетки накапливают метаболиты, важные для обеспечения энергетического цикла и метаболических процессов, а также выводят в окружающую среду токсические вещества. Транспортные системы обеспечивают поддержание ионных градиентов, существенно важных для окислительного фосфорилирования и стимуляции мышечных и нервных клеток .
