
Text_lektsiy_z_TTD_chastina_1__3-y_sem_ukr_2015
.pdf
Розділ 1: Лекція №3 |
21 |
P |
|
1 |
a |
|
|
У плоских координатах нерівноважні процеси |
|||||||||
|
|
|
|||||||||||||
Pa |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
зображуються умовно (штриховою лінією) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
va (Ta) |
|
v (T) |
|||||
2. КРУГОВІ І НЕКРУГОВІ ПРОЦЕСИ.
а) Кругові процеси або цикли - сукупність процесів, при здійснення яких
РТ повертається у вихідний стан. Таким чином, цикл - круговий процес робочого тіла.
P |
|
|
Визначальна ознака кругових процесів: |
||
|
|||||
|
|
|
|
|
|
|
|
|
|
∫dZ = 0 |
|
|
|
|
де Z - будь-який з параметрів стану, тобто зміна будь- |
||
|
|
|
якої характеристики стану в круговому процесі (циклі) |
||
|
|
|
|||
|
|
T |
|||
|
|
|
дорівнює 0 . |
||
|
|
Цикли мають важливе значення, бо по прямим циклам (за годинниковою стріл- |
|||
кою ) працюють теплові двигуни, за зворотними циклами (проти годинникової стріл-
кои) - холодильні установки (ХУ), тепло-насосні установки (ТНУ).
б) Некругові або розімкнені процеси - початковий і кінцевий стани не спів-
падають. Цикли можна розбити на декілька розімкнених процесів.
3 . ОБОРОТНІ І НЕОБОРОТНІ ПРОЦЕСИ.
Ця класифікація враховує не лише характер зміни стану РТ, але і особливо-
сті його енергообміну із зовнішніми джерелами (із зовнішнім середовищем), з
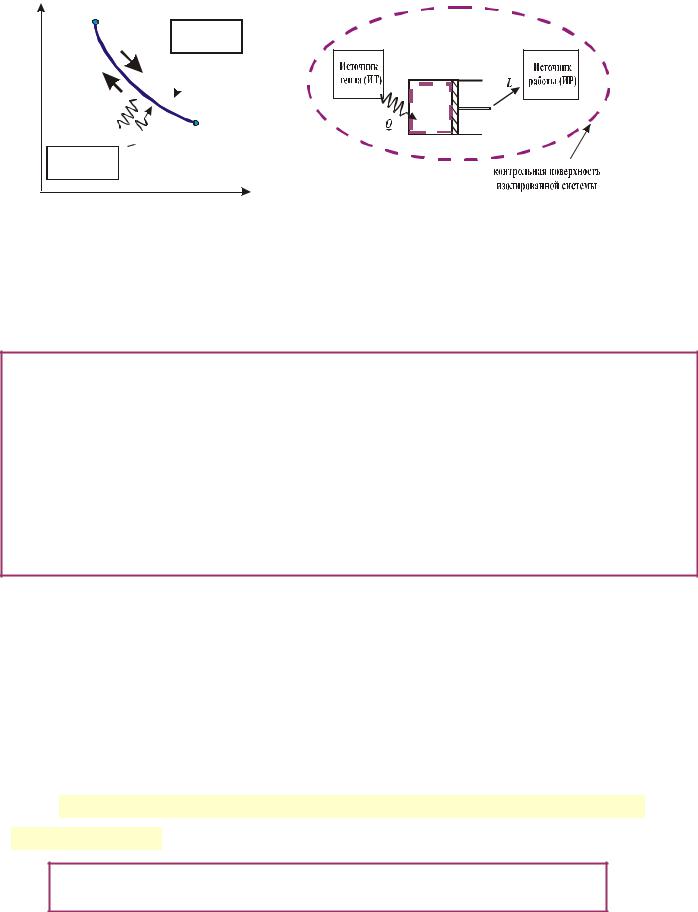
якими РТ утворює ізольовану систему.
а) Оборотний процес - процес (уявний), що гранично ідеалізується, допус-
кає можливість його протікання в протилежному напрямку через ті ж стани РТ і
до того ж так, що всі складові ізольованої системи, здійснюючи прямий і зворот-
ний процес, повертається у вихідний стан (само тіло і джерела). (Не плутати обо-
ротний і зворотний процес).
ТТД Лекції (3-й семестр) |
2015 р |
Розділ 1: Лекція №3 |
22 |
P |
1 |
|
Источник |
|
работы |
L

2
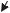
 Q
Q
Источник
теплоты
v (T)
Пізнавальна цінність оборотних процесів: вони мають найвищу енергетич-
ну ефективність і тому є еталоном енергетичної ефективності для реальних про-
цесів.
УМОВИ ОБОРОТНОСТІ ТЕПЛОМЕХАНІЧНИХ ПРОЦЕСІВ
1) Відсутність тертя в РТ ( δLr = δQr = 0 ) –рівноважний процес (гідравлічний опір дорівнює 0 ) - умова внутрішньої оборотності
2) Теплообмін між РТ і джерелом теплоти повинен протікати при нескінченно малій різниці температур Tр.т . − Tд.т . = dT >< 0 ( практично Tр.т. = Tи.т. ) - умова зов-
нішньої оборотності
З розгляду двох умов оборотності витікає, що кожен оборотний процес
обов'язково рівноважний ( Lr = Qr = 0 ), але не кожен рівноважний є оборотним
зважаючи ( завдяки) на другу умову оборотності (вона може не виконуватися).
Друга умова оборотності виконується в адіабатних процесах, в яких робо-
че тіло не віддає і не отримує теплоту із зовні.
За визначенням адіабатний процес – це процес, що протікає без зовніш-
нього теплообміну.
Ознака адіабатного процесу: δQ = 0 Q = 0
ТТД Лекції (3-й семестр) |
2015 р |
Розділ 1: Лекція №3 |
23 |
Отже: адіабатний оборотний процес = адіабатний рівноважний.
Введемо поняття узагальненого тертя (механічне, термічне, електричне,
магнітне, хімічне ). Узагальнене тертя породжує узагальнений опір, де і протікає процес переходу впорядкованого руху в хаотичний. Тоді оборотний процес - це процес, що протікає без узагальненого тертя і відповідно без узагальненого опо-
ру. Тобто, в ньому немає переходу впорядкованого руху в хаотичний.
б) Необоротний процес - це процес, в якому хоч би одна з умов оборотнос-
ті не виконується. Тоді процеси умовно рівноважні і нерівноважні (протікають з тертям) - завідомо необоротні.
Всі реальні процеси - необоротні.
У пропонованому курсі ми вивчатимемо дві необоротності реальних проце-
сів:
·пов'язані з тертям
·пов'язані з теплообміном при кінцевій різниці температур між РТ і
джерелом.
Завдання інженера: необхідно навчитися розрізняти ці необоротності і зна-
ти технічні рішення, за допомогою яких їх можна зменшувати.
ТТД Лекції (3-й семестр) |
2015 р |

Розділ 1: Лекція №3 |
24 |
Питання для самоперевірки знань з ТТД за Розділом 1 (лекція №3).
1.Термодинамічний процес – будь яка послідовна зміна стану робочого тіла (системи) під впливом енергообміну із зовнішнім середовищем.
2.Рівноважний процес - це безперервна послідовність рівноважних станів РТ, можливий при нескінченно повільному протіканні процесу і відсутності тертя. Таким чином, це процес, що ідеалізується.
3. |
Ознаки рівноважного процесу: |
Lr = Qr = 0 (відсутність тертя) |
4. |
Умовно рівноважні процеси - це реальні процеси (протікають з тертям |
|
Lr = Qr > 0 ), але для яких з достатньою для практики точністю всі проміжні стани і кінцеві можна вважати рівноважними.
5.Нерівноважні процеси - реальні процеси, що характеризуються неоднаковістю параметрів по всій масі РТ в проміжних станах (В курсі ТТД вивчають такі нерівноважні процеси, в яких проміжні стани,
- не рівноважні, а початковий і кінцевий - обов'язково рівноважні.)
6.Кругові процеси або цикли - сукупність процесів, в результаті здійснення, яких РТ повертається у вихідний стан.
7.Цикл - круговий процес робочого тіла.
8.По прямим циклам (за годинниковою стрілкою ) працюють теплові двигуни, за
зворотними циклами (проти годинникової стрілки) - холодильні установки (ХУ), тепло-насосні установки (ТНУ).
9.Оборотний процес - процес (уявний), що гранично ідеалізується, допускає можливість його протікання в протилежному напрямку через ті ж стани РТ і до того ж так, що всі складові ізольованої системи, здійснюючи прямий і зворотний процес, повертається у вихідний стан (само тіло і джерела). (Не плутати оборотний і зворотний процес).
10.Пізнавальна цінність оборотних процесів: вони мають найвищу енергети-
чну ефективність і тому є еталоном енергетичної ефективності для реальних процесів
11.Умови оборотності тепломеханічних процесів
1) Відсутність тертя в РТ ( δLr = δQr = 0 ) –рівноважний процес (гідравлічний опір дорівнює 0 )
2) Теплообмін між РТ і джерелом теплоти повинен протікати при нескінченно малій різниці температур Tр.т. − Tи.т. = dT ( практично Tр.т. = Tи.т. )
Яка умова оборотності завідомо виконується в адіабатних процесах – друга, бо за визначенням адіабатний процес протікає без зовнішнього теплообміну.
12.Необоротний процес - це процес, в якому хоч би одна з умов оборотності
не виконується.
Дві необоротності реальних процесів: 1) тертя по ходу РТ
2) теплообмін при кінцевій різниці температур T ( t ) між РТ і джере-
лом.
ТТД Лекції (3-й семестр) |
2015 р |
Розділ 1: Лекція № 4 |
25 |
Лекція №4 |
Дата: _________ |
1.6ТЕПЛОМЕХАНІЧНА ВЗАЄМОДІЯ В РІВНОВАЖНИХ ПРОЦЕСАХ. ВИЗНАЧЕННЯ
КІЛЬКОСТІ ТЕПЛОТИ І РОБОТИ В РІВНОВАЖНИХ ПРОЦЕСАХ ДЛЯ ЗАКРИТИХ СИСТЕМ.
Мірою механічної і теплової взаємодії є відповідно кількість теплоти і ро- боти. При кількісній оцінці енергообміну розрізняють роботу і теплоту
а) у рівноважних процесах (ознака Lr = Qr = 0 ) б) у реальних процесах (ознака Lr = Qr > 0 )
Для технічних цілей важливо отримати Q і L через параметри робочого тіла (системи).
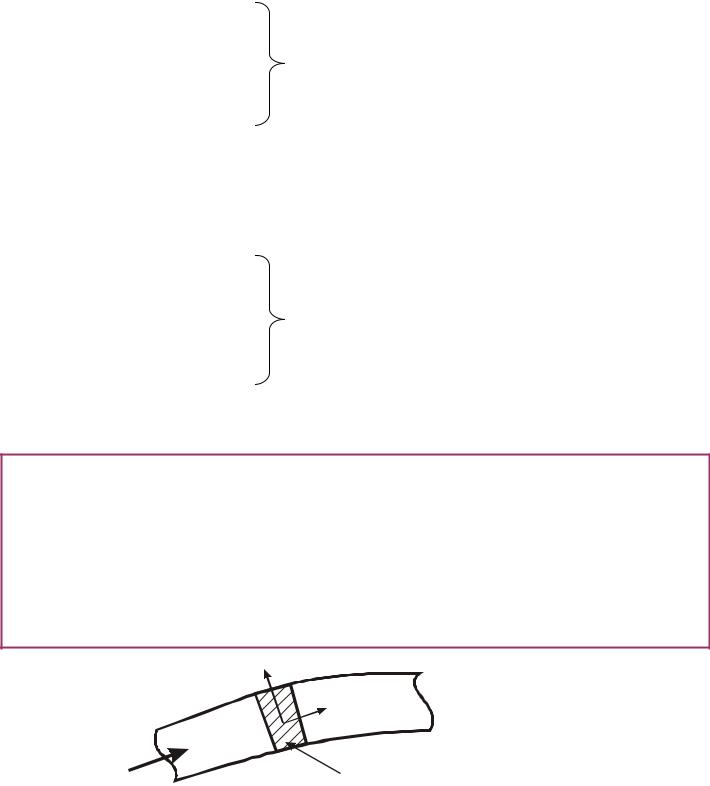
1.6.1. ДЕФОРМАЦІЙНА (ТЕРМОДИНАМІЧНА) РОБОТА В РІВНОВАЖНИХ ПРОЦЕСАХ.
Розглянемо закриту систему. Газ в циліндрі може стискуватися і розширю- ватися, при цьому обмінюючись енергією із зовнішнім середовищем через повер-
хню поршня у формі роботи розширення або стискання. Якщо РТ розширюєть-
ся, то РТ долає опір зовнішнього середовища і виконує роботу; при стискуванні зовнішнє середовище виконує роботу над газом.
f - площа поршня
Q
L
dx
контрольна поверхня
системи
Хай в результаті підведення елементарної кількості теплоти δQ робоче тіло (РТ) розширюється, при цьому поршень переміститься на відстань dx .
Об'єм при цьому зміниться на величину dV = f dx
Газ (РТ) діє на поршень з силою і виконує елементарну деформаційну роботу.
Робота=сила × путь
δL = p f dx = p dV
Елемен- сила Путь тарна робота
Величина δL є енергією, яка передається у формі роботи через контрольну
поверхню закритої системи. При стискуванні ( dV < 0 ) маємо δL < 0 , ( робоче тіло отримує роботу). При розширенні (δV > 0 ) маємо δL > 0 (робоче тіло віддає енер-
гію у формі роботи).
ТТД (3-й семестр) |
2015 р. |
Розділ 1: Лекція № 4 |
26 |
δL = pdV |
|
|
2 |
Деформаційна робота для рівно- |
|
L = ∫ pdV |
||
|
1важних процесів в повних вели-
2 |
|
L = ∫δL |
чинах. |
1 |
|
З урахуванням того, що L = l m и V = v m
δl = pdv
2 |
Деформаційна робота для рівно- |
|
l = ∫ pdv |
||
|
1важних процесів в питомих ве-
2 |
|
l = ∫δl |
личинах. |
1 |
|
Примітки:
а) Отримані вирази справедливі для будь-якої конфігурації виділеного об'єму РТ за умови, що система розглядається як закрита система.
б) Отримані вирази справедливі для будь-якої закритої системи ( m = const ): тобто не лише для не потокових процесів, але і для потокових процесів, в яких виділений об'єм розглядається, як закрита система.
y
x
Поток |
Закрита система (m=const) |
речовини |
|
Звернемо увагу, що зміна об'єму є ознакою того, що енергообмін у формі дефор-
маційної роботи має місце. Причиною, що породжує цей енергообмін, є тиск.
ТТД (3-й семестр) |
2015 р. |

Розділ 1: Лекція № 4 |
27 |
1.6.2. УЗАГАЛЬНЕНІ ВИРАЗИ ДЛЯ РІЗНИХ ВИДІВ ЕНЕРГЕТИЧНИХ ВЗАЄМОДІЙ (У ФОРМІ ВІДПОВІДНОГО ВИГДУ РОБОТИ) В РІВНОВАЖНИХ ПРОЦЕСАХ.
З курсу фізики відомо, що в рівноважних процесах при енергетичних взає-
модіях елементарна кількість енергії, що передається може бути представлена в узагальненому вигляді
δE = y dX
δE - елементарна кількість енергії, що передається у формі відповідного виду ро-
боти;
y - узагальнена сила (потенціал), величина, що породжує дану взаємодію (причи-
на його);
X - узагальнена координата даної взаємодії (заряд) - величина, яка змінюється за наявності даної взаємодії (ознака того, що взаємодія має місце).
У виразу для деформаційної роботи роль потенціалу (причина) виконує аб-
солютний p тиск, а роль координати взаємодії - об'єм V .
1.6.3. ЕЛЕМЕНТАРНА КІЛЬКІСТЬ ТЕПЛОТИ В РІВНОВАЖНИХ ПРОЦЕСАХ
Аналогічно δE = y dX для елементарної кількості теплоти можна записати де δQ - елементарна кількістьδ Q =енергіїTdS , що передається у формі теплоти;
T - термодинамічна температура [K], узагальнена сила (тепловий потенціал), причина, що породжує дану взаємодію у формі теплоти;
S - ентропія - величина, зміна якої є ознакою теплової взаємодії (узагальнена координата).
Факт існування ентропії і її зміни під впливом теплової взаємодії безпосере-
дньо виявити неможливо, оскільки він не пов'язаний ні з одним фізичним ефектом,
який дозволяє спостереження або вимір. У цьому полягає складність сприйняття ентропії. На відміну від ентропії всі інші величини, що входять в узагальнене рів-
няння δE = y dX можна виміряти.
ТТД (3-й семестр) |
2015 р. |

Розділ 1: Лекція № 4 |
28 |
Правомірність існування ентропії встановлюється зіставленням всіх виснов-
ків, які виходять з рівняння δQ = T dS , з даними значного досвіду, накопиченого
людством. Безумовний експериментальний і науковий факт існування ентропії
вводиться в науку як принцип існування ентропії і відноситься до другого закону
термодинаміки.
Фізичний сенс ентропії розкривається в статистичній фізиці, яка вивчає мікроскопічну структуру речовини із залученням теорії вірогідності. Там показа-
но, що ентропія є мірою хаотичності руху мікрочасток, з яких складається ті-
ло. При підводі до системи (тілу) енергії у формі теплоти, міра хаотичності руху
мікрочасток зростає (зростає внутрішня невпорядкованість, хаотичність), а при ві-
дведенні - навпаки, зменшується.
У рівноважних процесах, відповідно до рівняння δQ = T dS знак теплоти, як алгебраїчної величини, залежить від характеру зміни ентропії тіла:
якщо теплота підводиться до тіла (δQ > 0 ),то ентропія (міра хаотичності) збільшується ( dS > 0 ),а при відведенні (δQ > 0 ) – зменшується ( dS < 0 ).
δQ = TdS
2 |
Вираз для теплоти в рівноваж- |
|
Q = ∫TdS |
||
|
1них процесах (у повних величи-
2 |
|
Q = ∫δQ |
нах). |
1 |
|
З урахуванням того, що Q = q m та S = s m
δq = Tds
2 |
Вираз для теплоти в рівноважних |
|
q = ∫Tds |
||
процесах (у питомих величинах). |
||
1 |
||
2 |
||
|
||
q = ∫δq |
|
|
1 |
|
Зауваження по розділу 1.6:
1.Формули для Q, L ( l , q ) виведені для закритих систем і можуть застосовуватися для не потокових (типу циліндра з поршнем) і потокових процесів.
2.Отримані формули справедливі не лише для рівноважних процесів, але і для оборотних, бо друга умова оборотності не впливає на виведення отриманих
формул.
1.У отриманих виразах величини теплоти і роботи – алгебраїчні , тобто можуть мати знак «+» та «-».
. З цього місця матеріал наданий для студентів як СРС до Лекції №4
ТТД (3-й семестр) |
2015 р. |
Розділ 1: Лекція № 4 |
29 |
1.7ГРАФІЧНЕ ПРЕДСТАВЛЕННЯ РЕЗУЛЬТАТІВ ЕНЕРГООБМІНУ (ДЕФОРМАЦІЙНОЇ
РОБОТИ І КІЛЬКОСТІ ТЕПЛОТИ) В РІВНОВАЖНИХ І ОБОРОТНИХ ПРОЦЕСАХ.
1.7.1. ДЕФОРМАЦІЙНА РОБОТА
2
Кількість роботи в рівноважному процесі дорівнює l1− 2 = ∫ pdv
1
Для вирішення інтеграла необхідно знати залежність p = p(v ) у процесі, тобто рівняння процесу. З рівняння для деформаційної роботи, витікає, що в pv ко-
ординатах площа під кривою процесу 1-2 ( обмежена кривою рівноважного про- цесу і віссю абсцис) є деформаційною роботою процесу.
Оскільки площа під кривою процесу (рівноважного і оборотного) еквівалентна роботі, то діаграму часто називають робочою.
p |
|
1 |
|
|
б |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рівноважний процес: |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
a |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
δl = pdv |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p - причина (потенціал); |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
δl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
v - узагальнена координата. |
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
v1 |
|
|
|
|
|
|
|
|
|
|
v2 |
|
|
|
v |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
dv |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Приклади: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
для ІГ |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
pv1 = RT1 |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
а) p = const |
|
(ізобарний процес) |
l = ∫ pdv = p( v2 − v1 ) = |
|
|
= R( T2 |
− T1 |
) |
|||||||||||||||||||||||||||||||||||||
|
|
pv2 = RT2 |
|
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
б) v = const |
|
(ізохорний процес) |
l = ∫ pdv = 0 , так как dv = 0 ( v 2 |
|
= v1 ) |
|
|
|
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
в) |
pv = const ( ізотермічний процес T = const - |
рівнобока гіпербола |
в |
|
pv корд.) |
|
|
|
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
з врахуванням |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
2 |
|
2 |
|
|
|
|
|
|
dv |
|
|
|
p1v1 = p2 v2 = |
|
|
|
|
|
v2 |
|
|
|
|
|
p2 |
|
|
|
|
|
p2 |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
l = ∫ pdv = ∫ pv |
|
= |
|
= p1v1 |
ln |
= − p1v1 ln |
|
= − RT ln |
|
|
|||||||||||||||||||||||||||||||||||
|
|
|
= pv = const |
|
|||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
p |
p |
|
||||||||||||||||||||||||||||||||||||||
|
1 |
|
1 |
|
|
|
|
|
|
v |
|
|
|
|
|
|
|
v |
1 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
1 |
|
|
||||||||
г) |
pv k = const (ізоентропний процес s = const |
|
|
|
|||||||||||||||||||||||||||||||||||||||||
- |
гіпербола |
в pv корд., але більш крута, чим |
|||||||||||||||||||||||||||||||||||||||||||
рівнобока гіпербола |
для ізотерми) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
з врахуванням що: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
p v k = p |
v k = |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
1 |
|
1 |
2 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
2 |
|
= pv k = const |
2 |
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
||||||||||||||||||
l = ∫ pdv = |
|
= ∫ pv nv − ndv = |
|
( p1v1 − p2v2 ) = |
|
|
(T1 − T2 ) = |
|
|
|
|||||||||||||||||||||||||||||||||||
|
k − |
1 |
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||
|
k − 1 |
|
|
|
|||||||||||||||||||||||||||||||||||||||||
|
1 |
|
|
pv1 |
|
= RT1 |
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
pv2 |
|
= RT2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
ТТД (3-й семестр) |
2015 р. |

Розділ 1: Лекція № 4 |
30 |
з врахуванням що: |
|
|
|
|
|
|
|
|
|
v |
2 |
|
k |
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
p1 = p2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
v1 |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
v |
|
|
|
|
|
k −1 |
|
|
|
|
|
p |
|
|
k −1 |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p v |
|
|
k |
|||||||||||||
|
R |
|
T |
|
|
2 |
|
|
|
|
|
1 |
|
2 |
|
|||||||||||||||
|
|
|
|
|
T1 = T2 |
|
|
|
|
|
|
|
= |
= |
1 |
1 − |
|
|
|
|||||||||||
= |
|
1 |
− |
2 |
|
= |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
k − 1 |
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
k − 1 |
|
T1 |
|
|
v1 |
|
|
|
|
p1 |
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
p |
k −1 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
= T2 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
p2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Ааналіз:
1) Робота є функцією процесу, тобто залежить від шляху процесу 1-2 і визначається площею під кривою процесу. При цьому робота l1a 2 буде менше ніж робота
l1б2
l1a 2 < l1б2
2)Якщо dv > 0 , то l > 0 . - газ розширюється, робота відводиться (здійснюється газом).
Якщо dv < 0 , то l < 0 . - газ стискується, робота підводиться (витрачається на стискування).
Якщо dv = 0 v = const ( процес ізохорний), то l = 0 .
3)Прямі цикли - реалізуються в теплових двигунах (ДВС, ГТУ, ПТУ .) де теп-
лота перетворюється на роботу. Теплоту отримують, використовуючи первинні енергоресурси (ПЕР): нафта, вугілля, газ, мазут і так далі. У pv координатах (діаграмі) прямі цикли зображуються по ходу годинникової стрілки.
p |
lвідв=l1а2 >0 |
|
|
a |
|
|
|
|
|
|
|
1 |
lцикла >0 |
|
|
|
2 |
|
|
|
б |
|
|
|
|
|
|
|
lпідв=l2б1 <0 |
|
|
v1 |
v2 |
|
v |
Прямий цикл складається з двох процесів:
процесу 1а2 ( dv > 0 , lотв = l1а2 > 0 - РТ розширюється)
та
ТТД (3-й семестр) |
2015 р. |
