
- •Кафедра химии и экологии в строительстве
- •Общие методические указания
- •Контрольная работа
- •Раздел 1. Моль. Эквиваленты и эквивалентные массы простых и сложных веществ. Закон эквивалентов.
- •Основные физические величины
- •Основные понятия
- •1.2. Теоретическая часть.
- •Эквиваленты и молярные массы эквивалентов
- •Контрольные задания
- •Раздел 2. Строение атома и периодическая система элементов д.И.Менделеева
- •2.1. Электронная структура атома.
- •Электроотрицательности элементов по шкале л. Полинга
- •Примеры образования ионов за счет отдачи или присоединения электронов атомами
- •Контрольные задания
- •Раздел 3. Химическая связь
- •Примеры электронных формул атомов
- •Сравнение видов химической связи.
- •Метод валентных связей
- •Метод молекулярных орбиталей
- •Контрольные задания
- •Раздел 4. Основные классы неорганических соединений. Классификация сложных неорганических веществ.
- •Оксиды и их классификация.
- •Основания. Свойства и классификация оснований. Щелочи.
- •Амфотерные основания.
- •Соли. Названия и классификация солей.
- •Соли. Получение и химические свойства.
- •Контрольные задания
- •Раздел 5. Основы химической термодинамики. Общие закономерности протекания химических процессов
- •Внутренняя энергия и энтальпия
- •Термохимия. Термохимические уравнения. Термохимические расчёты
- •Энергия гиббса
- •Контрольные задания
- •Контрольная работа № 2
- •Раздел 6. Основы химической кинетики
- •Химическая кинетика и катализ.
- •Химическое равновесие.
- •Контрольные задания
- •Раздел 7. Способы выражения концентрации растворов. Свойства растворов. Температура кипения и замерзания растворов.
- •Контрольные задания
- •Раздел 8. Окислительно-восстановительные реакции.
- •Классификация. Различают четыре типа окислительно-восстановительных реакций.
- •Контрольные задания
- •Раздел 9. Гидролиз солей.
- •Водородный показатель (рН): в воде всегда присутствует немного катионов водорода и гидроксидионов, которые образуются в результате обратимой диссоциации:
- •Контрольные задания
- •Раздел 10. Коллоидные растворы Общие сведения
- •Классификация дисперсных систем.
- •Свободная поверхностная энергия и устойчивость дисперсных систем.
- •Образование высокодисперсных систем.
- •Внутренняя структура коллоидных частиц
- •Свойства коллоидных растворов
- •Оптические свойства коллоидных растворов
- •Молекулярно-кинетические свойства коллоидных растворов
- •Электрические свойства коллоидных растворов
- •Коагуляция
- •Контрольные задания
- •Варианты контрольных заданий
Амфотерные основания.
Гидроксид цинка Zn(OH)2 является малорастворимым основанием. Его можно получить, действуя щелочью на какую-нибудь растворимую соль цинка – при этом Zn(OH)2 выпадает в осадок:
ZnCl2 + 2 NaOH = Zn(OH)2 + 2 NaCl
Подобно всем другим основаниям, осадок гидроксида цинка легко растворяется при добавлении какой-нибудь кислоты:
Zn(OH)2 + H2SO4 = ZnSO4 + 2 H2O
Если же вместо кислоты к осадку гидроксида цинка добавить избыток щелочи, то он также растворяется, чего не происходит с другими гидроксидами. Почему Zn(OH)2 растворяется в щелочи?
Это явление объясняется тем, что в присутствии избытка сильного основания гидроксид цинка способен отдавать атомы водорода, подобно кислоте:
-
Zn(OH)2
+
2 NaOH
=
Na2ZnO2
+
2 H2O
гидроксид цинка
щелочь
соль
вода
H2ZnO2
+
2 NaOH
=
Na2ZnO2
+
2 H2O
цинковая кислота
щелочь
соль
вода
Происходит реакция нейтрализации наподобие той, которая могла бы произойти между NaOH и кислотой. Эта кислота (цинковая кислота H2ZnO2) и гидроксид цинка Zn(OH)2 являются одним и тем же соединением! Сокращенная (но не структурная) формула этого соединения может быть записана двумя способами:
Zn(OH)2 или H2ZnO2 – это две сокращенные формулы;
H–O–Zn–O–H единственная структурная формула.
Поскольку прочность связей Н–О и O–Zn сравнимы между собой, гидроксид цинка способен быть как основанием в присутствии кислоты, так и кислотой – в присутствии основания:
|
|
H2SO4 |
|
2 NaOH |
|
|
2 H2O + ZnSO4 |
= |
Zn(OH)2 = H2ZnO2 |
= |
Na2ZnO2 + 2 H2O |
|
реагирует как основание |
|
|
|
реагирует как кислота |
Данное свойство гидроксидов называется амфотерностью.
Амфотерными называются такие гидроксиды, которые способны отдавать в реакциях с другими соединениями как атомы (ионы) водорода, так и гидрокси-группы (анионы гидроксила).
Помимо гидроксида цинка, амфотерными свойствами обладают гидроксиды некоторых других металлов: Al(OH)3, Cr(OH)3, Be(OH)2, Sn(OH)4, Pb(OH)2.
Объяснение проявления амфотерности у одних металлов и отсутствие ее у других следует искать в теории химической связи.
Можно заметить, что амфотерные свойства проявляют те металлы, которые в Периодической таблице находятся наиболее близко к неметаллам. Как известно, неметаллы обладают большей электроотрицательностью (по сравнению с металлами), поэтому их связь с кислородом носит ковалентный характер и отличается значительной прочностью.
Связи между металлами и кислородом, как правило, ионные (из-за низкой электроотрицательности металлов). Такие связи часто менее прочны, чем ковалентные.
Рассмотрим структурные формулы трех разных соединений: гидроксида бора B(OH)3, гидроксида алюминия Al(OH)3 и гидроксида кальция Ca(OH)2.
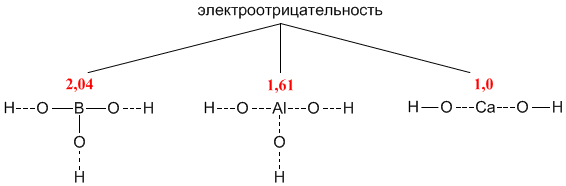
Соединение B(OH)3 имеет внутри молекулы наиболее «ковалентную» связь бора с кислородом, поскольку бор ближе по электроотрицательности к кислороду, чем Al и Сa. Из-за высокой электроотрицательности бору энергетически выгоднее входить в состав отрицательно заряженной частицы – то есть кислотного остатка. Поэтому формулу B(OH)3 чаще записывают как H3BO3:
H3BO3 = 3H+ + BO33- (в растворе)
Кальций – наименее электроотрицательный из этих элементов, поэтому в его молекуле связь Са–О носит ионный характер. Из-за низкой электроотрицательности для кальция выгодно существование в виде катиона Ca2+:
Ca(OH)2 = Ca2+ + 2OH- (в растворе)
В связи с этим в структурных формулах пунктирными линиями отмечены связи, разрыв которых энергетически более выгоден.
Структурные формулы показывают, что соединение B(OH)3 будет легче отдавать ионы водорода, чем ионы гидроксида, т.е. является кислотой (и по традиции должно быть записано сокращенной формулой H3BO3). Напротив, Ca(OH)2 – типичное основание. Гидроксид алюминия, в котором центральный атом имеет промежуточную электроотрицательность, может проявлять как свойства кислоты, так и основания – в зависимости от партнера по реакции нейтрализации. Это наблюдается в действительности. В первой из приведенных ниже реакций Al(OH)3 реагирует как обычное основание, а в следующих – как кислота:
2 Al(OH)3 + 3 H2SO4 = Al2(SO4)3 + 6 H2O.
Al(OH)3 = H3AlO3 + NaOH = NaH2AlO3 + H2O, причем если реакцию проводить при нагревании, то соль NaH2AlO3 теряет одну молекулу воды и образуется алюминат натрия NaAlO2. В растворе алюминат натрия, наоборот, легко присоединяет воду и существует в виде соли Na[Al(OH)4]. Итак:
Al(OH)3 + NaOH = NaAlO2 + 2 H2O (при сплавлении);
Al(OH)3 + NaOH = Na[Al(OH)4] (при добавлении раствора NaOH без нагревания).
У цинка электроотрицательность практически такая же, как у алюминия (1,65), поэтому гидроксид цинка Zn(OH)2 проявляет похожие свойства. Таким образом, амфотерные гидроксиды взаимодействуют как с растворами кислот, так и с растворами щелочей.
