
Методичка 6М
.PDFМинистерство путей сообщения Российской Федерации Дальневосточный государственный университет путей сообщения
Кафедра «Физика»
В.Б. Гороховский
ИЗУЧЕНИЕ НЕКОТОРЫХ ТЕРМОДИНАМИЧЕСКИХ СОСТОЯНИЙ ГАЗА
Методические указания на выполнение лабораторных работ
Хабаровск
2000
УДК 536.7(075.8) ББК В 317.1
Г 703
Рецензент:
Доцент кафедры «Физика»
Дальневосточного государственного университета путей сообщения
Л.Л. Коваленко
Гороховский В.Б.
Изучение некоторых термодинамических состояний газа.
Г703 Методические указания на выполнение лабораторной работы.
–Хабаровск: Изд-во ДВГУПС, 2000. – 14 с.: ил.
Методические указания составлены на выполнение лабораторной рабо- ты по разделу «Основы термодинамики». В теоретической части даны за- коны термодинамики и их применение к изопроцессам. Понятия удельной и молярной теплоемкостей и связь между ними, адиабатный процесс. Ука- зания содержат описание рабочей установки и метода лабораторного ис- следования. В заключительной части предусмотрено дополнительное за- дание для студентов, которые успешно справляются с основной задачей. Для защиты лабораторной работы приведены контрольные вопросы.
Указания предназначены для студентов первого курса всех технических специальностей дневной и заочной форм обучения.
УДК 536.7(075.8) ББК В 317.1
© Издательство Дальневосточного государственного университета путей сообщения (ДВГУПС), 2000
2
ВВЕДЕНИЕ
Метод молекулярно-кинетической теории является одним из способов изучения свойств вещества в газообразном, жидком и твердом состояниях, а также взаимных переходов из одного состояния в другое. Этот метод, применяемый для объяснения макроскопических свойств тел с точки зре- ния их молекулярного строения, есть по существу статистический.
Однако возможен и другой способ описания явлений, без детального рассмотрения тех микроскопических процессов, которые при этом проис- ходят. Такое описание можно сделать, исходя из понятий об энергии, ее превращениях и способах передачи.
Метод, рассматривающий процессы с энергетической точки зрения, на- зывается термодинамическим. С его помощью можно изучать свойства идеального и реального газов, упругость и сжимаемость, адсорбцию и диффузию, поведение вещества под действием давления и температуры, испарение и конденсацию, плавление, кристаллизацию и другие явления.
С помощью термодинамического метода решается множество вопросов в учении об электричестве, магнетизме, излучении и т. п. Он, кроме физики и химии, используется в ряде технических наук.
Весь этот широкий круг вопросов о свойствах энергии и законах ее пре- вращений, а также о процессах и состоянии равновесия в системах, в ко- торых наблюдаются тепловые эффекты, составляет предмет термодина- мики.
Среди многочисленных разделов современной физики термодинамика занимает особое положение. Это связано с тем, что любая форма энергии при ее превращениях в конце концов переходит в теплоту. В теплоту пере- ходит механическая энергия, энергия электрического тока, энергия света, энергия химической реакции и т. д. Любой вид энергии в процессе пре- вращений может пройти через многие формы энергии, но конечным ре- зультатом всех таких превращений непременно является теплота.
Наибольший практический интерес представляет превращение механи-
ческой энергии в теплоту и обратный процесс получения механической работы за счет теплоты.
При выполнении лабораторной работы студент изучает некоторые термодинамические состояния газа.
В рассматриваемой лабораторной работе даются основные положения термодинамики, подробно рассматривается теплоемкость газов при раз- личных условиях, применяется первое начало термодинамики к различ- ным изопроцессам, и изучается адиабатный процесс. Конечной целью ра- боты является определение показателя адиабаты.
3
ЦЕЛЬ РАБОТЫ
Определить отношение удельных теплоемкостей воздуха при постоян- ном давлении и постоянном объеме.
Приборы и принадлежности: стеклянный баллон с краном; жидкостный манометр; микрокомпрессор.
1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
1.1. Основные положения термодинамики
Термодинамикой называется раздел физики, в котором изучаются условия превращения энергии из одного вида в другой, и качественные соотношения при таких превращениях. В основе термодинамики лежат экспериментально установленные законы (начала) термодинамики. С по- мощью этих законов можно, не принимая во внимание молекулярное строение веществ, получить много сведений о свойствах тел и закономер- ностях процессов, происходящих с телами в различных условиях. Для
описания состояния термодинамической системы вводятся физические величины, называемые термодинамическими параметрами или парамет- рами состояния системы. Основными параметрами состояния системы яв- ляются: давление Р, удельный объем Vуд, занимаемый единицей массы вещества, и температура Т.
Для однородного тела удельный объем равен отношению его объема к массе:
Vуд= V/m.
Два состояния системы считаются различными, если для них неодина- ковы значения хотя бы одного из термодинамических параметров.
Состояние системы называется стационарным, если оно не изменяется со временем. Это означает, что ни один из термодинамических параметров, определяющих состояние, не изменяется с течением времени.
Равновесное состояние устанавливается в системе при постоянных внешних условиях и сохраняется в системе произвольно долго. Во всех частях системы, находящейся в состоянии термодинамического равнове- сия, температура одинакова. Температура равновесной системы является мерой интенсивности теплового движения ее молекул, то есть средней ки- нетической энергии.
Между тремя параметрами состояния системы существует связь, назы- ваемая уравнением состояния. Оно записывается в форме функциональ- ной зависимости давления в системе от объема и температуры.
P = f(V, T) |
(1.1) |
4
Идеальным газом называется газ, молекулы которого не взаимодей- ствуют друг с другом на расстоянии и имеют исчезающе малые собст-
венные объемы. У реальных газов молекулы испытывают силы межмоле- кулярного взаимодействия притяжения и отталкивания. Уравнение состоя-
ния идеального газа для произвольной массы имеет вид: |
|
||
pV = |
m |
RT , |
(1.2) |
|
|||
|
m |
|
|
где p, V и T – давление, объем и абсолютная температура газа, R – уни- версальная газовая постоянная, численно равная работе, совершенной
одним молем идеального газа при изобарном повышении температуры на один градус:
|
p(V |
μ - V μ ) |
|
|
|
R = |
2 |
1 |
|
, |
(1.3) |
|
T |
||||
|
|
|
|
||
где V2μ и V1μ – конечный |
и |
начальный объем моля газа |
R = |
||
= 8,31 Дж/моль К = 8,31×103 Дж/кмоль К. |
|
|
|||
Другой вид уравнения состояния идеального газа |
|
||||
|
p = nkT |
|
(1.4) |
||
где n – концентрация молекул газа, то есть число молекул в единице объ- ема газа; k – постоянная Больцмана, k = 1, 38×10-23 Дж/К.
1.2. Теплоёмкость газов
Одной из важнейших физических характеристик газов является тепло- емкость. Различают удельную и молярную теплоемкость.
Удельной теплоемкостью газов с называется величина, численно равная количеству теплоты, которое необходимо сообщить единице массы газа, чтобы увеличить его температуру на один градус.
Молярной (мольной) теплоемкостью Сμ называется величина, чис- ленно равная количеству теплоты, которое необходимо сообщить од- ному молю газа, чтобы увеличить его температуру на один градус:
Cμ = μc |
(1.5) |
где m – молярная масса газа.
Удельная и молярная теплоемкости газа зависят от условий, при кото- рых проводится нагревание, то есть от характера термодинамического процесса. Например, можно проводить нагревание при постоянном объе- ме или при постоянном давлении. Тогда получим соответственно теплоем- кость при постоянном объеме Сv или при постоянном давлении Сp. При этом всегда Сp > Сv.
5
Эта зависимость теплоемкости газов от условий нагревания может быть выяснена при использовании уравнения состояния идеального газа и первого начала термодинамики. Первое начало термодинамики формули-
руется так: количество теплоты dQ переданное системе, затрачивает- ся на увеличение ее внутренней энергии dU и на работу dА, совершае-
мую системой против внешних сил
dQ = dU + dA |
(1.6) |
||||
Изменение внутренней энергии идеального газа равно: |
|
||||
dU = |
m |
|
i |
RdT |
(1.7) |
|
|
||||
|
μ 2 |
|
|||
где i – число степеней свободы молекулы газа, то есть наименьшее число координат, которое необходимо задать, чтобы определить положение мо- лекулы в пространстве.
Элементарная работа
|
dA = pdV |
(1.8) |
||||||||
По определению теплоемкость равна |
|
|
|
|||||||
|
C = |
dQ |
|
|
|
|
(1.9) |
|||
dT |
|
|
||||||||
|
|
|
|
|
|
|||||
Разделив выражение (1.6) на dT, получим |
|
|||||||||
C = |
dQ |
= |
dU |
|
+ |
dA |
(1.10) |
|||
dT |
dT |
dT |
||||||||
|
|
|
|
|
||||||
Если при изменении температуры объем газа не меняется (V = const),
процесс называется изохорическим: V = const, dV = 0, dA = pdV = 0.
Все подводимое к газу тепло идет на увеличение его внутренней энер- гии. Тогда из уравнения (1.10) следует, что молярная теплоемкость при постоянном объеме газа равна:
|
Cvμ |
= |
dU |
|
|
(1.11) |
||
|
dT |
|||||||
|
|
|
|
|
||||
Процесс, протекающий при постоянном давлении |
(р=const) называ- |
|||||||
ется изобарическим. В этом случае уравнение (1.10) будет иметь вид: |
||||||||
C |
μ = |
dU |
+ p |
dV |
|
(1.12) |
||
|
|
|||||||
p |
|
dT |
|
|
dT |
|
||
|
|
|
|
|
||||
Из уравнения состояния для одного моля газа pV = RT получаем pdV + Vdp = RdT.
Но р=const, dp = 0, следовательно,
pdV = RdT.
6
|
Подставив это выражение в (1.12), получим |
|
||||
|
|
C |
μ = dU |
+ R , |
|
|
|
dU |
p |
|
dT |
|
|
|
|
|
|
|
||
но |
= Cvμ , следовательно, |
|
|
|
|
|
dT |
|
|
|
|
||
|
Cpμ = Cvμ + R |
(1.13) |
||||
|
|
|||||
Формула (1.13) носит название уравнения Майера. Смысл уравнения Майера заключается в том, что при изобарическом нагревании газа на один градус к газу должно быть подведено большее количество теплоты, чем для такого же изохорического нагревания. Разность количеств теплот должна быть равна работе совершаемой газом при изобарическом расши- рении.
Теплоемкость вещества (при Т = const) в изотермическом процессе из определения, уравнение (1.9), равна бесконечности, так как dT = 0, а dQ ¹ 0, то С = ¥. При изотермическом процессе первое начало термоди-
намики имеет вид
dQ = dA |
(1.14) |
так как при Т = const, dT = 0 и dU = 0, U = const. С точки зрения производ- ства работы газом, этот изопроцесс наивыгоднейший. Работа совершае- мая газом при Т = const:
v2 |
m |
v2 |
dV |
|
m |
|
V2 |
|
Q = A = òpdV = |
|
RT ò |
|
= |
|
RT ln |
|
(1.15) |
m |
V |
m |
V |
|||||
v11 |
|
v1 |
|
|
|
|
1 |
|
где m/m – количество молей газа, содержащихся в массе m, Т – постоянная температура газа, V1 и V2 – начальный и конечный объем газа.
Из молекулярно-кинетической теории следует, что Сpμ и Сvμ зависят от числа степеней свободы i молекул, из которых состоит газ:
Cpμ = |
i + 2 |
R |
(1.16) |
|||
|
||||||
|
|
2 |
|
|
|
|
Cvμ = |
i |
R |
(1.17) |
|||
2 |
||||||
|
|
|
|
|
||
Молекула одноатомного газа имеет три степени свободы (i = 3), жест- кая молекула двухатомного газа – пять (i = 5), трехатомного и многоатом- ного – шесть (i = 6). Отсюда следует, что молекулярная теплоемкость це- ликом определяется природой газа. Отношение теплоемкости газа Сp к
Сv называется показателем адиабаты.
Для идеального газа
g = |
Cp |
= |
i + |
2 |
(1.18) |
Cv |
i |
|
|||
|
|
|
|
||
|
|
|
|
|
7 |
Величина γ играет очень большую роль в проведении термодинамичес- ких и газодинамических расчетов, в особенности таких, которые связаны с адиабатическими процессами.
1.3. Адиабатный процесс
Если быстро сжимать газ или предоставить ему возможность быстро расширяться, причем изменение объема газа осуществлять без теплооб- мена с окружающей его средой, то такой процесс изменения состояния га-
за называется адиабатическим (адиабата).
При адиабатическом сжатии изменяется не только объем и давление газа, как при изотермическом процессе, но также изменяется и температура. Это изменение температуры газа происходит вследствие того, что за счет работы, затрачиваемой на сжатие газа, увеличивается его внутренняя энергия. Сле- довательно, уменьшение объема газа при адиабатическом сжатии должно повлечь за собой большее, чем при изотермическом сжатии, увеличение дав- ления.
Примером адиабатного процесса может служить весьма быстрое рас- ширение в атмосферу газа, помещенного в теплоизолированный сосуд, при быстром открывании крана. Адиабатный процесс должен происходить на столько быстро, чтобы не успел произойти теплообмен газа с атмосфе- ры при открывании крана.
Согласно первому началу термодинамики, теплота сообщаемая рас-
ходуется на увеличение ее внутренней энергии и на совершение системой работы против внешних сил, то есть
dQ = dU +dA.
При адиабатическом процессе dQ = 0, следовательно, dA = -dU, то есть работа, совершаемая газом при расширении, осуществляется за счет уменьшения внутренней энергии вещества.
Адиабатический процесс подчиняется закону Пуассона
pV γ |
= const |
(1.19) |
|
1−γ |
|
|
|
Tp |
γ |
= const |
(1.20) |
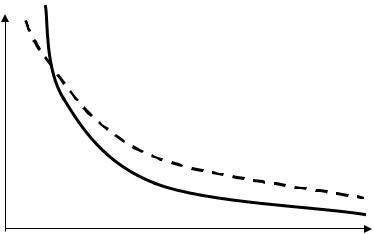
На рис. 1.1, на P – V диаграмме, сплошной линией изображена кривая, опи- сывающая адиабатическое сжатие. На этом же рисунке пунктиром показана изотерма, соответствующая температуре газа в начальном состоянии. Из ри- сунка видно, что адиабата идет круче, чем изотерма.
При помощи адиабатического процесса с той или иной степенью приб- лижения можно рассматривать широкий круг практических задач. К их числу относятся следующие задачи:
– нахождение скорости распространения звука в газах;
8
– течение газа по входным устройствам компрессоров, турбинах и соплах реактивных двигателей и т.д.
P
V
Рис.1.1. Сравнение графиков изотермического и адиа-
батического процессов
В табл.1.1 приведены сводные данные о характеристиках изопроцессов в газах.
Таблица 1.1
Сводные данные о характеристиках изопроцессов в газах
|
Условия |
Связь |
|
|
|
|
|
Кол-во |
|
|
|
|
|
|
|
|
|
|
|
между |
|
|
|
|
|
Изменение |
|
|
|
|
|
|
|
|
|
||
Название |
проте- |
Работа в |
|
теплоты, |
Теплоем- |
|||||||||||||
парамет- |
|
внутренней |
||||||||||||||||
процесса |
кания |
процессе |
|
сообщенное |
кость |
|||||||||||||
рами в |
|
энергии |
||||||||||||||||
|
процесса |
|
|
|
|
|
в процессе |
|
|
|
|
|
|
|
|
|
||
|
процессе |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Изохо- |
V = const |
P/T= const |
|
dA=0 |
|
|
dQ=CvdT |
dU=dQ |
C =m R |
|||||||||
рический |
|
|
|
A=0 |
|
|
Q=Cv(T2-T1) |
U =Q |
v |
|
μ |
|
(γ−1) |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
Изоба- |
р = const |
V/T= const |
dA=pdV |
|
dQ=CpdT |
dU=CVdT |
Cp = |
m γR |
||||||||||
рический |
|
|
|
|
|
|
|
Q=Cp(T2-T1) |
|
|
|
|
|
|||||
|
|
A=p(V2-v1) |
U=CV(T2 -T1) |
μ |
(γ−1) |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||||||||
Изотер- |
Т = const |
pV=const |
dA=pdV |
|
dQ=dA |
dU=0 |
CТ=∞ |
|||||||||||
мический |
|
|
A= |
m |
RTln |
V2 |
|
Q=A |
U=0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
μ |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
Адиаба- |
dQ = 0 |
pVγ= const |
dA=pdV=-dU |
|
dQ=0 |
dU=-dA= |
САД=0 |
|||||||||||
тический |
|
pTγ/γ-1= const |
A=- U= |
|
|
Q=0 |
=CvdT |
|
|
|
|
|
|
|
|
|
||
|
|
|
U=-A= |
|
|
|
|
|
|
|
|
|
||||||
|
VT1/γ-1= const |
=Cv(T1-T2) |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
=CV(T2 -T1) |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9 |
|||||||
2. МЕТОД РАБОТЫ
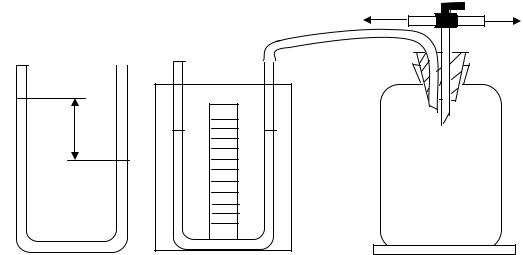
2.1. Лабораторная установка
Экспериментальная установка (рис.2.1) состоит из стеклянного балло- на достаточно большой емкости, соединенного с жидкостным U-образным манометром. Верхняя часть баллона закрыта пробкой и снабжена краном,
с помощью которого баллон сообщается с атмосферой и источником давления (в данном случае микрокомпрессором).
атмосфера
к микро-
компрессору
h
Рис. 2.1. Общий вид установки для определения величины отношения
γ =СP/CV
2.2. Метод измерения
Пусть в баллоне первоначально было атмосферное давление Pа. Если быстро повысить давление в баллоне и закрыть кран, то окончатель- ная разность уровней в манометре h1 установится не сразу (при быстром сжатии температура газа в баллоне повысится и пройдет некоторое время, пока температура воздуха в баллоне не сравняется, за счет теплопровод- ности, с температурой окружающего воздуха).
При всех дальнейших наблюдениях надо мысленно выделить в сосуде некоторую массу воздуха объемом V и рассматривать изменения, проис- ходящие только с этим количеством воздуха.
Предположим, что происходящие с газом изменения изображены на графике, выражающем зависимость P от V (рис.2.2).
Обозначим температуру окружающего воздуха То, а через Р1 – давле- ние газа внутри баллона.
10
