
- •2. Производные моносахаридов, образующиеся в организме (фосфорные эфиры, уроновые кислоты, аминосахара), их биологическое значение.
- •3. Биосинтез хс. Схема процесса. Атеросклероз и связь нарушений метаболизма хс и липопротеинов.
- •4.Минеральные вещества крови (Са, р, Na, k, Fe). Участие в обмене.
- •1. Основные этапы биосинтеза белка. Роль нуклеиновых кислот, активация ак, рабочий цикл рибосомы.
- •2. Гетерополисахариды (классы гликозаминокликанов). Строение, распространение в организме. Биологическая роль.
- •3.Структура ферментов. Активный центр. Механизм обр-ия фермент-субстратного комплекса. Аллостерические участки, их биороль.
- •4. Состав молока и роль в питании растущего ор-ма. Сравнительная оценка состава коровьего и женского молока. Преимущества естественного вскармливания.
- •1. Свойства и биолоическая роль белков. Белки как гидрофильные коллоиды. Реакция осаждения белков, использование реакций осаждения в мед.Практике. Методы очистки и разделения белков.
- •2. Переваривание и всасывание у в жкт. Возрастные особенности. Судьба всосавшихся моносахаридов.
- •3. Понятие об энергии активации. Образование фs-комплекса. Принципы количественного определения активности ф. Единицы активности.
- •4.Содержание и формы билирубина в крови. Диагностическое значение форм билирубина.
- •1. Белки как амфотерные электролиты. Механизм образования заряда. Изоэлектрическая точка белка. Св-ва б в ит.
- •2. Биосинтез и мобилизация гликогена, последовательность реакций. Биол.Роль. Регуляция активности фосфорилазы и гликогенсинтетазы.
- •3.Основные сведения о кинетике ферментативных реакций. Факторы влияющие на скорость р-ий.
- •4. Содержание глюкозы в крови. Возрастные особенности.
- •1.Гидролиз белков. Методы, условия, продукты гидролиза. Определение степени гидролиза. Использование гидролизатов в медицине.
- •2. Анаэробный распад глюкозы. Последовательность р-ий, локализация. Биологическая роль.
- •3. Стероидные гормоны, представители. Механизм действия. Особенности биосинтеза стероидных гормонов.
- •4. Содержание белков в плазме крови, возрастные особенности.
- •2. Роль анаэробного и аэробного распада глюкозы в мышцах. Судьба молочной кислоты.
- •3. Кофакторы и их связь с витаминами. Типичные примеры.
- •4. Содержание остаточного азота в крови. Компоненты остаточного азота.
- •1. Белки. Классификация б. Характеристика сложных б. Хромопротеины, классификация, строение, распространение.
- •2. Аэробное окисление у, схема процесса. Образование пвк из глю, последовательность р-ий. Челночный механизм транспорта водорода.
- •3. Регуляция активности ф. Аллостерические механизмы, ограниченный протеолиз, хим.Модифиация ферментов. Биологическая роль регуляции активности ф.
- •4. Возврастные особенности состава крови (белки, остаточный азот, глюкоза).
- •1. Нуклеопротеины. Современные представления о структуре и функциях нуклеиновых кислот. Продукты их гидролиза.
- •2. Окислительное декарбоксилирование пвк. Последовательность реакций, связь с дыхательной цепью.
- •3. Активаторы и ингибиторы ферментов. Типы ингибирования. Применение ингибиторов в качестве лекарственных средств.
- •4. Минеральные вещества крови. Распределение между плазмой и эритроцитами.
- •1. Днк. Первичная, вторичная и третичная структуры. Биологическая роль днк.
- •2. Цикл трикарбоновых кислот, последовательность реакций, связь с дыхательной цепью. Биологическое значение.
- •3. Классификация ферментов. Важнейшие представители основных классов.
- •4. Содержание Са и р в плазме крови.
- •1. Рнк. Первичная и вторичная структура. Типы рнк, особенности строения, локализация в клетке. Биологическая роль.
- •2. Строение коэнзима а, участие в обмене веществ.
- •3. Энергетический обмен. Стадии катаболизма б, л, у. Источники восстановительных эквивалентов для электрон-транспортной цепи. Роль митохондрий в окислении водорода.
- •4. Изменение содержания белков, остаточного азота, глюкозы при заболеваниях.
- •1. Гликопротеины. Их строение, классификация, представители. Биологическая роль.
- •2. Пентозофосфатный путь окисления глюкозы, основные этапы процесса. Биологическое значение цикла. Наследственные нарушения.
- •3. Митохондриальная цепь окисления кислорода. Образование электрохимического трансмембранного потенциала, его использование.
- •4. Анализ желудочного сока.
- •1. Липопротеины. Их строение, классификация. Состав и функции липопротеинов крови.
- •2. Роль печени в обмене углеводов. Глюконеогенез, субстраты для синтеза, схема реакций.
- •3. Тканевое дыхание, последовательность реакций. Продукция энергии в дыхательной цепи.
- •4. Формы кислотности желудочного сока.
- •1. Хромопротеины, их строение, биологическая роль. Основные представители хромопротеинов.
- •2. Поддержание постоянства глюкозы в крови. Источники и пути расходования глюкозы в крови. Гипо- и гипергликемия, причины их возникновения.
- •3. Надн-оксидазная система: надн-зависимые дегидрогеназы, флавиновые дг, железосеоцентры. Строение, их роль в транспорте электронов.
- •4. Возрастные особенности желуд сока.
- •1. Заменимые и незаменимые ак. Потребность ор-ма в б в зависимости от возраста. Белковый минимум. Формы баланса азота в организме. Возрастные особенности.
- •2. Биосинтез глюкозы (глюконеогенез). Возможные предшественники, последовательность реакций. Глюкозолактатный цикл (цикл Кори). Физиологическое значение.
- •3. Цикл кислорода дыхательной цепи. Цитохромоксидаза, строение, биологическая роль.
- •4.Физико-химические показатели мочи. Возрастные особенности.
- •1. Переваривание белков в жкт. Промежуточные и конечные продукты гидролиза белков. Использование амк в тканях.
- •2. Сахарный диабет. Характер нарушений обменных процессов при сах.Диабете. Нарушение уранатного пути использования глюкозы как основа нарушений структуры гликозаминогликанов.
- •3. Образование макроэргических соединений в цепи тканевого дыхания. Характеристика процесса с помощью коэффициента р/о. Разобщение окисления и фосфорилирования в дых.Цепи.
- •4. РН мочи в норме и при патологии.
- •1. Процессы превращения аминокислот в толстом кишечнике под влиянием гнилостных бактерий. Обзвреживание проуктов гниения.
- •2. Наследственные нарушения обмена моносахаридов и дисахаридов: галактоземия, фруктоземия, непереносимость дисахаридов. Гликоген- и агликогенозы
- •3. Окислительное и субстратное фосфорилирование в процессе биологического окисления.
- •4. Пигменты мочи и их происхождение.
- •2. Современные данные об активных формах углеводов, жирных кислот и аминокислот.
- •3. Надн – оксидазная система: убихинон, цитохромы. Строение, их роль в транспорте электронов
- •4.Органические вещества мочи, их происхождение.
- •1. Роль нуклеиновых кислот в биосинтезе белка. Характеристика генетического кода. Строение и роль т-рнк.
- •2.Взаимосвязь белкового, углеводного и липидного обменов. Роль ключевых метаболитов глюкозо-6-фосфатов, пировинограной кислоты и ацетил-КоА.
- •3. Образование со2 в процессах биологического окисления. Типы декарбоксилирования в цтк.
- •4. Азотсодержащие вещества мочи. Возрастные особенности.
- •1.Основные этапы биосинтеза белков (активация амк, фазы трансляции, участие рибосом).
- •2. Липиды, классификация и распространение. Химическая природа, свойства и биол.Роль триацилглицеридов.
- •3. Микросомальное и митохондриальное окисление. Сходства и различия. Пути использования кислорода. Токсичность кислорода. Механизмы защиты.
- •4. Содержание мочевой кислоты в крови. Причины гиперурикемии.
- •1.Современные представления о регуляции биосинтеза белка. Регуляция действия генов. Строение и функционирование лактозного оперона. Индукция и репрессия синтеза белков в организме человека.
- •2.Классификация глицеролипидов, хим строение и биологическая роль в организме
- •3. Витамины и их значение в жизнедеятельности человека. Классификация. Участие в обмене веществ.
- •4. Индикан мочи,значение исследования.
- •1.Процессы образования конечных продуктов обмена простых белков. Основные источники аммиака. Роль глутамина в оезвреживании аммиака и синтезе ряда соединений(как донор амидной группы).
- •2.Депонирование и мобилизация жиров в жировой ткани, физиологическое значение. Транспорт и использование жрных кислот, образующихся при мобилизации жиров. Биосинтез и использование кетоновых тел.
- •3.Витамин рр. Химическая природа. Растпространение, участие в обменных процессах.
- •4.Способы определения белка в моче.
- •1. Распад пуриновых и пиримидиновых азотистых оснований. Конечные продукты. Пути выведения.
- •2. Желчные кислоты, строение. Свойства. Участие в переваривании и всасывании липидов. Конъюгация желчных кислот, биологическая роль.
- •Транспорт
- •3. Гомополисахариды (крахмал и гликоген). Химическое строение, свойства. Особенности распада в желудочно-кишечном тракте и тканях.
- •4. Нервная ткань. Химический состав, особенности обмена. Возрастные особенности.
- •1. Хромопротеины, их строение, биологическая роль. Основные представители хромопротеинов.
- •Хромопротеины
- •2. Аэробное окисление углеводов, схема процесса. Образование пировиноградной кислоты из глюкозы, последовательность реакций. Челночные механизмы транспорта водорода.
- •3. Гормоны половых желез. Химическое строение и участие в обменных процессах.
- •4. Индикан мочи, происхождение, диагностическая роль.
4. Индикан мочи,значение исследования.
Индикан. Индол по воротной вене попадает в печень, где подвергается обезвреживанию путем связывания с серной кислотой, в результате чего образуется животный индикан. Реакцию катализирует ФАФС - 3-фосфоаденозин-5-фосфосульфат. В норме в крови индикан составляет 1,19-3,18 мкМ/л, в моче обычными методами не определяется, т.к. ниже 0,47 мМ в сутки.
Определение уровня индикана в сыворотке является важным показателем недостаточности функции почек. При хронических нефритах увеличение содержания индикана в крови точнее отражает степень почечной недостаточности, чем сведения о мочевине и остаточном азоте. Содержание индикана повышается при запорах, кишечной непроходимости, усиленном распаде белков (опухоли, эмпиема, бронхоэктатическая болезнь, абсцессы). В моче индикан выявляется при кишечной непроходимости, перитоните, гангрене, туберкулезе, раке желудка, брюшном тифе.
Билет№21
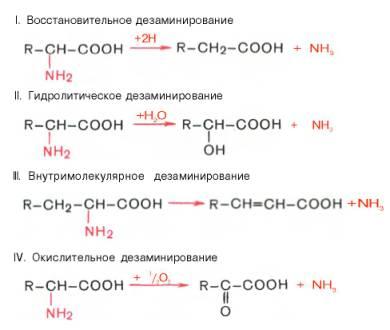
Основные типы превращений аминокислот в тканях(дезаминирование, трансаминирование. декарбоксилирование)
1)Дезаминирование. 4 вида. Во всех случаях аминая группа АК осв.в виде аммиака:
 Продукты:
жир.к-ты, оксик-ты, непред.АК, кеток-ты.
Продукты:
жир.к-ты, оксик-ты, непред.АК, кеток-ты.
Первая стадия окислительного дезаминирования(в тканях только это!) предполагает ок-е АК путем дегидрирования. В тканях при физиологич.знач.рН(7,3-7,4) активна только 1 L-оксидаза – глутамат-ДГ;ее небелковым компонентом является НАД или НАДФ. Оксидазы остальных АК активны только про рН=10, а при этом они неактивны.(в кач.небелк.компонента имеют ФМН) – прямому ок-ному дезаминированию подверг.только глутамат.
Непрямое дезаминирование.
Трансаминирование
АК + альфа-КГ аминотрансфераза, вит.В6альфа-кеток-та + глутамат
Механизм: 1. АК+ФП альфа-кетокта + ФП-амин
ФП-амин + альфа-КГ ФП +глутамат
Аминотрансферазы облад.субстратной специфичностью:
Ала+-КГ АЛТ, В6 ПВК / глутамат
Аспартат +-КГ АСТ, В6 оксалоацетат +глутамат
Декарбоксилирование
α-Декарбоксилирование, характерное для тканей животных, при котором от аминокислот отщепляется карбоксильная группа, стоящая по соседству с α-углеродным атомом. Продуктами реакции являются СО2 и биогенные амины:
![]()
ω-Декарбоксилирование, свойственное микроорганизмам. Например, из аспарагиновой кислоты этим путем образуется α-аланин:
![]()
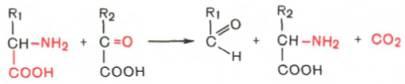
Декарбоксилирование, связанное с реакцией трансаминирования:
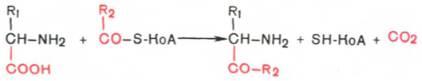
Декарбоксилирование, связанное с реакцией конденсации двух молекул:
Реакции декарбоксилирования в отличие от других процессов промежуточного обмена аминокислот являются необратимыми. Они катализируются специфическими ферментами – декарбоксилазами аминокислот
Стерины, стериды, их представители. Биологическая роль холестерина как предшественника других стеринов.
СТЕРИНЫ (стеролы), алициклич. прир. спирты, относящиеся к стероидам; составная часть неомыляемой фракции животных и растит.липидов.
Стерины присутствуют практически во всех тканях животных и растений и являются наиб. распространенными представителямистероидов в природе. В зависимости от источника подразделяются на животные (зоостерины), растительные (фитостерины), стерины грибов (микостерины) и микроорганизмов.
Холестерин (cholesterol)- Тетрациклический ненасыщенный спирт из класса стероидов, важнейший представитель стеринов, являющийся в организме предшественником желчных кислот, кортикостероидов, половых гормонов, кальциферола и т.д. Нарушение обмена холестерина лежит в основе ряда генетически обусловленных заболеваний.
Длястеринов характерно наличие гидроксильной группы в положении 3, а также боковой цепи в положении 17. У важнейшего представителя стеринов – холестерина – все кольца находятся в транс-положении; кроме того, он имеет двойную связь между 5-м и 6-м углероднымиатомами. Следовательно, холестерин является ненасыщенным спиртом:
Каждая клетка в организме млекопитающих содержит холестерин. Находясь в составе мембран клеток, неэтерифицированныйхолестерин вместе с фосфолипидами и белками обеспечивает избирательную проницаемость клеточной мембраны и оказывает регулирующее влияние на состояние мембраны и на активность связанных с ней ферментов. В цитоплазме холестерин находится преимущественно в виде эфиров с жирными кислотами, образующих мелкие капли – так называемые вакуоли. В плазме крови как неэтерифицированный, так и этерифицированный холестерин транспортируется в составе липопротеинов.
Холестерин – источник образования в организме млекопитающих желчных кислот, а также стероидных гормонов (половых и кортикоидных). Холестерин, а точнее продукт его окисления – 7-дегидрохолестерин, под действием УФ-лучей в коже превращается в витамин D3.
Холестерин находится в животных, но не в растительных жирах. В растениях и дрожжах содержатся близкие по структуре к холестерину соединения, в том числе эргостерин.
Эргостерин – предшественник витамина D. После воздействия на эрго-стерин УФ-лучами он приобретает свойство оказывать противорахитное действие (при раскрытии кольца В).
Восстановление двойной связи в молекуле холестерина приводит к образованию копростерина (копростанола). Копростерин находится в составе фекалий и образуется в результате восстановления бактериями кишечной микрофлоры двойной связи в холестерине междуатомами С5 и С6
Указанные стерины в отличие от холестерина очень плохо всасываются в кишечнике и потому обнаруживаются в тканях человека в следовых количествах.Стериды - сложные эфиры высших жирных кислот со стеринами.
Витамин С. Химическая природа, распространение. участие в обменных процессах.
Водорастворимый. Антискорбутный/аскорбиновая кислота. Сут.потр. 75-120мг. Салат, капуста, укроп, черная смородина, шиповник, картофель.
Биологич.роль: окисление НАДН. Участиев ОВР, р.гидроксилирования пролина, лизина, при синтезе коллагена, гормнов коры надпочечников, трп; синтез катехоламинов(адренал). Антиоксидант: блокир.своб.радикалы. В обмене железа, включ.его в трансферрин. Образование желч.кислот.
Авитаминоз:поражение сосудистой стенки, опорных тканей; уменьш.массы тела, общая слабость, одышка, цинга. Скорбут. Гнойные воспаления.
Парные соединения мочи.
микробные ферменты кишечника вызывают постепенное разрушение боковых цепей циклических аминокислот, в частноститирозина и триптофана, с образованием ядовитых продуктов обмена – соответственно крезола и фенола, скатола и индола.
После всасывания эти продукты через воротную вену попадают в печень, где подвергаются обезвреживанию путем химического связывания с серной или глюкуроновой кислотой с образованием нетоксичных, так называемых парных, кислот (например, фенолсернаякислота или ска-токсилсерная кислота). Последние выделяются с мочой.
Индол (как и скатол) предварительно подвергается окислению в индоксил (соответственно скатоксил), который взаимодействует непосредственно в ферментативной реакции с ФАФС или с УДФГК. Так, индол связывается в виде эфиросерной кислоты. Калиевая соль этой кислоты получила название животного индикана, который выводится с мочой. По количеству индикана в моче человека можно судить не только о скорости процесса гниения белков в кишечнике, но и о функциональном состоянии печени. О функции печени и ее роли в обезвреживании токсичных продуктов часто также судят по скорости образования и выделения гиппуровой кислоты с мочой после приема бензойной кислоты
Билет№22
Непрямое дезаминирование аминокислот, биологическое значение. Роль глутаматдегидрогеназы. Виды аминотрансфераз, их специфичность.
Непрямое дезаминирование.
1)Трансаминирование
АК + альфа-КГ аминотрансфераза, вит.В6альфа-кеток-та + глутамат
Механизм: 1. АК+ФП альфа-кетокта + ФП-амин
ФП-амин + альфа-КГ ФП +глутамат
Аминотрансферазы облад.субстратной специфичностью:
Ала+-КГ АЛТ, В6 ПВК / глутамат
Аспартат +-КГ АСТ, В6 оксалоацетат +глутамат
2)окислительное дезаминирование глутамата
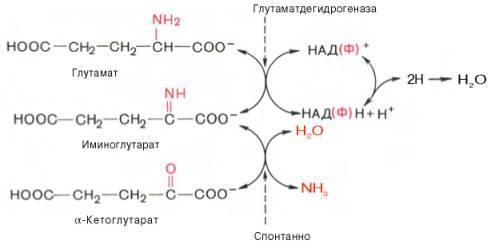
Роль: - синтез заменимых АК
- Т-первая реакция непрямого дезаминирования с образованием кетокислот, к-рые используются на гюконеогенез, или окисляются в ЦТК
- р.обратимы;их можно рассм.как р.анаболизма, так и катаболизма.
В тканях при физиологич.знач.рН(7,3-7,4) активна только 1 L-оксидаза – глутамат-ДГ;ее небелковым компонентом является НАД или НАДФ. Оксидазы остальных АК активны только про рН=10, а при этом они неактивны.(в кач.небелк.компонента имеют ФМН) – прямому ок-ному дезаминированию подверг.только глутамат.
Переваривание и всасывание простых и сложных липидов в ЖКТ. Возрастные особенности.
Витамин В1. Химическая природа, распространение, участие в обменных процессах.
Водорастворимый.
Антиневритный/тиамин.
![]() Сут.потребность
1,2-2,2мг. Растительная пища, дрожжи,
пшенич.хлеб, хлеб.злаки, соя, фасоль,
горох, печень, почки, могз. Активная
форма – тиаминпирофосфат.
Сут.потребность
1,2-2,2мг. Растительная пища, дрожжи,
пшенич.хлеб, хлеб.злаки, соя, фасоль,
горох, печень, почки, могз. Активная
форма – тиаминпирофосфат.
В форме ТПФ входит в состав 4 ферментов, участвующих в промежут.обмене веществ. ТПФ входит в состав 2 сложных ферментных систем1)пируват, 2)альфа-кетоглутарат-дегидрогеназных комплексов, катализирующих окислительное декарбоксилирование ПВК и альфа-КГ кислот.
Авитаминоз: бери-бери(симптом Вернике - энцефалопатия)/синдром Вейса(поражение ССС); нарушения деятельности НС, ССС, ЖКТ. Симптомы: наруш.мотор.и секретор.ф.ЖКТ(потеря аппетита, атония кишечника); потеря памяти, галлюцинации, одышка, сердцебиение, боли в обл.сердца, далее дегенеративые изменения нерв.окончаний и проводящих пучков, контрактуры, параличи;сердец.недостаточность.
Минеральные вещества мочи.
В моче содержатся практически все минеральные вещества, которые входят в состав крови и других тканей организма. Из 50–65 г сухого остатка, образующегося при выпаривании суточного количества мочи, на долю неорганических компонентов приходится 15–25 г.
Ионы натрия и хлора. В норме около 90% принятых с пищей хлоридов выделяется с мочой (8–15 г NaCl в сутки). При ряде патологических состояний (хронический нефрит, диарея, острый суставной ревматизм и др.) выведение хлоридов с мочой может быть снижено. Максимальная концентрация ионов Na+и Сl– (в моче по 340 ммоль/л) может наблюдаться после введения в организм больших количеств гипертонического раствора.
Ионы калия, кальция и магния. Многие исследователи считают, что практически все количество ионов калия, которое имеется в клубочковом фильтрате, всасывается обратно из первичной мочи в проксимальном сегменте нефрона. В дистальном сегменте происходит секреция ионов калия, которая в основном связана с обменом между ионами калия и водорода. Следовательно, обеднениеорганизма калием сопровождается выделением кислой мочи.
Ионы Са2+ и Mg2+ выводятся через почки в небольшом количестве (см. табл. 18.1). Принято считать, что с мочой выделяется лишь около 30% всего количества ионов Са2+ и Mg2+, подлежащего удалению из организма. Основная масса щелочноземельных металловвыводится с калом.
Бикарбонаты, фосфаты и сульфаты. Количество бикарбонатов в моче в значительной мере коррелирует с величиной рН мочи. При рН 5,6 с мочой выделяется 0,5 ммоль/л, при рН 6,6 – 6 ммоль/л, при рН 7,8 – 9,3 ммоль/л бикарбонатов. Уровень бикарбонатовповышается при алкалозе и понижается при ацидозе. Обычно с мочой выводится менее 50% всего количества выделяемых организмомфосфатов. При ацидозе выведение фосфатов с мочой возрастает. Повышается содержание фосфатов в моче при гиперфункции паращитовидных желез. Введение в организм витамина D снижает выделение фосфатов с мочой.
Серосодержащие аминокислоты: цистеин, цистин и метионин – являются источниками сульфатов мочи. Эти аминокислотыокисляются в тканях организма с образованием ионов серной кислоты. Общее содержание сульфатов в суточном количестве мочиобычно не превышает 1,8 г (в расчете на серу).
Аммиак. Как отмечалось, существует специальный механизм образования аммиака из глутамина при участии фермента глутаминазы, которая в большом количестве содержится в почках. Аммиак выводится с мочой в виде аммонийных солей. Содержание последних вмоче человека в определенной степени отражает кислотно-основное равновесие. При ацидозе их количество в моче увеличивается, а при алкалозе снижается. Содержание аммонийных солей в моче может быть снижено при нарушении в почках процессов образованияаммиака из глутамина.
Билет№23
Образование и обезвреживание аммиака. Биосинтез мочевины, последовательность реакций. Роль печени в мочевинообразовании. Возрастные особенности.
Источники аммиака:
1)дезаминирование АК(в тканях и кишечнике)
2)дезаминирование аминов
3)дезаминирование азотистых оснований
Аммиак в крови – 12-65мкмоль/л(10-120мкг%), в моче – 35,7 – 71,4ммоль/сут(0,5-1,0г)
Аммиак исключительно токсичен.
Обезвреживание:
1)образование амидов(локально)
Гутамат + NH3,NH4+,АТФ, магний++, глутамин-синтетазаглутамин +АДФ +Фн
Глутаминпочки( –аммиак, глутаминаза) Глутамат -аммиак2аммоний+аммониогенез
альфа-КГ
печень, синтез мочевины
синтез пуринов, пиримидинов.
2)восстановительное аминирование
А. альфа-КГ (глутаматДГ, аммоний, 2Н, НАДФ)глутамат, Н2О, НАДФН
Б. глутамат + ПВК (трансаминирование)альфа-КГ +ала
3)образование аммонийных солей
4)синтез мочевины.
Судьба всосавшихся простых и сложных липидов. Жировые депо. Липотропные вещества и их роль.
Витамин В2. Химическая природа, распространение, участие в обменных процессах.
Рибофлавин/лактофлавин(из молока)/гепатофлавин(из печени)/овофлавин(из белка яиц)/вердофлавин(из растений)
Потребность – 1,7мг – взрослые. Увеличивается в пожилом возр.и при тяжелой физич.нагрузке. Дрожжи, хлеб, семена злаков, яйца, молоко, мясо, свежие овощи.
Актив.форма – флавинадениндинуклеотид ФАД, ФМН(моно-).
Вход.в состав флавин.коферментов; ФМН и ФАД(просетич.группа ферментов-флавопротеидов), р.дегидрирования, биологическое окисление.
Авитаминоз: остановка роста, выпадение волос(алопеция); воспалит.процессы полости рта, слиз.об.языка(глоссит), губ, углов рта, эпителия кожи. Кератиты глаз, катаракта; общая мышечная слабость и слабость сердечной мышцы.
Реакции на патологические составные части мочи(белок. глюкоза, кровь, ацетоновые тела). Методы экспресс-диагностики.
На белок:
с сульфосалицил.к-той(выпад.хлопьеобраз.осадок)
с ТХУ =//=
с азотной кислотой (кольцо помутнения)
кол-венное определение нефелометрическим методом – степень помутнения р-ра(при взаимод.с ТХУ) пропорциональна концентрации белка. показания на ФЭКе.
На глю:
р. Ниляндера (черный осадок висмута)
р. Фелинга (красный осадок закиси меди)
метод Альтгаузена – полуколичественный – нагревание глю с 10%NaOH- деструкция глю с образованием окраш.продуктов(окраска от желтой до коричневой)
На кровь:
Бензидиновая р. (сине-зеленое окраш.)
На кетоновые тела:
р. Легаля (оранжево-красное окрашивание, переходящее в вишневое)
Экспресс-методы:
проба на присутствие глю в моче
Метод основан на р.Фелинга. На предмет.стекло щепотку смеси сернокислой меди и углеродистого натрия. На порошок 2 кап исследуемой мочи и слегка подогрев на спиртовке. Изменеие окраски: от голубого(отсутствие), до кирпично-красного (4%и более)
экспресс-анализ на присутствие ацетоновых тел
Основан на р.с нитропруссидом натрия. Поместить на полоску филтров.бумаги таблетку или щепотку реактив.порошка(сернокислый аммоний, углекислый натрий и нитропруссид натрия), +2 кап мочи. Через 2 мин окраску сравнить со шкалой. Цвет не меняется – отсутствие кет.тел. Наличие – цвет от розового до фиолетового.
Билет№24
