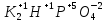- •Ступко т.В.
- •Введение
- •Методические рекомендации
- •1. Основные понятия химии
- •«Масса веществ, вступивших в химическую реакцию, равна массе веществ, образующихся в результате реакции».
- •Номенклатура неорганических соединений
- •1 ‑ Моно 4‑ тетра 7 – гепта 10 ‑ дека
- •Названия одноатомных катионов
- •Названия многоатомных катионов
- •Традиционные названия кислот и кислотных остатков
- •Структурные формулы некоторых веществ
- •Общие химические свойства основных классов неорганических веществ
- •Изменение цвета индикаторов в растворах
- •Основные способы получения солей
- •Строение вещества
- •2.1. Строение атома.
- •Характеристики основных элементарных частиц атома
- •Возможные значения квантовых чисел
- •Заполнение электронами электронных орбиталей многоэлектронных атомов
- •Сопоставление разных типов радиусов натрия и хлора
- •Периодический закон и периодическая система элементов д.И.Менделеева
- •Молекулы, кристаллы, химическая связь
- •Длина химической связи. При образовании химической связи всегда происходит сближение атомов ‑ расстояние между ними меньше, чем сумма радиусов изолированных атомов:
- •Длины некоторых простых и кратных связей
- •Энергии некоторых простых и кратных связей
- •Зависимость структуры ионного кристалла от величины ионных радиусов
- •Поляризация ионов
- •Тип гибридизации и геометрия молекулы
- •Полярность ковалентной связи
- •Температуры кипения водородных соединений элементов VI a группы
- •Учение о химическом процессе
- •3.1. Элементы химической термодинамики
- •Контрольные вопросы13
- •Кинетика. Химическое равновесие.
- •Кинетика гетерогенных химических реакций
- •Каталитические процесс.
- •Сложные реакции
- •4. Химические процессы в растворах
- •Растворы неэлектролитов.
- •Растворы электролитов. Теория электролитической диссоциации.
- •Ионизация воды .РН растворов
- •Растворимость малорастворимых электролитов. Произведение растворимости.
- •Ионные реакции в растворе
- •Гидролиз солей
- •Контрольные вопросы19
- •Окислительно-восстановительные процессы
- •Примеры окислителей и восстановителей
- •Классификация окислительно-восстановительных реакций
- •Критерий протекания окислительно-восстановительных реакций. Электродный потенциал
- •I полуэлемент мостик kCl II полуэлемент
- •Виды химических источников тока
- •4.3. Реакции комплексообразования
- •Номенклатура комплексных соединений
- •Тип гибридизации электронных орбиталей комплексообразователя и структура комплексного соединения
- •Изомерия комплексных соединений
- •Основные типы комплексных соединений
- •Устойчивость комплексных соединений в растворе
- •Контрольные вопросы26
- •Заключение
- •Список рекомендуемой литературы
- •Содержание
Контрольные вопросы19
Какие системы называются «растворы»?
Какие растворы называются истинными?
Сформулируйте определение «растворимость вещества».
Какие способы выражения концентрации раствора вы знаете?
Дайте определение «Массовая доля растворённого вещества».
Дайте определение «Молярная концентрация».
Дайте определение «Моляльная концентрация».
Дайте определение «Мольная концентрация эквивалента, «нормальность». Дайте определение первого закона Рауля.
Дайте определение второго закона Рауля.
Какие вещества называются неэлектролитами?
Какие вещества называются электролитами?
Какой процесс называется осмосом?
Каковы основные положения теории электролитической диссоциации?
Дайте определение понятию «рН растворов».
Дайте определение понятию «Произведение растворимости».
Какой процесс называется гидролиз солей?
Окислительно-восстановительные процессы
Реакции, идущие с изменением степени окисления элементов, называются окислительно-восстановительными (ОВР).
Степень окисления – это заряд, который имел бы атом, если бы все образованные им полярные связи в молекуле были ионными. Если связи действительно ионные, то степень окисления совпадает с зарядом элементарного иона, например K+F-. Если не все связи ионные, то степень окисления – это условное понятие.
Наиболее электроотрицательные элементы в соединении имеют отрицательные степени окисления, а атомы элементов с меньшей электроотрицательностью ‑ положительные.
Расчет степени окисления
Для вычисления степени окисления элемента следует учитывать следующие положения:
Степени окисления атомов в простых веществах равны нулю (Na0; H20).
Алгебраическая сумма степеней окисления всех атомов, входящих в состав молекулы, всегда равна нулю, а в сложном ионе эта сумма равна заряду иона.
Постоянную степень окисления имеют атомы: щелочных металлов (+1), щелочно‑земельных металлов (+2), водорода (+1) (кроме гидридов NaH, CaH2 и других, где степень окисления водорода -1), кислорода (-2) (кроме фторида кислорода ‑F2O, пероксидов, надоксидов и озонидов).
Например:
|
Оксид ванадия (V) |
V2O5 |
|
|
Аммиак |
NH3 |
|
|
Тетраборат натрия |
Na2B4O7 |
|
|
Гидрофосфат калия |
K2HPO4 |
|
|
Дихромат натрия |
Na2Cr2O7 |
|
|
Пероксид натрия |
Na2O2 |
|
|
Озонид калия |
KO3 |
|
Рассмотрим примеры окислительно-восстановительных реакций:
2Mg0 + O20 → 2Mg+2O-2;
2KCl+5O3-2  2KCl-1
+
3O20;
2KCl-1
+
3O20;
2KI-1 + Cl20 → 2KCl-1 + I20;
Mn+4O2+4HCl-1→Mn+2Cl2 +Cl20 +2H2O.
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим20.
Процесс отдачи электронов называется окисление. При окислении степень окисления повышается. Атом, молекула или ион, отдающие электроны, являются восстановителем. Восстановитель в процессе реакции окисляется. Для приведенных примеров восстановители:
Mg0- 2ē → Mg+2; O-2 - 2ē → O0;
2I-1 - 2ē → I20; 2Cl-1 - 2ē → Cl2.
Процесс присоединения электронов называется восстановление: При восстановлении степень окисления понижается. Атом, молекула или ион, принимающие электроны, являются окислителем. Окислитель в процессе реакции восстанавливается. В наших примерах окислители:
O20 + 2ē → O-2 ; Cl+5+ 6ē →Cl-1;
Cl20 +2ē → 2Cl-1; Mn+4+2ē →Mn+2.
Соединения, содержащие атомы элементов с максимальной степенью окисления, могут быть только окислителями за счет этих атомов, так как они способны только принимать электроны.
Соединения, содержащие атомы элементов с минимальной степенью окисления, могут служить только восстановителями, поскольку они способны лишь отдавать электроны, потому что внешний энергетический уровень у таких атомов завершен восемью электронами.
Важнейшие восстановители и окислители представлены в таблице 14.
Таблица 14.